
Conditia termodinamica fundamentala a realizarii proceselor de reducere
Minereurile feroase ca si alte minereuri folosite in siderurgie sunt formate din oxizi sau prin prepararea lor sunt aduse la aceasta stare (cazul carbonatilor). Extragerea fierului sau a altor preparate din metale se realizeaza prin reducerea oxizilor.
Pentru reducerea minereurilor se folosesc reducatori solizi (carbon, Al, Si) si gazosi (CO, H2, CH4 si amestecuri de gaze).
Reactia generala de reducere este:
MeO + R = Me + RO ΔHR = 0; ΔGR;
unde: MeO - este oxidul supus reducerii (in general un oxid metalic);
R - reducatorul;
Me - metalul redus (sau un oxid inferior);
RO - oxidul reducatorului.
Pentru ca reactia de reducere sa poata avea loc este necesar ca ΔGR < 0. Pentru aceasta trebuie ca reducatorul R sa aiba afinitate suficient de mare fata de oxigen, mai mare decat a Me fata de oxigen.
Pentru o evaluare calitativa a acestei afinitati se folosesc reactiile de oxidare a R si Me.:
I) 2R + O2 = 2RO ΔGRO
+
II) 2Me + O2 = 2MeO /-1 ΔGMeO
|
III) 2MeO +2R = 2Me + 2R ΔGR |
Conform legii lui Hess:
ΔGR = ![]() [ ΔG2RO
- ΔG2MeO]
[ ΔG2RO
- ΔG2MeO]
Pentru ca ΔGR < 0 trebuie ca ΔG2RO < ΔG2MeO.
Conditia fundamentala a reducerii, este deci: pentru ca un reducator R sa poata reduce un oxid MeO este necesar ca entalpia libera de formare a oxidului reducator sa fie mai mica (mai negativa) decat entalpia libera de formare a oxidului MeO.
Folosind variatia standard a entalpiei libere:
ΔG![]() =
= ![]() [ ΔG2RO
- ΔG2MeO]< 0
[ ΔG2RO
- ΔG2MeO]< 0
Deoarece ΔG0 = RT ln Po2 conditia reducerii este:
![]() .
.
In cazul general:
RT ln Po2(MeO)
= ΔG![]() + 2RTln
+ 2RTln![]()
RT ln Po2(RO)
= ΔG![]() + 2RTln
+ 2RTln![]()
Deci in final pentru ca reducerea sa aiba loc trebuie ca:
[ΔG![]() + 2RTln
+ 2RTln ![]() ]T < [ΔG
]T < [ΔG![]() + 2RTln
+ 2RTln![]() ]T
]T
Pe baza acestor relatii se poate stabili in prealabil, cu ajutorul diagramei potentialelor de oxigen, daca un anumit oxid poate fi redus sau nu in conditiile preconizate.
Daca raspunsul este negativ, nu totdeauna este necesar sa se schimbe reducatorul, ci se poate actiona asupra termenului care cuprinde activitatile termodinamice ale substantelor condensate sau presiunile partiale ale componentei fazei gazoase.
De exemplu una din posibilitatile de a mari partea dreapta a inegalitatii este de a micsora aMeO. Acest procedeu se practica curent la fabricarea feroaliajelor.
Din
inegalitatea ![]() se poate obtine
relatia:
se poate obtine
relatia:
![]()
din care rezulta ca pentru a se asigura desfasurarea procesului de reducere la o anumita temperatura este necesar ca tensiunea de disociere a oxidului reducatorului la aceea temperatura sa fie mai mica sa fie mai mica decat tensiunea de disociere a oxidului supus reducerii.
Pentru estimari de acest fel se poate folosi diagrama de variatie a tensiunii de disociere a oxizilor cu temperatura (fig. 3.1).
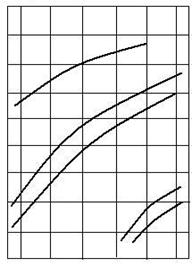
lgP![]() ,+4
,+4
atm 0
-4 Fe2O3
-8 Fe3O4
Fig. 3.1. Variatia tensiunii de disociere a oxizilor cu temperatura
-12 FeO
-16
-20
-24 MgO
-28 CaO
-30
600 1000 1400 1600 T,sC
Toate aceste concluzii sunt minimale si asigurarea lor conduce la concluzia ca reactia de reducere este in principiu posibila.
Pentru ca reactia sa aiba loc cu viteza suficienta, pana la epuizarea oxidului MeO trebuie asigurat un exces de reducator
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |