CENTRUL ACTIV AL ENZIMELOR
In general masa moleculara a enzimelor este mult superioara maselor moleculare ale substratelor lor,acestea reprezentand cel mult 1% din masele moleculare ale enzimelor ce catalizeaza transformarea lor.Plecand si de la faptul ca multe enzime sunt heteroproteine, iar cofactorul enzimatic este implicat in actul catalitic s-a emis urmatorul postulat asupra realizarii procesului catalitic " Activitatea catalitica este realizata de o regiune mica din enzima , geometric discreta, numita centrul activ sau situs catalitic"
Structura centrului activ este diferita de la o enzima la alta si depinde in mare masura de structura macromoleculei enzimatice.
- La enzimele monocomponente , a caror molecula este formata exclusiv din catene polipeptidice ,centrul activ este alcatuit din resturi de aminoacizi localizate in zone diferite ale catenei polipeptidice .
Ex. Muramidaza este o enzima a carei molecula este reprezentata de o singura catena polipeptidica ce contine 129 resturi de aminoacizi.Centrul activ este format din resturile Glu35 si Asp52. Chimiotripsina ,a carei molecula contine trei catene polipeptidice formate din 242 resturi de aminoacizi, centrul activ este alcatuit din resturile His 57 si Ser 195 dintr-o catena si Asp102 din alta catena polipeptidica.
- In cazul enzimelor bicomponente ,cofactorul enzimatic face parte integranta din structura centrului activ fie singur, fie impreuna cu alte resturi de aminoacizi. Ex. La carboxipeptidaza A ,care este o metaloenzima, situsul catalitic contine ionul Zn2+ si resturile de aminoacizi Arg145, Tyr248 si Glu270,apoenzima fiind alcatuita din 300 resturi de aminoacizi.
In functie de rolul jucat in procesul catalitic ,resturile de aminoacizi se clasifica astfel:
- grupari de contact - resturi de aminoacizi implicate direct atat in fixarea substratului in vederea formarii complexului enzima-substrat (ES) cat si in realizarea actului catalitic.
-grupari conformationale- resturi de aminoacizi care nu fac parte din centrul activ,deci neimplicate direct in procesul catalitic,dar care asigura o conformatie spatiala caracteristica fiecarei enzime si necesara realizarii procesului catalitic.
- grupari auxiliare- resturi de aminoacizi cu anumite proprietati fizico-chimice ( hidrofile, hidrofobe ) ,cu rol in cataliza dar fara sa participe direct in legarea substratului.
- grupari indiferente- aminoacizi ce nu participa in nici un fel la realizarea procesului catalitic , ele putand fi clivate sau inlocuite fara pierderea activitatii enzimatice.Aceste grupari confera enzimelor anumite proprietati ( soubilitate, stabilitate etc.).
Studiind cinetica reactiilor enzimatice , Michaelis si Menten propun urmatoarea formulare a reactiilor enzimatice cu un singur substrat:
![]()
![]() S + E ES P+
E
S + E ES P+
E
Autorii postuleaza ca reactiile enzimatice decurg in doua etape.
- in prima etapa are loc interactiunea reversibila dintre enzima si substratul sau cu formarea unui complex binar ES denumit complex Michaelis, instabil deoarece se transforma fie pe cale inversa regenerand substratul si enzima, fie cu formarea produsului de reactie si regenerarea catalizatorului. Pentru formarea acestui complex ,intre enzima si substratul sau pot lua nastere urmatoarele tipuri de legaturi:
1) legaturi coordinative - realizate prin punerea in comun a electronilor neparticipanti de oxigen si azot din apoenzima,fiind cele mai puternice legaturi.
2) legaturi de hidrogen - intre atomii de hidrogen si atomii cu caracter electronegativ,mai ales cei de oxigen si azot.
3) atractii electrostatice - iau nastere datorita existentei unei grupe functionale libere ce ionizeaza la pH fiziologic.
4) interactiuni hidrofobe - la formarea lor participa apoenzimele prin resturile aminoacizilor aromatici sau alifatici cu catena lunga.
5) transferul de sarcina - se realizeaza atunci cand substratul si enzima poseda structuri bogate si respectiv sarace in electroni.
CENTRUL ALOSTERIC. ENZIME ALOSTERICE.
Initial ,termenul de alosterie era atribuit fenomenului de modificare a conformatiei unei enzime ca urmare a interactiunii sale cu o anumita substanta,legarea avand loc intr-o zona diferita de centrul activ.Clarificarea deplina a notiunii a fost posibila datorita cercetarilor privind reglarea activitatii enzimelor in vivo, una din principalele particularitati ale transformarilor biochimice. Aceste transformari reprezinta succesiuni de reactii care alcatuiesc o cale sau secventa metabolica.
E1 E2 E3 E4
![]()
![]() S P1 P2 . P
S P1 P2 . P
![]()
![]()
Rezulta ca produsul de reactie ce rezulta sub actiunea enzimei E1 reprezinta substratul enzimei E2 s.a.m.d. iar produsul final P este considerat produsul caii metabolice. Daca produsul final se acumuleaza intr-o cantitate mai mare decat cea fiziologic normala,el inhiba activitatea enzimei E1si intreaga cale este stopata.Acest tip de inhibitie se numeste retroinhibitie sau inhibitie de tip feed back si are loc in urma interactiunii produsului final P cu o zona din geometria enzimei E1 distincta de centrul activ, zona numita centru alosteric.
In momentul in care concentratia produsului final scade, enzima E1 este dezinhibata ,iar secventa se reia. Aceasta proprietate o au mai ales enzimele ce catalizeaza prima reactie dintr-o secventa metabolica si se numesc enzime alosterice.
Proprietati comune ale enzimelor alosterice:
- prezinta structura cuaternara
- nu respecta, de regula, cinetica Michaelis-Menten
- pot suferii modificari conformationale fara pierderea actvitatii catalitice
- joaca, in general, un rol de reglare a metabolismului
Exemple de enzime alosterice:
Aspartat-transcarbamilaza din Escherichia coli ce catalizeaza reactia:
| | | |
O=C + CH ----- ----- ----------------- O=C CH
| | N COOH
O- P CH H PO |
/ H
H N COOH
carbamoil-fosfat aspartat carbamoil-aspartat
![]()
![]()
Aceasta este prima reactie dintr-o cale metabolica de biosinteza a nucleotidelor pirimidinice. Prin introducerea in mediul de fermentatie a unei anumite cantitati de CTP se obtine blocarea activitatii aspartat-transcarbamilazei in timp introducerea de AMP sau ATP determina activarea enzimei.
Pentru elucidarea cineticii acestei reactii s-au efectuat experimente complexe prin crearea diferitelor conditii de reactie in medii de incubare cu compozitie diferita.S-a observat ca aspartat-transcarbamilaza este modulata de anumite semnale chimice care permit ajustarea activitatii sale in functie de necesitatile de moment ale celulei. Un exces de CTP inhiba enzima evitandu-se o supraproductie de nucleotide pirimidinice, in timp ce UTP-ul anuleaza acest efect.Fenomenul de retroinhibitie exercitat de produsul final este posibil datorita existentei centrului alosteric in structura aspartat-transcarbamilazei.
Transcarbamilaza poate exista sub doua forme conformationale din care una(T) este mai putin activa,iar cealalta( R ) este foarte activa.
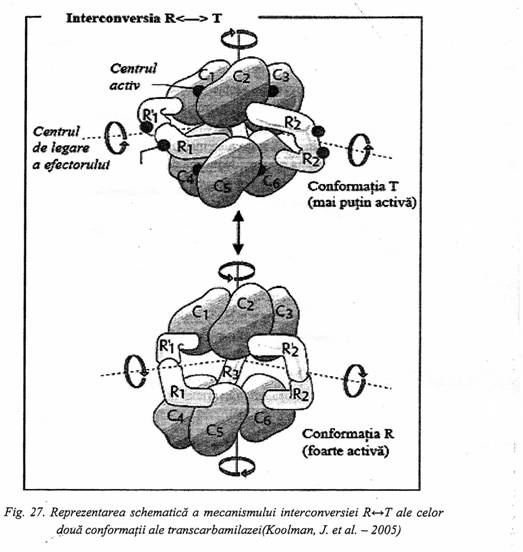
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |