
Echilibru chimic. Legea echilibrului chimic
In sistem izolat :
a) Evolutie spre o stare de repaus chimic,
b) printr-o reactie totala sau completa
![]() 2Na + 2H2O 2NaOH + H2
2Na + 2H2O 2NaOH + H2
b) Nici-o evolutie (stari metastabile)
N2 + O2 ; H2 + O2 ; H2 + Cl2
c) Evolutie spre o stare de echilibru, printr-o reactie inversibila sau de echilibru
![]()
![]()
![]() CH3COOH + C2H5OH C2H5COOCH3 + H2O
CH3COOH + C2H5OH C2H5COOCH3 + H2O
t = 0 1 mol 1 mol 0 moli 0 moli
t = t1 0,8 0,8 0,2 0,2
t = ti 0,33 0,33 0,67 0,67
t = te 0,33 0,33 0,67 0,67
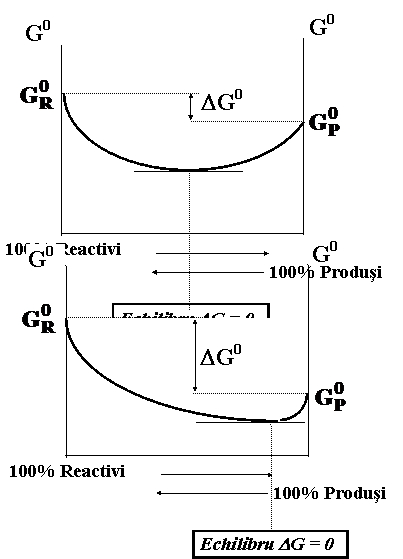
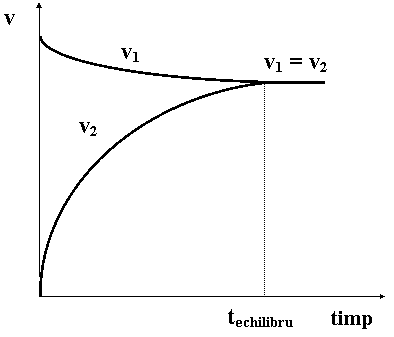
echilibru dinamic
Legea echilibrului chimic (legea actiunii maselor,
legea Guldberg si Waage)
aA + bB cC + dD
v1 =K1 [A]a[B]b ; v2 =K2 [C]c[D]d
v1 = v2

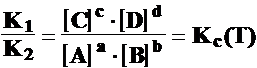 ;
; 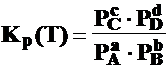
![]()
![]()
![]() CH3COOH + C2H5OH C2H5COOCH3 + H2O
CH3COOH + C2H5OH C2H5COOCH3 + H2O
t = 0 1 mol 1 mol 0 moli 0 moli
t = t1 0,8 0,8 0,2 0,2
t = ti 0,33 0,33 0,67 0,67
t = te 0,33 0,33 0,67 0,67
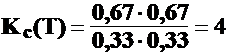
![]()
DG0 = R T lnKc

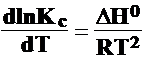 legea lui Van't
Hoff
legea lui Van't
Hoff
Deplasarea echilibrului chimic
Factori de echilibru : C(pi), T, P
![]() Ruptura
de echilibru
Ruptura
de echilibru
Principiul Le Chatelier (principiul diminuarii constrangerii) :
Orice modificare a unui factor de echilibru (exercitarea unei constrangeri) conduce la o deplasare a echilibrului in sensul reactiei care se opune acestei modificari
a) Influenta concentratiei (presiunii partiale)
aA + bB cC + dD
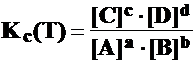
b) Influenta temperaturii
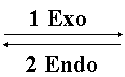
aA + bB cC + dD
Scaderea de temperatura deplaseaza echilibru in sensul reactiei exoterme si invers
DH < 0
![]()
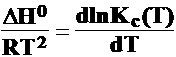 ;
; 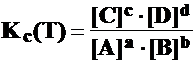
![]() lnKc
< ; Kc <
lnKc
< ; Kc <
c) Influenta presiunii totale (P)
La o crestere a presiunii P a sistemului, echilibrul se deplaseaza in sensul reactiei in care se micsoreaza numarul de moli de substanta gazoasa (presiunea partiala)
nA, nB, nC, nD
nA + nB + nC + nD = n
pA, pB, pC, pD
pA + pB + pC + pD =P
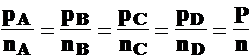
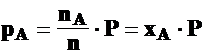
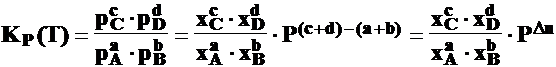
![]() Dn < 0
; P ; PDn
Dn < 0
; P ; PDn
EXEMPLE
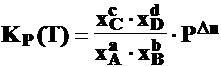 ;
; 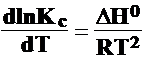
a) Sinteza amoniacului
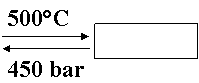
N2 (g) + 3H2 (g) 2NH3 (g)
DH = 46,2 kJ/mol ; Dn = 2 2 < 0
![]() NH3
NH3
racire presiune cat mai mare (400-1 000 bar)
|
|
Continutul NH3 (% vol) |
||||
|
P bar | |||||
h ; T = 500°C ; P = 450 bar ; reciclarea gazelor
b) Obtinerea varului prin calcinarea calcarului
![]()
![]() CaCO3
(s) CaO (s) + CO2
(g)
CaCO3
(s) CaO (s) + CO2
(g)
Dn = 1 0 = 1 > 0 ; micsorare de P prin eliminare de CO2
c) Reducerea oxidului de fier in furnal
FeO (s) + CO (g) Fe (s) + CO2 (g)
Dn = 1 1 = 0 , presiunea nu are nici-o influenta
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |