
Structura atomului. Tabelul periodic al elementelor chimice.
1. Atom. Element chimic. Izotopi. Straturi. Substraturi. Orbitali. Clasificarea elementelor in blocuri de elemente: s, p, d, f. Structura invelisului electronic pentru elementele din perioadele 1, 2, 3.
2. Corelatii intre structura invelisului electronic, pozitia in tabelul periodic si proprietati ale elementelor: caracter metalic, caracter nemetalic. Variatia caracterului metalic si nemetalic al elementelor in grupele principale si in perioadele 1, 2, 3.
3. Proprietati chimice ale sodiului: reactii cu O2, Cl2, H2O. Proprietati chimice ale clorului: reactii cu H2, Fe, H2O, Cu, NaOH, NaBr, KI.
Atomul este cea mai mica particula dintr-o substanta care nu mai poate fi fragmentata prin procedee chimice obisnuite.
![]() Protoni: p+ sau
Protoni: p+ sau ![]()
![]() Nucleu - nucleoni
Nucleu - nucleoni
ATOM Neutroni: n0 sau ![]()
Invelis electronic -
Electroni: e- sau ![]()
Atomul este neutru din punct de vedere electric deoarece nr. p+=nr. e-
Elementul chimic reprezinta specia de atomi care au acelasi numar atomic. (Z)
Notatia unui
element chimic: ![]()
Z - numar atomic =nr. protoni=nr. electroni A = Z+N
A - numar de masa = nr. protoni + nr. neutroni
Izotopii sunt specii de atomi cu aceeasi sarcina nucleara, dar cu mase diferite, deoarece contin un nr. diferit de neutroni (acelasi Z, A-diferit)
|
Izotopii hidrogenului |
Simbol |
nr. atomic Z |
nr. de masa A |
nr. p+ |
nr. n0 |
nr. e- |
|
Hidrogen usor: protiu |
| |||||
|
Hidrogen greu: deuteriu |
| |||||
|
Hidrogen supragreu: tritiu |
|
Masa atomica relativa este numarul care ne arata de
cate ori masa unui atom este mai mare decat unitatea atomica de masa
(a 12-a parte din masa izotopului ![]() )
)
1 unitate atomica de masa (u sau uam) = 1,66 10-27 kg
Masa atomica relativa depinde de:
a) masele izotopilor care compun elementul chimic
b) proportia in care se gasesc acesti izotopi
A = S proportia (%) izotopului masa atomica relativa a izotopului
Exemplu: Cuprul se gaseste in natura intr-un amestec de izotopi: 63Cu in proportie de atomi de 70% si 65Cu in proportie de 30%.
Masa atomica relativa a cuprului: ACu = ![]()
Masa atomica absoluta (in grame) 63,6 10-27 kg = 10-24 g
STRUCTURA INVELISULUI ELECTRONIC
Invelisul electronic al atomului este alcatuit din electroni care graviteaza in jurul nucleului.
Electronii sunt situati pe 7 straturi numerotate de la nucleu spre exterior cu cifre de la 1 la 7 sau cu litere de la K la Q
Nr. maxim de electroni care pot ocupa un strat = 2n2, n-nr. stratului
Straturile sunt alcatuite din unul sau mai multe substraturi iar substraturile sunt alcatuite din orbitali de acelasi tip (care au aceeasi energie).
Orbitalul atomic reprezinta zona din jurul nucleului unde se pot gasi cu cea mai mare probabilitate electronii.
|
Tip de orbital |
Nr. Orbitali |
Nr. max. de e- |
Forma si orientare |
Energie |
|
s |
Sferica In centrul sferei se afla nucleul atomic |
Joasa |
||
|
p |
Bilobata, cu 2 lobi identici, cei 3 orbitali sunt situati de-a lungul celor 3 axe de coordonate x,y,z |
Mai inalta |
||
|
d |
tetralobata |
Si mai inalta |
||
|
f |
complicata |
Foarte inalta |
|
Nr. stratului |
Felul substratului |
Nr. max. de electroni pe: |
|
|
substrat |
strat |
||
|
1s | |||
|
2s | |||
|
2p | |||
|
3s | |||
|
3p | |||
|
3d | |||
|
4s | |||
|
4p | |||
|
4d | |||
|
4f | |||
|
5s | |||
|
5p | |||
|
5d | |||
|
5f | |||
|
6s | |||
|
6p | |||
|
6d | |||
|
6f | |||
|
7s | |||
|
7p | |||
|
7d | |||
|
7f | |||
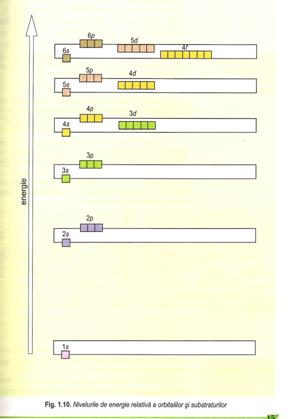
Configuratia electronica reprezinta repartizarea electronilor pe straturi, substraturi si orbitali.
Reguli de ocupare cu electroni a straturilor substraturilor si orbitalilor
Ordinea cresterii energiei: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
2. CORELATII INTRE STRUCTURA INVELISULUI ELECTRONIC AL ATOMULUI SI POZITIA IN SISTEMUL PERIODIC
|
Grupa perioada |
1 IA |
2 IIA |
|
13 IIIA |
14 IVA |
15 VA |
16 VIA |
17 VIIA |
VIIIA |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Metale alkaline (tip s) |
Gaze rare |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Metale alcalino- (tip s) pamantoase |
Nemetale tip p |
halogeni |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
IIIB |
IVB |
VB |
VIB |
VIIB |
VIIIB |
IB |
IIB | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Metale tranzitionale de tip d |
Metale de tip p |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
configuratie |
s1 |
s2 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
d9 |
d10 |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Lantanide blocul f |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Actinide blocul f |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
f1 |
f2 |
f3 |
f4 |
f5 |
f6 |
f7 |
f8 |
f9 |
f10 |
f11 |
f12 |
f13 |
f14 |
VALENTA. NUMAR DE OXIDARE. ELECTROVALENTA. COVALENTA Valenta este capacitatea de combinare a atomilor unui element cu atomii altui element. Cand se combina cu alte elemente atomii cedeaza, accepta sau pun in comun electroni pentru a ajunge la o configuratie stabila de octet (8 electroni) sau dublet (2 electroni) pe ultimul strat. Electroni de valenta - electronii de pe ultimul strat
Valenta Covalenta = numarul electronilor pusi in comun Atomul este neutru din punct de vedere electric: numarul protonilor=numarul electronilor Atomul poate ceda sau accepta unul sau mai multi electroni, se obtin astfel particule incarcate cu sarcina electrica denumite ioni. Transformarea atomului in ion se numeste ionizare. Ioni pozitivi sunt particule incarcate cu sarcina pozitiva. Se obtin prin cedare de electroni: Ioni negativi sunt particule incarcate cu sarcina negativa. Se obtin prin acceptare de electroni: Electrovalenta = numarul electronilor cedati sau acceptati Electrovalenta elementelor din grupele I, II, III principale = numarul grupei Electrovalenta elementelor din grupele IV, V, VI, VII principale = 8 - numarul grupei Covalenta = numarul electronilor pusi in comun Covalenta elementelor din grupele IV, V, VI, VII principale: minima = 8 - numarul grupei maxima = nr. grupei Numarul de oxidare (N.O.) reprezinta numarul de electroni cu care un atom sau un ion participa la formarea unei legaturi ionice sau covalente. Reguli de calcul:
a) N.O. pt. elementele din grupa IA= +1 (Na, K) b) N.O. pt. elementele din grupa IIA= +2 (Mg, Ca) c) N.O. pt. elementele din grupa IIIA= +3 (Al) d) N.O. pt. elementele din grupele secundare este variabil: Fe +2 sau +3, Cu +1 sau +2, Zn +2, Ag +1, Hg +1 sau +2 e) N.O. pt. ionii poliatomici: hidroxid: HO= -1; azotat: NO3= -1; sulfat: SO4= -2; carbonat: CO3= -2; fosfat: PO4= -3
Caracter metalic (electropozitiv)- este proprietatea elementelor de a forma ioni pozitivi prin cedare de electroni. Elementele care au aceasta proprietate sunt metale (grupa I, II, III principale, grupele secundare, lantanide, actinide).
Elementele din grupele principale prin cedare de electroni ajung la configuratia gazului rar din perioada anterioara Elementele din grupele secundare cedeaza electronii de pe ultimul strat sau de pe ultimul si penultimul strat- nu isi formeaza configuratie de gaz rar
In perioada caracterul metalic creste de la dreapta la stanga. In grupele principale caracterul metalic creste de sus in jos, in grupele secundare variatia este inversa In acelasi sens variaza si taria bazelor. Al(OH)3; Mg(OH)2; NaOH
Caracter nemetalic (electronegativ)- este proprietatea elementelor de a forma ioni negativi prin acceptare de electroni. Elementele care au aceasta proprietate sunt nemetale (grupa IV, V, VI, VII principale).
Elementele din grupele principale prin acceptare de electroni ajung la configuratia gazului rar din aceeasi perioada. In perioada caracterul nemetalic creste de la stanga la dreapta. In grupe caracterul nemetalic creste de jos in sus. In acelasi sens variaza si taria acizilor oxigenati superiori H4SiO4; H3PO4; H2SO4; HClO4
Creste
caracterul nemetalic, creste taria acizilor oxigenati superiori
3. Proprietati chimice ale sodiului: reactii cu O2, Cl2, H2O. Proprietati chimice ale clorului: reactii cu H2, Fe, H2O, Cu, NaOH, NaBr, KI. Reactii ale sodiului cu O2, Cl2, H2O 2Na + O2 Na2O2 (peroxid de sodiu) 2Na + Cl2 2NaCl (clorura de sodiu) 2Na + 2H2O 2NaOH + H2 Hidroxid de sodiu Reactii ale clorului Cl2 + H2 2 HCl (acid clorhidric) Cl2 + Fe FeCl3 (clorura de fer III) Cl2 + H2O HCl + HClO HClO
Cl2 + Cu CuCl2 Cl2 + 2NaOH NaCl + NaClO + H2O (NaCl-clorura de sodiu; NaClO-hipoclorit de sodiu) Cl2 + 2NaBr 2NaCl + Br2 (reactia pune in evidenta caracterul nemetalic mai accentual al Cl2 fata de Br2) Cl2 + 2KI 2KCl + I2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||