
UNIVERSITATEA"TRANSILVANIA"
Facultatea Stiinta Si Ingineria Materialelor
Specializarea Ingineria Valorificarii Deseurilor
OXIDAREA CARBURII DE CALCIU
INTRODUCERE
CALCIUL este cunoscut din anul 1808 cand Sir Humpherey Davy
impreuna cu renumitul chimist suedez J.J.Berzelius il obtin preparearea calciului metalic din amalganul de calciu rezultat din electroliza a fost realizata prin electroliza
clorurii de calciu folosind un catod de mercur.
Din punct de vedere chimic este un metal reactive, calciul se combina direct, reactionand energic in unele cazuri chiar si la rece, cu hidrogenii (in
special cu fluorul si clorul), cu oxigenul si sulful. Se combina direct cu azotul rezultand nitruri, si cu carbonul,dand carburi.
CARBONUL este un element remarcabil din mai multe motive. Printre formele sale diferite se numara una dintre cele mai moi (grafit) si una dintre cele mai dure (diamant) dintre substantele cunoscute. Mai mult, are o capacitate deosebita de a forma legaturi chimice cu alti atomi mici, incluzand atomii de carbon, iar marimea sa il face capabil de a forma legaturi multiple. Datorita acestor proprietati, carbonul poate forma aproape zece milioane de compusi chimici diferiti.
Cel mai cunoscut si important oxid al carbonului este bioxidul de carbon, CO2. Este o componenta minora a atmosferei Pamantului, produs si folosit de toate fiintele vii, si un compus volatil in alta parte. In apa formeaza urme de acid formic, HCO2H, dar ca majoritatea compusilor cu mai multi atomi de oxigen la un singur carbon este instabil.
CARBURA DE CALCIU CaC2 denumita si carbid este nelipsita la prepararea acetilenei destinata sudurii sau taierii otelurilor.
1.DATELE TERMODINAMICE NECESARE PENTRU REALIZAREA PROIECTULUI
Se gasesc in urmatorul tabel:
Tabelul 1-datele necesare pt realizarea proiectului
|
Substanta |
∆H
|
S
|
C |
C
|
||
|
a
|
b*10
|
c*10
|
||||
|
CaC | ||||||
|
O | ||||||
|
Ca | ||||||
|
CO | ||||||
∆H![]() =entalpia de formare in conditii standard a substantelor.
=entalpia de formare in conditii standard a substantelor.
∆S![]() =entropia de formare in conditii standartd a substantelor.
=entropia de formare in conditii standartd a substantelor.
C![]() =capacitatea calorica molara in conditii standard.
=capacitatea calorica molara in conditii standard.
2.Calculul entalpiei de reactie in conditii standard.
Entalpia de formare a unei substante reprezinta cantitatea de caldura cedata sau acceptata la formarea unui mol de substanta din elemental in stare standard.
.Este o marime energetica.
.Este o marime extensive acre depinde de numarul moleculelor speciei introduce in sistem.
.Entalpia caracterizeaza un sistem si o transformare.
Pentru o reactie chimica avem:
∆H0R,298= ![]() ∆H
∆H![]() -
-![]() ∆H
∆H![]()
Unde:
vi,vj -sunt coeficienti stoechiometrici;
∆H![]() -este entaplia
standard de formare a produsilor de reactie
-este entaplia
standard de formare a produsilor de reactie
∆H![]() -este entalpia standart de formare a reactantilor.
-este entalpia standart de formare a reactantilor.
Ecuatia studiata in aceast proiect este:
CaC![]() +2O
+2O![]() →Ca+2CO
→Ca+2CO![]()
Prin conventie ∆H![]() al elementelor in stare in stare standard = 0
al elementelor in stare in stare standard = 0
Tabelul 2-valoarea entalpiei de reactie in conditii standard
|
Substanta |
CaC |
O |
Ca(s) |
CO |
|
∆H |
∆H![]() = ∆H
= ∆H![]()
![]() - ∆H
- ∆H![]() -∆H
-∆H![]() -∆H
-∆H![]()
∆H![]() =2*(-94.05)-0-0-(-15)
=2*(-94.05)-0-0-(-15)
∆H![]() =- 173.1 kcal/mol
=- 173.1 kcal/mol
3.Aprecieri asupra stabilitatii componentilor obtinuti in comparatie cu alti compusi similari
Substanta principala este carbonatul de calciu,a carui stabilitate o vom compara cu cea a unor compusi prezentati mai jos:
Tabelul 3-comparearea stabilitatii componentilor obtinuti cu alti compusi similari
|
Substanta |
CaBr |
Ca(CN) |
CaCl |
CaC |
|
∆H |
|
CaCl![]() CaBr
CaBr![]() Ca(CN)
Ca(CN)![]() CaC
CaC![]()
![]()
Cu cat o substanta are valoarea
entalpiei mai mica,cu atat este mai stabile.Din acest motiv,putem spune ca CaC![]() este o substanta mai stabila decat restul substantelor.
este o substanta mai stabila decat restul substantelor.
4.Determinarea dependentei entalpiei de reactie in functie de temperatura.
Pornind de la relatia:
∆HR,T=∆aT+∆bT2-∆c/T+IH
Calculam:
∆a=∑![]() -∑
-∑![]()
∆b=∑![]() -∑
-∑![]()
∆c=∑![]() -∑
-∑![]()
∆a=(a![]() +a
+a![]() )-(a
)-(a![]() +a
+a![]() )
)
∆a=(16.4+7.52)-(5024+10.55)
∆a=8.13 cal/mol*K →8.13*10![]() kcal/mol
kcal/mol
∆b=(b![]() +b
+b![]() )-(b
)-(b![]() +b
+b![]() )
)
∆b=(2.84+0.81)-(3.50+2.16)
∆b=-2.01*10![]() cal/mol*K →-2.01*10
cal/mol*K →-2.01*10![]() kcal/mol
kcal/mol
∆c=(c![]() +c
+c![]() )-(c
)-(c![]() +c
+c![]() )
)
∆c=(-2.07+(-0.90))-(-2.04)
∆c=-9.03*10![]() cal/mol*K →-0.93*10
cal/mol*K →-0.93*10![]() kcal/mol
kcal/mol
Putem determina ![]()
∆H![]() =∆a*298+∆b298
=∆a*298+∆b298![]() /2-∆c/298+I
/2-∆c/298+I![]()
I![]() =-173.1*10
=-173.1*10![]() -8.13*298-2.01*
-8.13*298-2.01*![]() *10
*10![]() -
-![]()
=-175924.0686 cal/mol*K →-175.924![]()
Cunoscand I![]() vom obtine ecuatia de dependenta a entalpiei de reactie in
functie de temperatura:
vom obtine ecuatia de dependenta a entalpiei de reactie in
functie de temperatura:
∆H![]() =8.13+-2.01*10
=8.13+-2.01*10![]() *298/2-0.93*10
*298/2-0.93*10![]() /T-175924.0686
/T-175924.0686 ![]()
Determinarea entalpiei de reactie la temperaturile de 300K,500K,700K,1000K.
∆H![]() =∆aT+∆bT
=∆aT+∆bT![]() /2-∆c/T+I
/2-∆c/T+I![]()
∆H![]() =8.13*298-
=8.13*298-![]() +
+![]() -175942.0686
-175942.0686
∆H![]() =-173278.4961
=-173278.4961![]() →-173.2784
→-173.2784![]()
∆H![]() =8.13*300-
=8.13*300-![]() +
+![]()
∆H![]() =-173265.5186
=-173265.5186 ![]() →-173.2655
→-173.2655 ![]()
∆H![]() =8.13*500-
=8.13*500-![]() +
+![]()
∆H![]() =-171924.3186
=-171924.3186 ![]() →-171.9243
→-171.9243![]()
∆H![]() =8.13*700-
=8.13*700-![]() +
+![]()
∆H![]() =-170592.6616
=-170592.6616![]() →-170.5926
→-170.5926![]()
∆H![]() =8.13*1000-
=8.13*1000-![]() +
+![]()
∆H![]() =-168706.0686
=-168706.0686![]()
→-168.7060![]()
5.Particularizarea si trasarea grafica a dependentei
entalpiei la temperaturile de 300sK,500sK,700sK,1000sK,pentru un mol de
substanta principala respectiv
Reprezantarea grafica a entalpiei in functie de temperaturile 300K,500K,700K,1000K
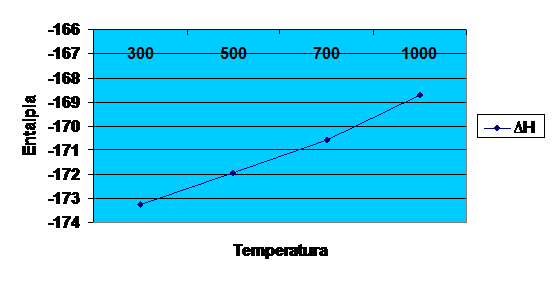
Diagrama entalpiei in functie de temperatura
Reprezentarea
grafica a entalpiei in finctie de temperatura pt
Pentru a calcula entalpia
de reactia a
∆H![]() =n*∆H
=n*∆H![]()
Unde:
n=numarul de moli
prezenti in
M![]() =40 g/mol
=40 g/mol
n=100*10![]() /40=2500 moli Ca
/40=2500 moli Ca
![]() ∆H
∆H![]() =2500 *(-173.2655)
=2500 *(-173.2655)
=-443163.75 ![]()
![]() ∆H
∆H![]() =2500*(-171.9243)
=2500*(-171.9243)
=-429810.75![]()
![]() ∆H
∆H![]() =2500*(-170.5926)
=2500*(-170.5926)
=-426481.5![]()
![]() ∆H
∆H![]() =2500*(-168.7060)
=2500*(-168.7060)
=-421765![]()
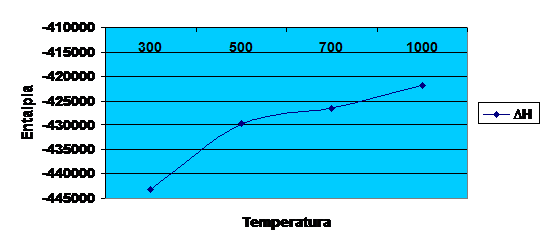
Diagrama entalpiei in functie de temperatura pt
6.Calculul entropiei de reactie in conditii standard.
Entropia serveste ca masura a ireversibilitatii termodinamice a uniu proces fizic sau chimic.
.Entropia (S),evalueaza gradul de dezordine al unui sistem.
.Entalpia caracterizeaza un sistem si o transformare.
.Entropia depinde de starea de agregare a unui sitem.
S![]() >S
>S![]() >S
>S![]()
Pentru o reactie chimica avem:
∆S![]() =∑γiS
=∑γiS![]() -∑γjS
-∑γjS![]()
Unde:
γi,γj -sunt coeficienti stoechiometrici.
S![]() -este entropia standard de formare a produsilor de reactie.
-este entropia standard de formare a produsilor de reactie.
S![]() -este entropia standard de formare a reactantilor.
-este entropia standard de formare a reactantilor.
Pentru ecuatia studiata avem la temperatura T=298K si presiunea 1 atm:
Tabelul 4-entropiile standard de formare
|
Substanta |
CaC |
O |
Ca |
CO |
|
∆S |
∆S![]() =∆S
=∆S![]() +∆S
+∆S![]() -∆S
-∆S![]() +∆S
+∆S![]()
∆S![]() =2*51.6+9.95-4*49.00+16.1
=2*51.6+9.95-4*49.00+16.1
=30.17 ![]()
![]()
7.Aprecieri asupra sontanietatiii procesului studiat in sistemele isolate si in sistemele neizolate
In capitolele anterioare am calculat:
∆H![]() =-173.2784
=-173.2784![]()
∆S![]() =0.03017
=0.03017 ![]()
∆G0R,298
=-182.2690![]()
Deci: ∆H0R,298<0, ∆S0R,298<0, ∆G0R,298<0
Variatia energiei libere Gibbs intr-o reactie exprima relatia dintre variatia entalpiei de reactie si variatia entropiei de reactie la o anumita temperature,reprezentand si interdependenta dintre tendinta sistemelor catre un minim de enregie si un maxim de dezordine.
Procesul studiat decurge sopontan in sitem neizolat deoarece ∆G0R,298<0.
8.Determinarea dependentei entropiei de reactie in functie de temperaturile 300K,500K,700K,1000K.
∆S![]() =∆a*lnT+∆b*T-
=∆a*lnT+∆b*T-![]() +I
+I![]()
Unde :
I![]() =
=
I![]() = ∆S
= ∆S![]() -∆a*ln 298-∆b*298+
-∆a*ln 298-∆b*298+![]()
=30.17-8.13*ln 298+2.01*10![]() *298-
*298-![]()
=-16.072![]() →-0.01607
→-0.01607![]()
∆S![]() =8.13*ln 298+2.01*10
=8.13*ln 298+2.01*10![]() *298+
*298+![]()
=13803.9421![]() → 13.8039
→ 13.8039![]()
∆S![]() =8.13*ln300+2.01*10
=8.13*ln300+2.01*10![]() *300+
*300+![]()
=47.4913![]() →0.0474913
→0.0474913![]()
∆S![]() =8.13*ln500+2.01*10
=8.13*ln500+2.01*10![]() *500+
*500+![]()
=54.3457![]() →0.0523457
→0.0523457![]()
∆S![]() =8.13*ln700+2.01*10
=8.13*ln700+2.01*10![]() *700+
*700+![]()
=54.762![]() →0.054762
→0.054762![]()
![]()
∆S![]() =8.13*ln1000+2.01*10
=8.13*ln1000+2.01*10![]() *1000+
*1000+![]()
=58.2165![]() →0.0582165
→0.0582165![]()
9.Particularizarea si
trasarea grafica a dependentei entropiei la temperaturile de
300sK,500sK,700sK,1000sK,pentru un mol de substanta principala respective
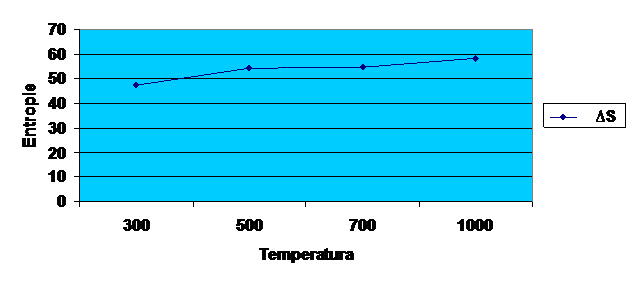
Diagrama 3-trasarea grafica a dependentei entropiei la temperaturile de 300K,500K,700K,1000K.
Determinarea entropiei de reactie la temperaturile de
300k,500K,700K,100K pentru
∆S![]() =n*∆S
=n*∆S![]()
∆S![]() =2500*0.0474913
=2500*0.0474913
=118.7282![]()
∆S![]() =2500*0.0523457
=2500*0.0523457
=130.8642![]()
∆S![]() =2500*0.054762
=2500*0.054762
=136.905![]()
∆S![]() =2500*0.0582165
=2500*0.0582165
=145.54125![]()
Trasarea grafica a entropiei de reactie la temperaturile de
300K,500K,700K,100K pentru 100Kg de substanta principala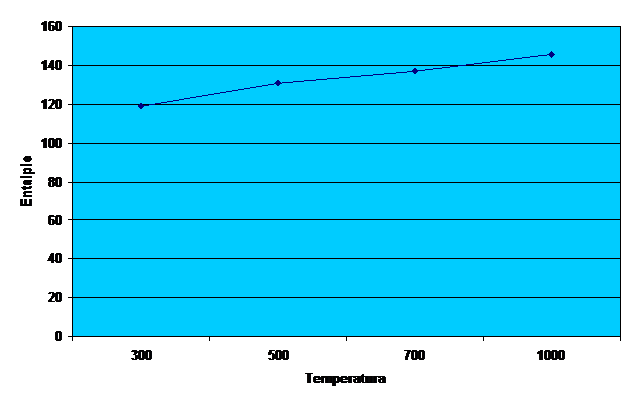
Diagrama 4-trasarea entropiei de reactie la temperaturile 300K,500K,700K,100K pentru 100Kg de substanta principala.
10.Calculul energiei libere Gibbs in conditii standard
Energia libera Gibbs este un potential termodinamic,o marime energetica cu semnificatie cu cea a energiei potentiale din mecanica, adica este o functie de minim(un proces ce decurge in sensul energiei sistematice)
Pentru reactii chimice avem:
∆G0R,298=∑νi∆G0f,produsi,298-∑νj∆G0f,reactanti,298
Sau
∆G0R,298=∆HR,298-T*∆SR,298
Relatia de mai sus se aplica astfel:
∆HR,298=-173.2784 ![]()
∆SR,298=0.03017![]()
∆G0R,298=-173.2784-298*0.03017
=-182.2690![]()
11.Dependenta energiei libera Gibbs de temperature
∆G0R,1000=∆HR,1000-1000*∆SR,1000
∆G0R,298 =-182.2690![]()
∆G0R,300=∆HR,300-300*∆SR,300
∆G0R,300=-173.2655-300*0.0474913
=-187.5128![]()
∆G0R,500=∆HR,500-500*∆SR,500
∆G0R,500=-171.9243-500*0.0523457
=-198.0971![]()
∆G0R,700=∆HR,700-700*∆SR,700
∆G0R,700=-170.5926-700*0.054726
=-208.9008![]()
∆G0R,1000=-168.7060-1000*0.0582165
=-226.9225![]()
12.Particularizarea si
trasarea grafica a dependentei energiei libera Gibbs la temperaturile de
300sK,500sK,700sK,1000sK,pentru un mol de substanta principala respectiv
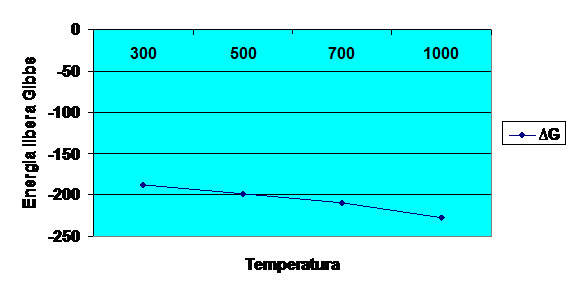 Diagrama 5-trasarea
grafica a dependentei energiei libere Gibbs la temperaturile de
300K,500K,700K,1000K,pentru un mol de substanta principala
Diagrama 5-trasarea
grafica a dependentei energiei libere Gibbs la temperaturile de
300K,500K,700K,1000K,pentru un mol de substanta principala
Determinarea energiei libere Gibbs la
temperature de 300K,500K,700K,1000K pentru
∆GR,T/100=n*∆GR,T
∆GR,T/300 =2500*(-187.5128)
=-468782 Kcal/mol
∆GR,T/500 =2500*(-198.0971)
=-495242.75 Kcal/mol
∆GR,T/700 =2500*(-208.9008)
=-522252 Kcal/mol
∆GR,T/1000 =2500-(-226.9225)
=-567306.25 Kcal/mol
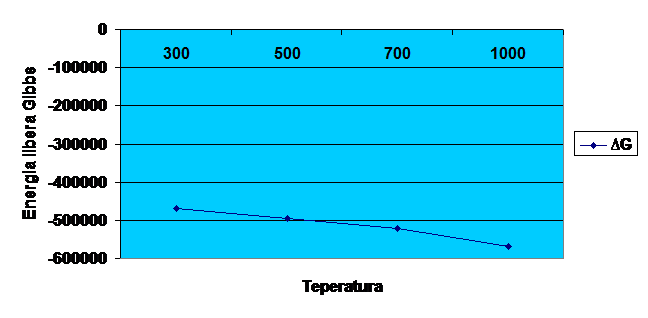
Diagrama 6-trasarea grafica a
dependentei energiei libere Gibbs la temperaturile de
300K,500K,700K,1000K,pentru
13.Concluzii
Pozitia pe care o ocupa chimia in raport cu celelalte stiinte ale naturii se datoreaza faptului ca furnizarea datelor fundamentale pentru cunoasterea substantelor si a proceselor la care participa acestea.
CaC![]() +2O
+2O![]() →Ca+2CO
→Ca+2CO![]()
∆H![]() =-173.2784
=-173.2784![]()
.∆H![]() <0 ,in concluzie reactia este exoterma
<0 ,in concluzie reactia este exoterma
∆S![]() =0.03017
=0.03017 ![]()
.∆S![]() <0 ,avem un process spontan in reactie
<0 ,avem un process spontan in reactie
∆G0R,298
=-182.2690![]()
.∆G0R,298<0 ,procesul decurge spontan in sistem neizolat.
Pentru reactiile exoterme s-a constatat ca cu cresterea temperaturii valoarea constantei de echilibru creste, deci concentratia de reactie creste, adica echilibrul se va deplasa spre dreapta.
Prin modul in care rezultatele chimiei sunt puse la dispozitia oamenilor, chimia este,in societatea moderna, omniprezenta si prezenta aplicabilitatea in care de zi-cu-ci in cele mai diverse ramuri ale activitatii umane, de la indrustrie in medicina s.a.
14.Bibliografie
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |