Legatura chimica este forta care mentine impreuna atomii in molecule. Aceasta:
- determina structura si proprietatile substatelor
- este determinata de invelisul electronic exterior al atomilor.
Atomii nu sunt stabili in stare libera, avand invelisuri atomice incomplete in starea fundamentala - ei au tendinta de a se lega intre ei. Procesul de combinare a atomilor - formarea legaturilor chimice - are loc spontan, cu degajare de energie. Starea finala - molecula, macromolecula sau reteaua - este mai stabila decat atomii liberi si are energie mai mica.
Formarea legaturilor chimice este consecinta a doua fenomene:
- stabilitatea deosebita a configuratiei de gaz nobil a atomilor,
- tendinta atomilor de a-si ocupa cat mai complet orbitalele vacante.
Molecula poate fi definita ca fiind un grup discret de atomi mentinuti impreuna prin legaturi chimice. Macromolecula are masa moleculara uriasa (peste 100.000 u.a.m.).
Din punct de vedere structural, substantele pot fi formate din: atomi, ioni, molecule (sau macromolecule) legate prin diferite tipuri de leguri chimice sau forte intermoleculare.
Structura chimica a substantelor comporta mai multe
- asezarea reciproca a atomilor
- natura legaturilor dintre atomi
- influentele lor reciproce.
Exista tipuri generale de legaturi chimice, adica doua modalitati de realizare a configuratiilor stabile ale atomilor: legatura ionica si legatura covalenta
Teoria electronica a legaturii chimice (clasica) - W.Kossel, G.N.Lewis (1916)
Prin combinare chimica atomii isi modifica straturile exterioare de electroni, realizand configuratii mai stabile, identice cu ale gazelor nobile sau apropiate de acestea. Teoria electronica a legaturii chimice se bazeaza pe cateva principii si anume:
- tendinta de combinare este cauzata de nestabilitatea configuratiei electronice a atomilor liberi,
- stabilitatea configuratiei de gaz nobil - realizarea octetului electronic,
- tendinta de folosire cat mai completa a electronilor si orbitalelor disponibile.
Prin combinare chimica atomii isi modifica straturile exterioare de electroni, realizand configuratii mai stabile, identice cu ale gazelor nobile sau apropiate de acestea.
Kossel in 1916 a elaborat teoria electronica a legaturii ionice. Aceasta legatura ia nastere intre elemente cu caracter chimic diferit, deci cu diferente mari de electronegativitate. Conform acestei teorii formarea legaturii ionice presupune doua etape:
- formarea ionilor
- atractia electrostatica dintre ioni.
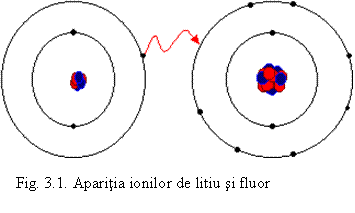
Formarea ionilor are loc prin pierdere sau castig de electroni:
metalele puternic electropozitive, cu un numar mic de electroni pe ultimul nivel fata de configuratia de gaz nobil (mai ales din grupele 1 si 2), cedeaza acesti electroni, trecand in ioni pozitivi numiti cationi. De exemplu:
Li0 - e = Li+
 Acestia au configuratia electronicǎ a elementului
precedent. Pentru litiu, prezentat mai sus:
Acestia au configuratia electronicǎ a elementului
precedent. Pentru litiu, prezentat mai sus:
[He]2s1 - e- → [He]
- nemetalele - puternic electronegative - cu deficit mic de electroni fata de configuratia de gaz nobil, primesc electroni, trecand in ioni negativi numiti anioni. De exemplu:
F0 + e = F-
 Acestia vor avea
configuratia electronica a gazului nobil urmator:
Acestia vor avea
configuratia electronica a gazului nobil urmator:
[He]2s22p5 + e- → [Ne]
Reamintim cǎ legatura ionica ia nastere intre elemente cu caracter chimic foarte diferit - cu electronegativitati diferite - elemente aflate la extremitati in sistemul periodic. Elementele de la mijlocul sistemului periodic (metale sau nemetale) pot ceda sau primi un numar limitat de electroni.
Metalele tranzitionale (din blocul d) nu totdeauna realizeaza configuratii de gaz nobil. Acestea pot realiza configuratii de 14, 16 sau 18 electroni devenind ioni pozitivi. De asemenea au o pronuntata tendinta de a da mai multe stari de oxidare - valenta variabila - iar legatura ionica apare doar la sarcini mici +1 sau +2.
Starea de oxidare a elementelor in combinatii ionice este egala cu sarcina ionului respectiv si nu poate fi mai mare decat trei la ionii simpli, deoarece numarul electronilor cedati sau primiti nu poate fi mai mare. Energia de ionizare creste cu fiecare electron cedat, iar afinitatea pentru electron scade cu fiecare electron acceptat de atom. Tendinta de formare a ionilor mai depinde si de dimensiunile atomilor: atomii cu dimensiuni mici formeaza mai usor anioni (primesc electroni), iar cei cu dimensiuni mari formeaza cationi (cedeaza usor electroni). Un ion cu sarcina electrica mare si raza mica ar avea un camp electric foarte intens, care ar polariza puternic ionii de semn contrar, legatura devenind practic covalenta. De aceea ionul H+ nu poate exista liber in solutie, ci doar legat covalent de moleculele de apa de exemplu. Razele cationilor sunt mult mai mici decat ale atomilor initiali, iar razele anionilor sunt ceva mai mari decat ale atomilor din care provin.
Exista si ioni poliatomici sau complecsi, care sunt de fapt molecule incarcate electric, formate prin legaturi covalente, de exemplu: NH4+, H3O+, OH-, SO42-, [Cu(NH3)4]2+, etc.
Nu exista "molecule ionice" ci numai ioni intr-o retea cristalina, in care fiecare ion este inconjurat de un num de ioni de semn contrar, astfel incat atractiile electrostatice sa fie maxime si respingerile minime, asigurandu-se neutralitatea retelei in ansamblu. Legatura ionica nu se satureaza, se respecta doar neutralitatea sistemului.
La formarea combinatiilor ionice se degaja energie - cu cat aceasta este mai mare, stabilitatea combinatiei este mai mare. La aceasta contribuie:
- atractia coulombiana dintre ioni (in stare gazoasa),
- energia de retea a cristalelor ionice (se degaja),
- solvatarea ionilor.
Δx: 0,5 1,0 1,5 1,8 2,0 2,5 3,0 3,2
%caract. ionic: 6 22 43 55 63 79 89 92
Conventional, se considera ionica o legatura dintre elemente ale caror electronegativitati difera cu mai mult de 1,8, deci procentul de caracter ionic este mai mare de 55%.
- au caracter salin (majoritatea sunt saruri),
- au puncte de topire (tt) si de fierbere (tf) ridicate,
- se dizolva in soventi polari (apa), in solutie apoasa are loc fenomenul de hidratare a ionilor prin care ionii se inconjoara cu moleculele dipolare ale apei.
- in stare solida sunt izolatori,
- solutiile substantelor ionice in apa conduc curentul electric, de aceea se numesc electroliti sau conductori electrici de ordinul II, avand conductibilitate ionica. In acelasi mod conduc curentul electric si topiturile ionice.
- covalenta in grupele principale este egala cu 8 minus numarul grupei - aceasta reprezinta chiar numarul de electroni necesari pentru completarea octetului,
- prin legaturi covalente se formeaza molecule.
Exemple:
H2 H.
+ H. ![]() H H
H H
F - F (v. Fig. 3.2)
![]()
![]() F2
F2
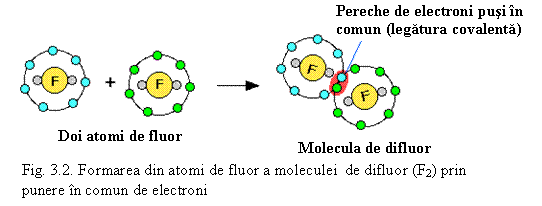
Analog se poate scrie formarea legaturilor covalente simple si pentru alte elemente din perioada a 2-a:
H - F; H-O-H; :NH3; CH4
Perechile de electroni neangajate in legǎturi se numesc electroni neparticipanti.
Se mai pot forma si legaturi multiple intre atomi de acelasi fel. De exemplu mentionam:
:N≡N: =C=C= -C≡C-
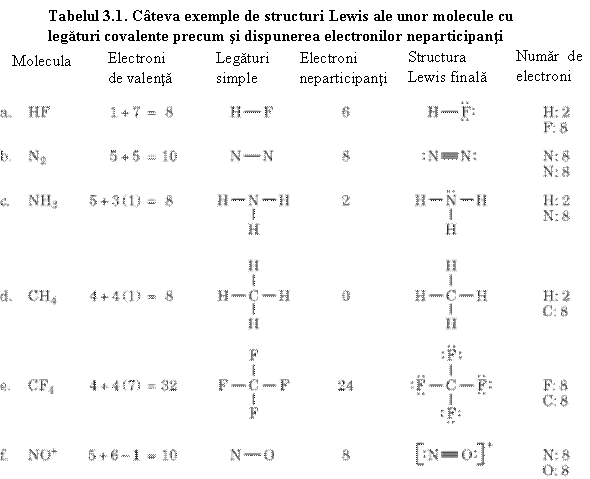
Dar pot lua nastere legaturi multiple si intre atomi diferiti, ca de exemplu: O=C=O, O=S=O, H-C≡N. Cateva exemple de molecule covalente sunt prezentate in tabelul 3.1
Caracteristicile legaturii covalente sunt:
- este orientata in spatiu
- este rigida (atomii ocupa pozitii fixe),
- este saturata,
- este foarte puternica,
- prin covalente se formeaza molecule independente (in stare gazoasa) sau retele atomice (in stare solida),
- la moleculele formate din atomi diferiti, apare fenomenul de polarizare
Caracteristicile substantelor cu legaturi covalente difera in functie de moleculele substantelor dar si in functie de retelele rezultate.
Substantele cu molecule mici (O2, N2, CO2, NH3, etc; substante organice)
- sunt gaze sau lichide la temperatura ordinara,
- au temperaturi de topire (tt) si de fierbere (tf) joase,
- intre molecule exista forte de atractie slabe - van der Waals,
-sunt solubile in solventi organici,
- solutiile sunt neelectroliti.
Legatura covalenta polara.
Din punct de vedere al naturii atomilor constituenti, moleculele pot fi:
Molecule homonucleare - formate din atomi identici - au norul electronic simetric.
Molecule heteronucleare - formate din atomi diferiti - norul electronic este asimetric iar perechea de electroni de legatura este atrasa mai mult de atomul mai electronegativ (densitatea de sarcina negativa este mai mare in jurul atomului mai electronegativ).
Centrul sarcinilor pozitive si negative nu mai coincid iar rezultatul este acela ca apare o polaritate a moleculei. Aceasta poarta numele legatura covalenta polara. Notatia generala este:
Aδ+ - B δ-
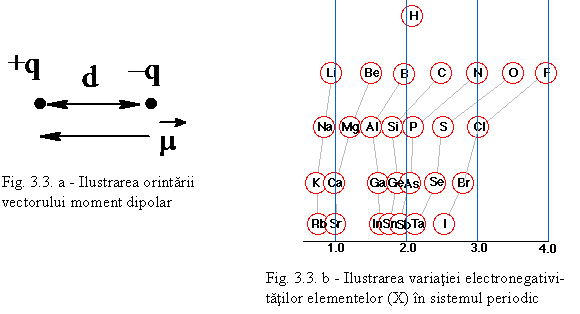
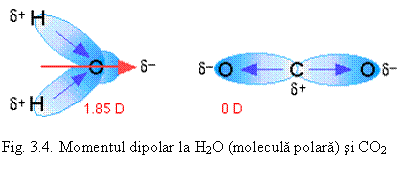
Molecula are un moment electric de dipol: μ= q.d (fig. 3.3 - a) q fiind sarcina electrica iar d - distanta intre sarcini μ avand unitatea debye - D (1 D = 3,336.10-30 C.m). De exemplu, pentru acid fluorhidric notatia obisnuita este: H δ+ - Fδ- unde δ este sarcina partiala (fractiune din sarcina electronului e). Din sarcina partiala se poate calcula procentul de ionicitate (δ/e).100. Gradul de ionicitate se poate determina experimental. Acesta depinde de diferenta de electronegativitate dintre cele doua elemente (vezi fig 3.3. b).
Daca notam cu XA -electronegativitatea elementului A formata din semisuma energiei de ionizare EA si afinitatii pentru electroni AA:
XA = (EA+ AA)/2
Se stie ca daca diferenta XA - XB > 1,8 atunci ionicitatea i > 55% si legatura ionica predomina. Cu XA , XB s-au notat electronegativitatile atomilor A si B.
In moleculele poliatomice, momentul electric dipolar este suma vectoriala a momentelor tuturor legaturilor polare. Daca legaturile polare sunt simetrice, momentele se anuleaza si μ = 0.Exemple:
O δ-/2=C δ+=O δ-/2 μ = 0 - in consecinta molecula este nepolara.
 S δ-/2=C
δ+=S δ-/2 μ = 0 - analog ca mai sus, este o molecula
nepolara.
S δ-/2=C
δ+=S δ-/2 μ = 0 - analog ca mai sus, este o molecula
nepolara.
Daca molecula are un moment de dipol diferit de zero, inseamna ca structura acesteia este asimetrica. Exemple: H2O, SO2, NH3 (vezi fig. 3.4 ).
Cu cat sunt mai diferite electronegativitatile elementelor (vezi fig. 3.3 - b), cu atat polaritatea moleculei creste. Substantele cu molecule polare se dizolva in apa - are loc disocierea in ioni cu formare de electrolit. Datorita polaritatii moleculei de apa, are loc fenomenul de hidratare a ionilor in solutie.
La limita, legatura polara devine legatura ionica. Legatura polara este intermediara intre legatura covalenta si cea ionica. Atomul electronegativ are un exces de electroni (si o sarcina electrica q). In functie de aceasta sarcina distingem cazurile:
q = 0 - legatura covalenta pura,
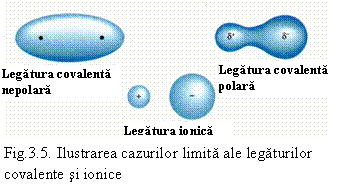 q > 0 si q < e - legatura covalenta
polara,
q > 0 si q < e - legatura covalenta
polara,
q = n.e - legatura pur ionica (e fiind sarcina electronului) - vezi si fig. 3.5.
De fapt numai in stare gazoasa ionii au sarcini intregi. In cristalele ionice solide sarcinile ionilor sunt subunitare sau ceva mai mici de un numar intreg.
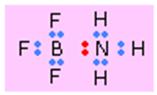
Legatura coordinativa (donor - acceptor)
Este o legatura covalenta in care perechea de electroni de legatura provine de la un singur atom - donor. Atomul care accepta perechea de electroni - acceptor. Reactia poate fi scrisa:
:NH3 + BF3 = H3N → BF3
Sageata indica aici o legatura donor-acceptor, amoniacul fiind donorul iar atomul de bor (B) care are in BF3 doar 6 electroni de legatura in jurul sau este acceptorul. Situatia electronilor este ilustrata mai jos unde perechea de electroni cedata de amoniac este colorata in rosu:
Combinatiile formate prin legaturi coordinative - denumite combinatii complexe - sunt formate dintr-un ion central (metal) si liganzi. Liganzii pot fi molecule neutre sau anioni. Numarul de liganzi care inconjoara ionul central poarta numele de numar de coordinatie. Exemple de formare a denumirilor:
[Cu(NH3)4]2+ + 2Cl- - clorura tetraaminocupru(II)
[Co(NH3)6]2+ + 2Cl- - clorura hexaaminocobalt(II)
Na+ + [Ag(CN)2]- - dicianoargentat de sodiu
4K+ + [Fe(CN)6]4- - ferocianura de potasiu sau hexacianoferat de potasiu.
Teoria mecanic-cuantica a covalentei
Covalenta ia nastere prin contopirea orbitalelor atomice care duc la formare de orbitale moleculare care apartin intregii molecule.
Mecanica cuantica - calculeaza (cu aproximatie) ecuatiile si geometriile orbitalelor moleculare.
Etapele formarii legaturii covalente conform mecanicii cuantice:
- redistribuirea orbitalelor atomice,
- suprapunerea (intrepatrunderea) orbitalelor atomice (OA)cu formarea de orbitale moleculare (OM),
- ocuparea OM cu perechi de electroni.
Se pot combina orbitale atomice de simetrie (orientare) potrivita si de energie apropiata. Procesul are loc cu eliberare de energie - proces spontan starea rezultata (molecula) este mai stabila decat atomii izolati.
Exista doua metode matematice de tratare a legurii chimice:
- metoda orbitalelor moleculare (OM)
- metoda legaturii de valenta (LV) - sau metoda perechilor de electroni de legatura. Acestea difera mai mult prin modul matematic de tratare concluziile fiind similare.
Metoda LV e mai simpla si poate exprima formare multor molecule. Dar nu toate legaturile chimice se pot reduce la perechi de electroni - sunt cazuri in care participa mai multi electroni (ex. in benzen - legaturi delocalizate). Metoda OM poate insa rezolva numai molecule mai simple, pentru cele mai complicate calculele sunt insurmontabile.
Metoda orbitalelor moleculare (OM)
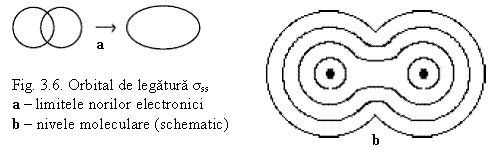
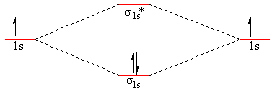
Legatura σs (s-s) - Molecula H2
Prin contopirea a 2 orbitale atomice s rezulta 2 orbitale moleculare
- 1 OM de legatura σs (- prin suprapunerea OA de acelas semn
- 1 OM de antilegatura σs* (cu energie mai ridicata) - prin suprapunerea OA de semn contrar neprezentata in fig. 3.6.
- OM de legatura se ocupa cu o pereche de electroni cu spini opusi
- electronii sunt atrasi de ambele nuclee
- densitatea electronica este maxima intre nuclee - in OM de legatura
- in OM de antilegatura densitatea electronica este minima - probabilitatea de a gasi electronul este minima, dar nu este zero.
Din punct de vedere energetic noua situatie este avantajoasa deoarece prin popularea cu electroni a celor doua orbitale rezulta o situatie in care molecula H2 (cu o pereche de electroni prezenti pe acelasi orbital σ1s) are o energie mai coborata decat suma enegiei atomilor individuali asa cum reiasǎ din schema de mai jos:
![]()
![]()
Legatura σsp (sigma s-p ) de exemplu molecula HF
OA de tip s a hidrogenului se suprapune cu o OA de tip p a fluorului - rezulta doua OM: una de legatura σsp si o altǎ OM de antilegatura σs*. Reprezentarea doar pentru orbitala de legǎturǎ σsp este:
Legatura
σpp. MoleculaF2 posedǎ o astfel de legǎturǎ a
cǎrei formare care se reprezinta astfel:
F F F2
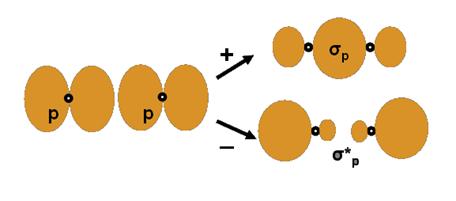
Norul electronic are densitatea maxima intre atomii ce formeaza molecula si mai exista doua planuri nodale situate lateral. Pe langa acesta mai apare si o orbitala de antilegatura σ*pp.
Legatura π (dubla). Se mai pot combina si doua orbitale p cu axele paralele dupa ce s-au combinat doua OA pe aceeasi axa (cu formare de legatura σp) - astfel ia nastere legatura πp - dubla - (prin suprapunerea a douǎ orbitale pz) care constituie a 2-a legatura dupa formarea legaturii simple σ.
Suprapunerea OA se realizeaza in doua zone si nu mai exista o axa de rotatie dar exista un plan nodal. Formarea acestei legaturi se poate reprezenta schematic astfel:
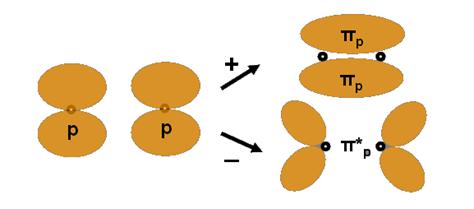
O astfel de legǎturǎ apare in urmǎtoarele exemple:
O2 O = O,
C2 , >C = C < sau
N2 ; N≡N - in ultimul caz existǎ in moleculǎ o legatura tripla (o legatura σ si doua legaturi π) este ilustrata pe fig 3.7. Se observa aici si forma orbitalilor de antilegatura, faptul ca volumul orbitalilor se mareste cu n si noua distributie a energiei orbitalilor ocupati dupa principiile ocuparii cu electroni a orbitalilor.
Metoda legaturii de valenta (LV)
- legatura se realizeaza prin perechi de electroni
- rezolva molecule mai complicate intr-un mod mai simplu decat OM. Majoritatea formii legaturilor chimice se explica prin hibridizare.
Hibridizarea este combinarea si redistribuirea orbitalelor unui atom cu orbitale de forma diferita dar de energie apropiata ale acelasi atom - se formeaza orbitale hibride. Acestea se combina apoi cu orbitalele altui atom formand orbitale de legatura, care se ocupa cu perechi de electroni cu spini opusi.
Orbitalele hibride (de legatura) au orientari bine determinate in spatiu. Ele tind sa se aranjeze astfel incat simetria sa fie maxima. Hibridizarea are loc in procesul formarii legaturii chimice.
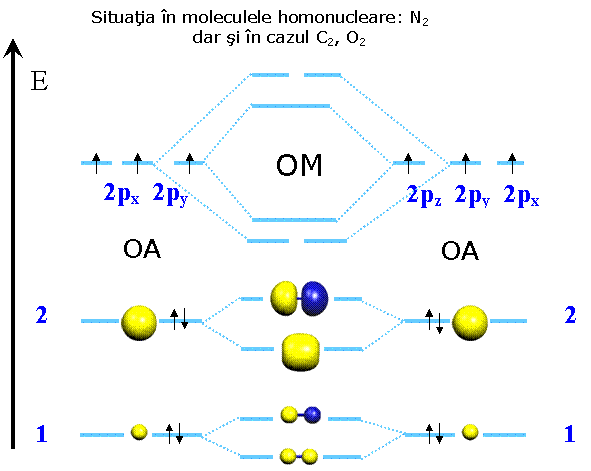
Fig. 3.7. OM din cateva molecule importante
Exemple:
4Be (prezinta hibridizare s-p) cu orientare liniara intre un orbital s si un orbital p ca de exemplu in:
X - Be - X
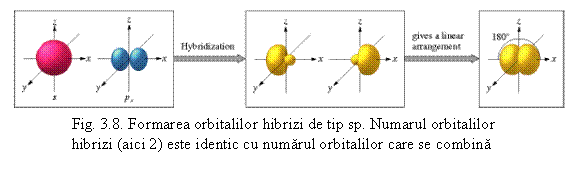 R - Be - R (vezi fig. 3.8)
R - Be - R (vezi fig. 3.8)
![]()
5B (prezinta hibridizare sp2) - cu orientare trigonala (vezi fig. 3.9) prin combinarea unui orbital s cu doi orbitali p ca de exemplu in BX3 sau BR3.
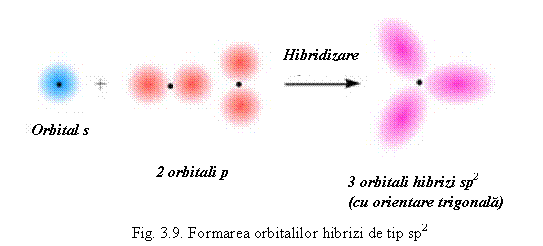
Lobul orbitalei p hibride disponibil pentru legatura este mai mare, deci permite o suprapunere mai mare cu orbitala celuilat atom, astfel legatura este mai puternica.
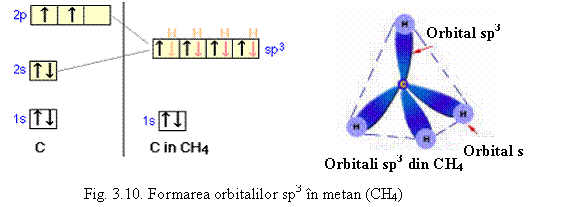
Carbonul este hibridizat sp3 numai in combinatii cu legaturi simple. In combinatii cu legaturi duble este hibridizat sp2 (orientare in triunghi) pentru cele trei legaturi simple σ, iar a patra legatura este π (care formeaza o legatura dubla impreuna cu una din legaturile σ ).
Etena, H2C=CH2, de exemplu, are structura:
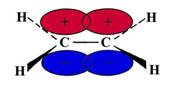
Are o legatura dubla σpp si o legatura πpp asa cum se vede din reprezentarea de mai sus. Legaturile C-H sunt legaturi σ . Hibridizarea sp2 duce la unghiul de 120o intre valentele C-H.
Legaturi intermoleculare (Forte van der Waals)
Sub aceasta denumire sunt cuprinse toate fortele care actioneaza intre molecule stabile. Aceste forte actioneaza intre molecule sau ioni si sunt mai slabe decat cele amintite sub denumirea de legaturi chimice. Exista doua componente ale acestor forte, una de atractie si alta de respingere. Daca consideram doar fortele care intervin in atractie acestea pot fi de trei tipuri:
a. Fortele London (forte de dispersie) care apar de exemplu intre moleculele monoatomice ale gazelor rare, dar care sunt cele mai generale, manifestandu-se intre orice tipuri de molecule, indiferent de simetria acestora sau chiar intre particule solide eventual suprapuse peste fortele amintite anterior.
b. Fortele Debye (forte de inductie) care apar in urma interactiunii unui dipol permanent al unei molecule cu un dipol indus intr-o alta molecula.
c. Fortele Keesom (numite si forte de orientare) rezultate din de atractia dintre sarcini electrice (prezente in cazul ionilor poliatomici), dintre dipoli (la moleculele cu dipolmoment permanent) sau dintre multipoli sau orice combinatii ale acestora.
Acestea au cateva caracteristici comune:
sunt forte de atractie slabe ce apar chiar la configuratii moleculare stabile,
intensitatea acestor forte este reflectata de punctele de fierbere ale substanteor respective.
Fortele London pot aparea datorita unor fluctuatii a electronilor fata de pozitia de echilibru fie spontane fie sub actiunea unor radiatii luminoase. Aceste fluctuatii dau nastere la asanumitii dipoli temporari. Acestia pot induce intr-o molecula invecinata fara dipol un "dipol temporar indus". Schematic, procesul de formare al dipolului temporar este:
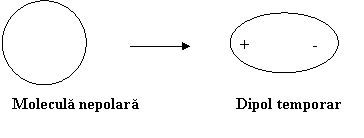
Apoi dipolul temporar induce la randul sau intr-o alta molecula fara dipol permanent un dipol temporar indus acestia atragandu-se reciproc.
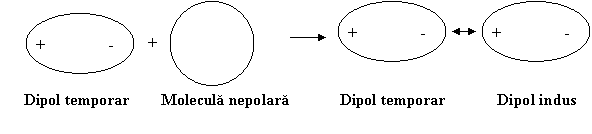 Energia potentialǎ a legǎturii nou formate, EpL, este puternic
dependentǎ de polarizabilitatea α si invers
proportionalǎ cu puterea a 6-a a distantei dintre centrele de
greutate ale moleculelor invecinate, r:
Energia potentialǎ a legǎturii nou formate, EpL, este puternic
dependentǎ de polarizabilitatea α si invers
proportionalǎ cu puterea a 6-a a distantei dintre centrele de
greutate ale moleculelor invecinate, r:
EpL=-3α2hνo/4r6
unde h este constanta lui Planck iar νo este frecveta de oscilatie a dipolului temporar. Se observǎ cǎ aceste forte scad foarte repede cu distanta r.
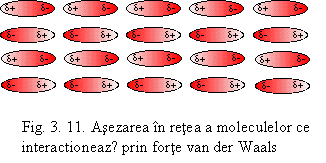 Fortele Keesom - de orientare - se manifestǎ numai in cazul
moleculelor cu dipoli permanenti care se atrag reciproc astfel ca polul
pozitiv al moleculei sǎ se pozitioneze in dreptul polului negativ al
moleculei invecinate (vezi fig. 3.11).
Fortele Keesom - de orientare - se manifestǎ numai in cazul
moleculelor cu dipoli permanenti care se atrag reciproc astfel ca polul
pozitiv al moleculei sǎ se pozitioneze in dreptul polului negativ al
moleculei invecinate (vezi fig. 3.11).
Energia potentialǎ a acestui tip de forte intermoleculare, EpK, este datǎ de ecuatia:
EpK = -2μ12μ22/3kTr6
 unde μ1, μ2 sunt dipolmomentele celor
douǎ molecule implicate, k este constanta lui Boltzmann, T - temperatura
absolutǎ si r - distanta dintre centrele de greutate ale celor
douǎ molecule. Se poate observa cǎ fortele de orientare depind
de valoarea momentului dipolar al moleculelor si scad de asemenea
proportional cu puterea a 6-a a distantei r dintre molecule.
unde μ1, μ2 sunt dipolmomentele celor
douǎ molecule implicate, k este constanta lui Boltzmann, T - temperatura
absolutǎ si r - distanta dintre centrele de greutate ale celor
douǎ molecule. Se poate observa cǎ fortele de orientare depind
de valoarea momentului dipolar al moleculelor si scad de asemenea
proportional cu puterea a 6-a a distantei r dintre molecule.
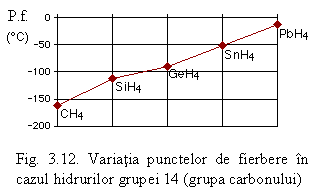
Un exemplu edificator privind efectul acestor forte este dat de hidrurile grupei 14 (vezi Fig. 3.12). Se poate observa cǎ in cazul acestor hidruri punctele de fierbere (P.f.) cresc regulat cu masa, respectiv cu volumul, moleculelor. In cazul hidrurilor polare fenomenul prezintǎ unele exceptii. Astfel in cazul hidrurilor calcogenilor punctele de fierbere cresc doar in cazul sulfului, seleniului si telurului:
Compusul P.f. (oC)
H2O 100
H2S -60,7
H2Se -41,5
H2Te -2,0
Acest lucru este rezultatul efectelor simultane ale fortelor London si Keesom, nota dominantǎ dand-o fortele London - prezente in cazul oricǎror molecule polare sau nepolare. Apa, care ar trebui sǎ aibǎ un punct de fierbere mult mai coborat, face exceptie datoritǎ unui alt tip de legǎturǎ dintre moleculele sale, ce urmeazǎ a fi prezentate in cele ce urmeazǎ (legǎtura de hidrogen).
Sǎ considerǎm acum si fortele repulsive care actioneazǎ intre molecule. Fortele repulsive cresc foarte repede cu distanta fiind de forma B/rn unde n = 9 - 12. Asadar luand in considerare atat fortele atractive cat si cele repulsive energia potentialǎ totalǎ in cazul interactiunilor van der Waals va fi datǎ in functie de molecule de o ecuatie de tipul:
Ep = -A/r6 + B/rn (n = 9 12)
unde A si B sunt constante ce depind de natura moleculelor, r fiind distanta dintre douǎ molecule. Ep are valori de ordinul 1 - 2 kcal/mol (sau 0,1 eV) fiind mult mai slabe decat legǎturile chimice covalente.
Legǎtura de hidrogen
O legǎrurǎ de hidrogen este un tip special de legǎturǎ intermolecularǎ de tip dipol-dipol, mai bogatǎ in energie decat fortele van der Waals, care apare doar in cazul existentei in respectiva moleculǎ a unui atom de hidrogen legat covalent de un atom puternic electronegativ (F, O, N etc). Legǎtura se stabileste intre atomul de hidrogen legat si un alt atom electronegativ al unei molecule invecinate (in acest caz vorbim de legǎturǎ de hidrogen intermolecularǎ) sau intre hidrogenul legat si un alt atom electronegativ invecinat din aceeasi moleculǎ (legǎturǎ intramolecularǎ). Un exemplu este legǎtura de hidrogen intermolecularǎ dintre moleculele apei care este prezentatǎ schematic pe fig. 3.13. Aceastǎ legǎturǎ determinǎ ca moleculele sǎ se atragǎ reciproc si sǎ aparǎ o orientare particularǎ intre moleculele apei.
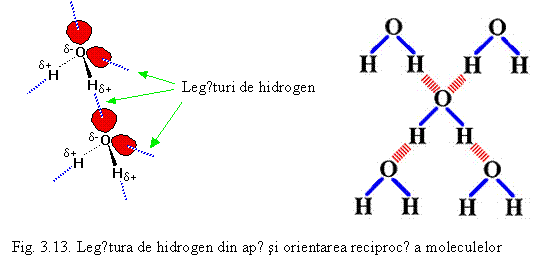
In general legǎtura de hidrogen este mai puternicǎ decat fortele van der Waals dar mai slabǎ decat legǎturile covalente, ionice sau metalice amintite. Legǎtura de hidrogen este responsabilǎ pentru punctul de fierbere ridicat al apei (100oC) comparativ cu cel al celorlalte hidruri din grupa 16. Cauza este realizarea unor mase moleculare mai mari decat par in conformitate cu formula chimicǎ datoritǎ "asocierii" mai multor molecule. Acest tip de legaturǎ stǎ la baza structurilor tridimensionale ale proteinelor si acizilor nucleici precum si specificitǎtii efectelor acestora.
Atomul de hidrogen legat de un atom puternic electronegativ (F, O, N) este un "donor de legǎturǎ de hidrogen". Atomul electronegativ al unei molecule sau structuri invecinate este "acceptorul de legǎturǎ de hidrogen", indiferent dacǎ acesta este sau nu legat de un alt atom de hidrogen. Exemple de legaturi de hidrogen sunt cele dintre moleculele apei, alcoolului etilic sau amoniacului. In toate aceste cazuri acceptorul de legǎturǎ de hidrogen este legat si el de un atom de hidrogen. Existǎ insǎ si o legǎturǎ de hidrogen la care participǎ carbonul doar atunci cand acesta este legat si de alti atomi electronegativi. Este cazul cloroformului (CHCl3) unde atomul de hidrogen, partial dezgolit de electroni, poate intra in interactiune cu atomi electronegativi (posesori de nori electronici negativi) apartinand unor alte molecule aflate in aceeasi solutie.
Legatura de hidrogen este adesea descrisǎ ca o interactiune electrostaticǎ dipol-dipol. Totusi are unele caracteristici ale legǎturii covalente fiind directionatǎ, puternicǎ si produce o distantǎ interatomicǎ mai scurtǎ decat fortele van der Waals. Astfel intr-o legǎturǎ de hidrogen X-HY unde X si Y sunt atomi electronegativi distanta X-H este ~1,1 Å pe cand distantǎ HY este de 1,6 - 2 Å. Implicand un numǎr limitat de parteneri in legǎturǎ aceasta se manifestǎ ca un fel de valentǎ. Lichidele in care se manifestǎ legǎturi de hidrogen se denumesc "lichide asociate". Exemple de astfel de lichide sunt apa, alcoolii, amoniacul si aminele, acidul fluorhidric sau diversele amestecuri ale acestora cu substante continand atomi electronegativi legati sau nelegati de un atom de hidrogen.
Respingerea Perechilor de Electroni din Stratul de Valenta (RPESV)
Teoria (sau modelul) RPESV reprezinta un mijloc simplu pentru prezicerea structurilor geometrice ale combinatiilor elementelor din grupele principale. Rezultatele sale sunt similar cu cele obtinute prin metoda hibridizarii orbitalilor atomici dar este mai simpla si mai directa. Teoria RPESV se bazeaza pe idea ca perechile sau grupurile de electroni din stratul de valenta (fie de legatura, fie electroni neparticipanti) se vor respinge asezandu-se la o distanta maxim posibila. Consecinta va fi aceea ca moleculele adopta o geometrie care sa le permita perechilor de electroni sa se aseze cat mai departe unele de altele - geometrie care este foarte apropiata de geometria observata experimental.
Prezentam in continuare cateva cazuri de geometrii intalnite frcvent in chimie.
In rezumat, ori de cate ori intalnim in jurul unui atom central un numar de perechi de electroni (de legatura sau neparticipanti) acestia vor tinde sa se aranjeze dupa aceeasi geometrie (v. Fig.3.14) anume:
2 perechi la atomul central - geometrie liniara,
3 perechi la atomul central - geometrie trigonala,
4 perechi la atomul central - geometrie tetraedrica,
5 perechi la atomul central - geometrie bipiramidal-trigonala,
6 perechi la atomul central - geometrie octaedrica,
7 perechi la atomul central - un numar de geometrii mai putin uzuale.
Numararea electronilor se face astfel:
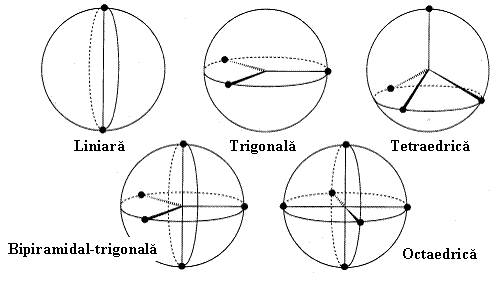
Fig. 3.14. Geometrii explicabile prin modelul RPESV frecvent utilizate
Pentru moleculele covalente cu legaturi simple, se numara mai intai toti electronii de valenta ai atomului central la care se mai adauga cate un electron pentru fiecare atom legat (ligand). De ex. in cazul BCl3: exista trei electroni pe ultimul strat la atomul de bor la care se adauga trei electroni pentru fiecare atom de clor. Rezulta 3 perechi de electroni.
Cand sunt prezente si legaturi duble se numara mai intai cei patru electroni din legatura dubla care formeaza toti un singur grup.
Cateva exemple de geometrii sunt prezentate in cele ce urmeaza.
Geometria liniara Moleculele cu doua perechi (sau doua grupuri) de electroni in jurul atomului central prezinta un unghi de 180o intre valente molecula avand in consecinta forma liniara. Exemplele prezentate in Fig. sunt pentru moleculele BeCl2, CO2 respectiv pentru ionul NO2+.
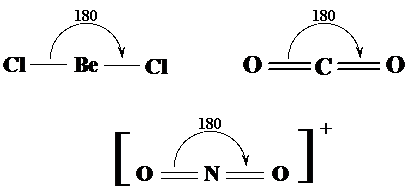
Fig. 3.15. Exemple de molecule cu forma liniara
Geometria trigonala Este prezenta in molecule ca BF3, NO2 si in ionul NO2-. In cazul azotului (cu 5 electroni pe utimul strat) exista aici si electroni neparticipanti (Fig. 3.16).
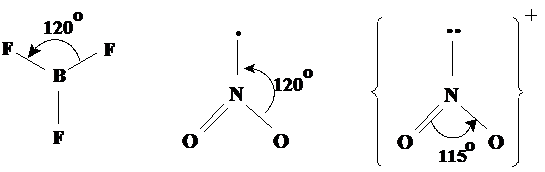
Fig. 3.16. Exemple de molecule cu forma trigonala.
Observatie: Repulsia dintre perechile (grupele) de electrón un este independenta de numarul electronilor din grup sau de faptul ca electronii sunt neparticipanti sau nu. Perechile de electroni neparticipanti, nefiind atrase de un nucleu ocupa un spatiu mai extins de cat o pereche de electroni de legatura. Consecinta este usor de anticipat: perechea de electroni neparticipanti provoaca o micsorare a unghiului dintre electronii de legatura. Acest lucru va ramane valabil si in cazul celorlalte geometrii. In plus, repulsia dintre perechile (grupele) de electroni nu este independenta de numarul de electroni din grup. O preche de electroni neparticipanti va respinge ceva mai puternic perechile de electroni de legatura decat un singur electron.
Geometria tetraedrica Are la baza orientarea tetraedrica a electronilor dar geometria molecule este influentata de electronii neparticipanti in sensul amintit anterior. Exemplele de molecule din aceasta categorie sunt: CH4, NH3, H2O (Fig.3.17).
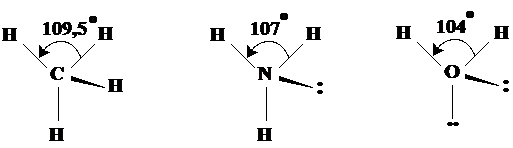
Fig. 3.17. Exemple de molecule cu forma tetraedrica. Se observa
micsorarea unghiurilor dintre electronii legaturilor.
Geometria bipiramidal-trigonala PCl5 are o geometrie din aceasta categorie deoarece cele 5 perechi de electroni se resping la distanta maxima fromand o bipiramida trigonala (Fig.3.18).

Fig. 3.18. Geometria bipiramidal-trigonala a PCl5
SF4 respectiv XeF2 prezinta geometrii modificate de existenta electronilor neparticipanti. Acestia vor prefer orientarea ecuatoriala pentru a minimize repulsia deorece distanta dintre atomii situati la 120o este mai mare decat intre atomii situati la 90o. Astfel SF4 ar putea in principiu exista in doua structure (a) si (b) redate in fig. 3.19. Este preferata forma (b) fata de (a) intotdeauna.
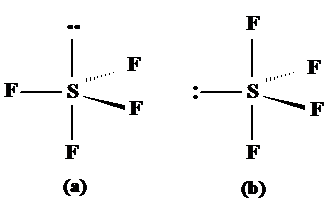
Fig. 3.19. Exemple de molecule ce au electroni neparticipanti
cu forma bipiramidal-trigonala.
Din acelasi motiv BF3 are forma apropiata de T iar XeF2 forma liniara pe cand SF4 adopta o forma deosebita (de sea) dupǎ cum se observǎ in fig. 3.20.
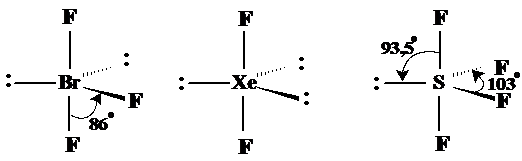
Fig. 3.20. Exemple de molecule cu forma bipiramidal-trigonala.
Geometria octaedrica Duce de asemenea la situatii in care respingerea plaseaza atomii legati la atomul central la distanta maxima posibila. Un exemplu din aceasta geometrie este SF6. Unde exista electroni neparticipanti apar geometrii particulare, de exemplu JF5 sau XeF4 (v. Fig. 3.21).

Fig. 3.21. Exemple de molecule cu forma octaedrica.
In aceste cazuri electronii prefer orientarea axiala a perechilor de electroni neparticipanti.
Webografie:
https://www.chem1.com/acad/pdf/c1xbond.pdf
Liaison Chimique,Xavier Assfeld, Laboratoire de Chimie théorique, Entrée 2A, 7ème niveau,
https://en.wikipedia.org/wiki/Hydrogen_bond#Bonding
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |