
Reducerea altor oxizi importanti in siderurgie
Reducerea cu CO, H2 si C
Reducerea oxizilor de mangan are loc la elaborarea fontei care contine (0,5 - 2,5 % Mn) si a feroaliajelor cu mangan care contine pana la 80 %Mn.
Oxizii superiori MnO2, Mn2O3, Mn3O4 sunt usori reductibili si pot fi redusi cu CO si H2, reactiile sunt exoterme, cu exceptia Mn3O4 cu H2 (ΔH > 0).
2MnO2 + CO = Mn3O4 + CO2 ΔG![]() = -233 062 + 33,93
= -233 062 + 33,93![]() (J)
(J)
3Mn3O4 + CO = 2Mn3O4 + CO2 ΔG![]() = -208 569+ 5,82
= -208 569+ 5,82![]() (J)
(J)
Mn3O4
+ CO = 3MnO + CO2 ΔG![]() = -215 035+ 37,65
= -215 035+ 37,65![]() (J)
(J)
MnO
+ CO = Mn + CO2 ΔG![]() = +116 756 + 4,63
= +116 756 + 4,63![]() (J)
(J)
2MnO2
+ H2 = Mn2O3 + H2O ΔG![]() = -189 532 + 9,54
= -189 532 + 9,54![]() (J)
(J)
3Mn2O3
+ H2 = Mn3O4 + H2O ΔG![]() = -10 116 - 12,24
= -10 116 - 12,24![]() (J)
(J)
Mn3O4
+ H2 = 3 MnO + H2O ΔG![]() = + 20 316 - 40,35
= + 20 316 - 40,35![]() (J)
(J)
Mn
+ H2 = Mn + H2O ΔG![]() = +147 249 + 23,48
= +147 249 + 23,48![]() (J)
(J)
Oxidul inferior de mangan MnO nu se poate reduce cu CO sau H2, deoarece ΔG > 0 pentru orice temperatura.
In cazul dizolvarii manganului in fier:
MnO
+ CO = [Mn]1% + CO2 ΔG![]() = +120 841 - 33,55
= +120 841 - 33,55![]() (J)
(J)
MnO
+ H2 = [Mn]1% + H2O ΔG![]() = +151 334 - 14,70
= +151 334 - 14,70![]() (J)
(J)
Dar
nici in acest caz ΔG![]() nu este negativ, de aceea el se reduce numai cu carbonul
la temperatura de 1683 K (1410 oC),
care este temperatura de echilibru a reactiei de reducere cu carbonul.
nu este negativ, de aceea el se reduce numai cu carbonul
la temperatura de 1683 K (1410 oC),
care este temperatura de echilibru a reactiei de reducere cu carbonul.
MnO + C = Mn + CO ΔG![]() = 287 544 - 169,82
= 287 544 - 169,82![]()
→ Te = 1410 sC.
In realitate reducerea MnO cu carbon incepe mai repede datorita dizolvarii manganului in fier (la 1381 oC) si formarii carburii Mn3C ( in jur de 1250 oC), dar aliajul se imbogateste in carbon.
MnO
+ ![]() C =
C = ![]() Mn3C + CO ΔG0 = 255 315 - 170,35
Mn3C + CO ΔG0 = 255 315 - 170,35![]() (J)
(J)
→ Te = 1226 sC
MnO
+ C = [Mn]Fe + CO ΔG0
= 287 544 -172,78![]() (J)
(J)
→ Te = 1380 sC
Carbonul din fonta ajunge la mai mult de 4% C, iar in feromangan la circa 7% C.
Reducerea silicei (SiO2) este un proces necesar la elaborarea fontei care contine 0,8 - 1 %Si, a ferosiliciului in care continutul de siliciu poate ajunge la 90 % si a siliciului tehnic (99,9 % Si).
Silicea este un oxid foarte stabil si din acest motiv nu poate fi redus cu CO sau H2. Calculele arata ca:
![]() SiO2 + CO =
SiO2 + CO = ![]() Si + CO2 ΔG > 0; Kp
=
Si + CO2 ΔG > 0; Kp
= ![]()
![]() SiO2 + H2 =
SiO2 + H2 = ![]() Si + H2O ΔG > 0; Kp
=
Si + H2O ΔG > 0; Kp
= ![]() pentru 2400 K, ceea ce
confirma imposibilitatea reducerii SiO2 cu CO sau H2.
De aceea reducerea silicei se
poate realiza numai cu carbon.
pentru 2400 K, ceea ce
confirma imposibilitatea reducerii SiO2 cu CO sau H2.
De aceea reducerea silicei se
poate realiza numai cu carbon.
Reactiile de reducere cu carbon sunt:
La T > 1500 sC:
SiO2
+ 2C = Si + 2CO ΔG0 = 666 457 - 364,8![]() (J)
(J)
→ Te = 1554 sC;
SiO2
+ 3C = SiC + 2CO ΔG0 = 561 150 - 367,194![]() (J)
(J)
Te = 1255 sC.
Dizolvarea siliciului in fier usureaza reducerea, coborand temperatura de echilibru la Te = 1128 sC, conform reactiei:
SiO2
+ 2C = [Si]Fe + 2CO ΔG0 = 541 024 - 386,22![]() (J)
(J)
→ Te = 1128 sC.
Reducerea cu carbon in prezenta fierului are loc cu formarea compusului definit FeSi pana la consumarea fierului, dupa reactia:
SiO2 + 2C + Fe = FeSi + 2CO ΔH > 0
Carbura de siliciu formata in procesul de reducere cu carbon este distrusa de fierul din feroaliaj pana la consumarea fierului, incepand cu temperatura de 1083 K, conform reactiei:
SiC
+ Fe = FeSi + C ΔG0 = 41 382 - 38,2![]() (J)
(J)
Te = 810 sC.
Siliciul este un element grafitizant, care impiedica dizolvarea carbonului in fier. Cu cat continutul de siliciu al aliajului este mai mare, cu atat continutul de carbon este mai scazut.
Feroaliajele cu siliciu nu rezulta niciodata carburate.
Reducerea Cr2O3 are importanta la fabricarea ferocromului (Cr = 65 -85 %). Datorita reductibilitatii sale scazute, Cr2O3 nu poate fi redus cu CO sau cu H2 deoarece pentru reactiile respective ΔG >0. Calculele arata ca la 1800 K, constanta de echilibru pentru cele doua reactii are urmatoarele valori:
![]() Cr2O3 + CO =
Cr2O3 + CO = ![]() Cr + CO2 ΔG0 > 0; Kp =
Cr + CO2 ΔG0 > 0; Kp = ![]() ;
;
![]() Cr2O3 + H2 =
Cr2O3 + H2 = ![]() Cr + H2O ΔG0 > 0; Kp =
Cr + H2O ΔG0 > 0; Kp = ![]() .
.
De aceea Cr2O3 in furnal si cuptoarele de feroaliaje este redus de catre carbon. Reactiile sunt :
La T > 1050 oC
Cr2O3
+ C = 2CrO + CO ΔG![]() = + 545 742 - 325,34
= + 545 742 - 325,34 ![]() (J)
(J)
→ Te = 1677K (1404 sC).
CrO
+ C = Cr + CO ΔG![]() = + 349002 - 97,17
= + 349002 - 97,17 ![]() (J)
(J)
→ Te = 3591K (3318sC).
La T < 1050 oC
Cr2O3
+ 3C = 2Cr + 3CO ΔG![]() = 796 678 - 519,7
= 796 678 - 519,7![]() (J)
(J)
→ Te = 1533 K (1260 sC).
Deoarece temperatura de echilibru a reactiei de reducere a monoxidului de crom cu carbonul este foarte mare si nu poate fi atinsa in nici un agregat metalurgic, reactia practic nu are loc.
La elaborarea ferocromului, cromul se dizolva in fier, iar temperatura de reducere coboara la 1508 K (1235 sC).
Cr2O3
+ 3C = 2[Cr]Fe + 3CO ΔG0= 796 678 -
528,2![]() (J)
(J)
→ Te = 1235 sC.
In cazul formarii carburilor de crom dintre care cea mai stabila este Cr7C3, temperatura de echilibru coboara la 1278 K (1205 sC), dupa reactia:
![]() Cr2O3 +
Cr2O3 + ![]() C =
C = ![]() Cr7C3 + 2CO ΔG0
= 510.572 - 364,18
Cr7C3 + 2CO ΔG0
= 510.572 - 364,18![]() (J)
(J)
→ Te = 1130 sC.
Din acest motiv ferocromul rezulta intotdeauna carburat putand dizolva pana la 9 %C.
O particularitate a reducerii Cr2O3 este aceea ca in minereurile de crom el nu se afla in stare pura, ci sub forma unor minerale complexe care se reduc mai greu, ca de exemplu:
- FeO· Cr2O3 - cromit;
- (Mg,Fe)O· Cr2O3 - magnocromit;
- (Mg,Fe)O·(Al,Cr)2O3 - crompicolit.
In acest caz pe langa crom se reduce si fierul, astfel:
FeO· Cr2O3 + 4C = [Fe]Cr + 2 [Cr]Fe + 4 CO.
Reducerea oxizilor de vanadiu V2O5, V2O4, V2O3, VO este un proces de baza la fabricarea ferovanadiului si a unor fonte aliate cu vanadiu. Oxizii V2O5 si V2O4 nu pot fi practic redusi cu CO si H2 deoarece temperatura de incepere a reactiei este de neatins in agregatele metalurgice, cu exceptia reducerii cu H2 a oxidului V2O4, conform reactiilor:
V2O5
+ CO = V2O4 + CO2 ΔG![]() = -166.379 + 12,05
= -166.379 + 12,05![]() (J)
(J)
→Te = 13.300 K
V2O5
+ H2 = V2O4 + H2O ΔG![]() = -135.886 + 16,1
= -135.886 + 16,1![]() (J)
(J)
→Te = 8440 K
V2O4
+ CO = V2O3 + CO2 ΔG![]() = -73 950 - 10,95
= -73 950 - 10,95![]() (J) → Te
= 6753 K
(J) → Te
= 6753 K
V2O4
+ H2 = V2O3 + H2O ΔG![]() = -43 457 - 39,06
= -43 457 - 39,06![]() (J) → Te = 1112 K
(839 oC)
(J) → Te = 1112 K
(839 oC)
Trioxidul
de vanadiu nu se poate reduce cu CO sau cu H2 deoarece au ΔG![]() mai mare decat zero. El se reduce numai cu carbonul,
dupa reactia:
mai mare decat zero. El se reduce numai cu carbonul,
dupa reactia:
![]() V2O3
+ 2C =
V2O3
+ 2C = ![]() V + 2CO ΔG
V + 2CO ΔG![]() = 602 796 - 350,57
= 602 796 - 350,57![]() (J) → Te
= 1719 K (1446 oC)
(J) → Te
= 1719 K (1446 oC)
Reducerea oxizilor de titan este un proces de baza la fabricarea ferotitanului si are loc in succesiunea TiO2→ Ti3O5→ Ti2O3→ TiO →Ti. Numai TiO2 si Ti3O5 pot fi redusi cu CO sau H2 la circa 1050 oC.
3TiO2 + CO = Ti3O5 + CO2
3TiO2 + H2 = Ti3O5 + H2O
Ti3O5 + CO = Ti2O3 + CO2;
Ti3O5 + H2 = Ti2O3 + H2O.
Numai Ti2O3 si TiO pot fi redusi cu carbon conform reactiilor:
Ti2O3
+ C = 2 TiO + CO ΔG![]() = 369 998 - 182,94
= 369 998 - 182,94![]() (J) → Te = 2023 K
(1750 oC);
(J) → Te = 2023 K
(1750 oC);
TiO + C = Ti + CO ΔG![]() = 494 913 - 188,1
= 494 913 - 188,1![]() (J) → Te = 2631 K
(2358 oC).
(J) → Te = 2631 K
(2358 oC).
Procesul este insotit de dizolvarea titanului in fier si de formarea carburii de titan TiC, ambele favorizand reactia de reducere.
Reducerea oxizilor de wolfram are loc la producerea pulberilor de wolfram si a ferowolframului. Acesti oxizi au reductibilitate relativ mare de aceea pot fi redusi atat cu CO cat si cu hidrogen. Reactiile decurg in succesiunea: WO3→ W4O11→WO2→W.
4WO3
+ H2 = W4O11 + H2O ΔG![]() = 56 818 - 60,292
= 56 818 - 60,292![]() (J)
(J)
![]() W4O11
+ 2H2 =
W4O11
+ 2H2 = ![]() WO2 + 2 H2O
ΔG
WO2 + 2 H2O
ΔG![]() = 10 443 - 93,797
= 10 443 - 93,797![]() (J)
(J)
WO2
+ 2H2= W + 2 H2O ΔG![]() = 21 200 - 16,198
= 21 200 - 16,198![]() (J)
(J)
4WO3
+ CO = W4O11 + CO2 ΔG![]() = 26 347 - 34,145
= 26 347 - 34,145![]() (J)
(J)
![]() W4O11
+ 2CO =
W4O11
+ 2CO = ![]() WO2 + 2CO2 ΔG
WO2 + 2CO2 ΔG![]() = -50 498 - 37,502
= -50 498 - 37,502![]() (J)
(J)
WO2
+ 2CO = W + 2CO2 ΔG![]() = - 39 741 - 40,09
= - 39 741 - 40,09![]() (J)
(J)
Oxizii WO2 si WO3 se reduc numai cu carbon. Din reactii pot rezulta fie wolfram fie o carbura de wolfram, conform reactiilor:
WO2
+ 2C = W + 2CO ΔG![]() = 301 795 - 308,97
= 301 795 - 308,97![]() (J)
(J)
→Te = 976 K (703 oC)
WO2
+ ![]() C =
C = ![]() W2C + 2CO ΔG
W2C + 2CO ΔG![]() = 282 751 - 328,35
= 282 751 - 328,35![]() (J)
(J)
→Te = 861 K (588 oC)
![]() WO3 + 2C =
WO3 + 2C = ![]() W + 2CO ΔG
W + 2CO ΔG![]() = 327 231 - 339,7
= 327 231 - 339,7![]() (J)
(J)
→Te = 963 K (690 oC)
![]() WO3 +
WO3 + ![]() C =
C = ![]() W2C + 2CO ΔG
W2C + 2CO ΔG![]() = 308 187 - 357,4
= 308 187 - 357,4![]() (J)
(J)
→Te = 862 K (589 oC).
Deoarece reactiile de reducere cu formarea carburii au loc la temperaturi mai mici decat cele cu formarea metalului, ferowolframul rezulta intotdeauna carburat, dar continutul de carbon nu depaseste 3,5 - 4%.
Reducerea oxidului de molibden (MoO2) este utilizata la fabricarea feromolibdenului. Se reduce usor cu CO si H2 dupa reactiile:
MoO2
+ 2CO = Mo + 2CO2 ΔG![]() = -5860 - 66,362
= -5860 - 66,362![]() (J)
(J)
→Te = 921 K (648 oC)
MoO2
+ 2H2 = Mo + 2H2O ΔG![]() = 55 081 - 62,657
= 55 081 - 62,657![]() (J)
(J)
→Te = 879 K (606 oC)
Datorita reactiei 2CO = CO2 + C molibdenul se carbureaza formand carbura Mo2C.
MoO2
+ 2C = Mo + 2CO ΔG![]() = 335 677 - 355,64
= 335 677 - 355,64![]() (J)
(J)
→Te = 944 K (671 oC)
MoO2
+ 3C = Mo2C + 2CO ΔG![]() = 344 467- 365,68
= 344 467- 365,68![]() (J)
(J)
→Te = 942 K (669 oC).
Oxizii de nichel (NiO) se reduc usor cu CO si H2, iar oxidul de cobalt (CoO) se reduc usor numai cu H2.
2NiO
+ 2CO = 2Ni + 2CO2 ΔG![]() = -30.889 -39,344
= -30.889 -39,344![]() (J)
(J)
→Te = 785 K (512 oC)
NiO + H2 = Ni + H2O ΔG![]() = -32 312 -50,01
= -32 312 -50,01![]() (J)
(J)
→Te = 646 K (373 oC)
2CoO
+ 2CO = 2CO + 2CO2 ΔG![]() = -87 058 + 13,98
= -87 058 + 13,98![]() (J)
(J)
→Te = 6227 K (5954 oC)
CoO + H2 = Co + H2O ΔG![]() = -13 509 -35,41
= -13 509 -35,41![]() (J)
(J)
→Te = 381 K (108 oC).
Oxizii de zirconiu (ZrO2) si de niobiu (Nb2O5) nu se reduc cu CO si H2 fiind greu reductibili. Ei se reduc numai cu carbonul dupa reactiile.
ZrO2
+ 2C = Zr + 2CO ΔG![]() = 831 240 - 340,7
= 831 240 - 340,7![]() (J)
(J)
→Te = 2439 K (2166 oC)
![]() Nb2O5
+ 2C =
Nb2O5
+ 2C = ![]() Nb + 2CO ΔG
Nb + 2CO ΔG![]() = 392 943 - 285,95
= 392 943 - 285,95![]() (J)
(J)
→Te = 1374 K (1101 oC).
Reducerea cu siliciu
Reducerea oxizilor metalici cu siliciu are loc conform reactiei generale:
![]() MexOy + Si
MexOy + Si ![]() Me + SiO2 ΔH < 0.
Me + SiO2 ΔH < 0.
Reactia de reducere cu siliciu este exoterma (tabelul urmator) insa pentru majoritatea oxizilor care vin in considerare la producerea feroaliajelor, cantitatea de caldura degajata nu este suficienta pentru desfasurarea proceselor fara aport exterior de caldura sau cu adaosuri de oxizi (de exemplu oxizi de fier, in loc de fier vechi), care necesita consum suplimentar de reducator.
O cale de realizare a regimului termic necesar desfasurarii procesului este utilizarea cuptoarelor electrice cu arc, caldura necesara fiind furnizata si de energia electrica.
Viteza reactiei de reducere cu siliciu, ca reactie exoterma, va fi mai mare la temperaturi joase, ceea ce inseamna ca o crestere prea accentuata a temperaturii va conduce la diminuarea gradului de reducere si pierderea unei mari cantitati de zgura. Concomitent, reducatorul nefolosit se va dizolva in feroaliaj. De aceea, este necesar sa se stabileasca temperatura optima de lucru, in vederea reducerii cat mai avansate a oxizilor, in conditiile ramanerii unei cantitati mici de reducator nefolosit.
Din figura 3.18 se poate stabili temperatura de echilibru pentru reactiile de reducere cu Si a principalilor oxizi intalniti in industria feroaliajelor functie de care se poate determina temperatura de lucru pentru fiecare proces in parte.

ZrO2 + Si = Zr + SiO2 DG , [J]
 50 + 209.275
50 + 209.275
2/3 Al2O3 + Si = 4/3 Al + SiO2
40 + 167.420
30 2/3 B2O3 + Si = 4/3 B + SiO2 + 125.565
20 + 83.710
10 TiO2 + Si = Ti + SiO2 + 41.855
0 0
- 10 2MnO + Si = 2Mn + SiO2 - 41.855
- 20 2/3 Cr2O3 + Si = 4/3Cr + SiO2 - 83.710
2/5 Nb2O5 + Si = 4/5 Nb + SiO2
- 40 2/5V2O5 + Si = 4/5V + SiO2 - 167.420
- 50 2FeO + Si = 2Fe + SiO2 - 209.275
![]() - 60 2/3WO3 + Si = 2/3W
+ SiO2 -
251.130
- 60 2/3WO3 + Si = 2/3W
+ SiO2 -
251.130
- 70
- 80
2/3MoO3 + Si = 2/3Mo + SiO2
1700 1800 1900 2000 2100
Fig. 3.18. Variatia cu temperatura a entalpiei libere a reactiilor
de reducere cu siliciu a oxizilor
In tabelul de mai jos sunt prezentate principalele caracteristici termodinamice ale reactiilor de reducere ale unor oxizi metalici cu siliciu.
Caracteristicile reactiilor de reducere cu siliciu
|
Reactia |
Kp |
DG , in J/cal |
|
|
|
|
|
| ||
|
|
|
|
|
2MnO + Si = 2Mn + SiO2 |
|
|
|
|
|
|
|
| ||
|
| ||
|
|
|
|
|
MoO2 + Si = Mo + SiO2 |
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
2FeO + Si = 2Fe + SiO2 |
|
|
|
MnO2 + Si = Mn + SiO2 | ||
|
|
|
|
|
| ||
|
| ||
|
ZrO2 + Si = Zr + SiO2 |
|
|
|
WO2 + Si = W + SiO2 |
|
|
|
TiO2 + Si = Ti + SiO2 |
|
|
|
|
|
|
|
2MgO + Si = 2Mg + SiO2 |
|
|
O particularitate a reducerii cu siliciu o constituie formarea de SiO2, oxid puternic acid, pe cand unii oxizi care urmeaza sa fie redusi cu siliciu au caracter bazic. In aceste conditii, silicea rezultata din proces se combina cu o parte din oxidul supus reducerii, imobilizandu-l in zgura. In consecinta este necesar sa se foloseasca si un fondant bazic care sa se combine cu silicea. Folosirea de fondanti conduce insa la cresterea cantitatii de zgura, deci implicit la marirea pierderii de element util in zgura. Din acest motiv si folosirea fondantilor trebuie facuta cu discernamant, pentru optimizarea gradului de reducere.
Siliciul se poate folosi sub forma de ferosiliciu cu 75.90% Si sau sub forma feroaliajului complex dintre siliciu si elementul al carui oxid urmeaza sa fie redus (Fe-Me-Si).
Folosirea feroaliajului complex cu siliciu este practicata frecvent la elaborarea multor feroaliaje afinate, procedeul constand din doua etape:
- producerea feroaliajului complex cu siliciu, prin reducerea cu carbon a oxidului metalic in prezenta de silice, sau reducerea cu siliciu a oxidului respectiv folosind un exces de siliciu;
- oxidarea siliciului din feroaliajul complex cu ajutorul oxidului metalic.
Reducerea cu aluminiu
Reducerea cu aluminiu este recomandata in cazul in care feroaliajul nu trebuie sa contina carbon, iar continutul de siliciu trebuie sa fie scazut.
Procesul de reducere are loc conform reactiei:
![]() MexOy + 2Al =
MexOy + 2Al = ![]() Me + Al2O3 ΔH > 0.
Me + Al2O3 ΔH > 0.
Procesul de cu aluminiu este un proces intotdeauna exoterm uneori puternic exoterm.
In procesele de reducere cu aluminiu se degaja o cantitate mare de caldura.
Caldura produsa in reactia de reducere (Qr ) trebuie sa contribuie la incalzirea si topirea aliajului si zgurei (Qt), la acoperirea pierderilor prin radiatie, conductibilitate si convectie (Qp), la incalzirea captuselii refractare (Qi). La aceasta se adauga sau se scade caldura de formare a compusilor din zgura sau aliaj (Qf), in functie de caracterul procesului (exoterm sau endoterm). Pentru ca procesul sa decurga fara aport exterior de caldura (prin incalzire cu combustibil sau cu energie electrica), trebuie sa existe un exces de caldura (Qe) care sa supraincalzeasca feroaliajul si zgura, astfel incat acestea sa se mentina lichide pentru a se putea separa.
Deci:
Qe = Qr + Qf - (Qt + Qp + Qi).
Valoarea Qe, daca este prea mare, procesul decurge exploziv, producandu-se pierderi de materiale si conditii periculoase de lucru.
Variatia cu temperatura a entalpiei libere pentru aceste procese este aratata in figura 3.19.
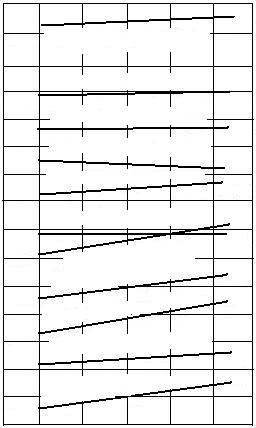 + 10 + 41.855
+ 10 + 41.855
 0 ZrO2
+ 4/3 Al = Zr + 2/3 Al2O3 0 J
0 ZrO2
+ 4/3 Al = Zr + 2/3 Al2O3 0 J
- 10 - 41.855
2/3 B2O3 + 4/3 Al = 4/3 B + 2/3 Al2O3
- 30 TiO2 + 4/3 Al = Ti + 2/3 Al2O3 - 125.565
- 40 SiO2 + 4/3 Al = Si + 2/3 Al2O3 - 167.420
- 50 2MnO + 4/3 Al = 2Mn + 2/3 Al2O3 - 209.275
- 60 - 251.130
2/3Cr2O3 + 4/3Al = 4/3Cr + 2/3Al2O3
- 80 2/5Nb2O5 + 4/3Al = 4/5Nb + 2/3Al2O3 - 334.840
2/5V2O5 + 4/3Al = 4/5 V + 2/3Al2O3
- 90 - 376.695
- 100 2FeO + 4/3Al = 2Fe + 2/3Al2O3 - 418.550
- 110 2/3WO3 + 4/3 Al = 2/3W + 2/3Al2O3 - 460.405
- 120 - 502.260
2/3MoO+ 4/3Al = 2/3 Mo + 2/3Al2O3
- 140 - 585.970
1700 1800 1900 2000 2100 T, K
Fig. 3.19. Variatia potentialului termodinamic al reactiilor
de reducere a oxizilor cu aluminiu
In tabelul urmator sunt prezentate principalele caracteristici termodinamice ale reactiilor de reducere cu aluminiu.
Caracteristicile reactiilor de reducere cu aluminiu
|
Reactia |
log Kp |
DG , in J/cal |
|
|
|
|
|
2CaO + |
|
|
|
3BaO2 + 2Al = Al2O3 + 3BaO | ||
|
|
|
|
|
|
|
|
|
|
|
|
|
2FeO + |
|
|
|
MnO2 + |
|
|
|
|
|
|
|
2MnO + |
|
|
|
|
|
|
|
MoO2 + |
|
|
|
|
|
|
|
2NbO + |
|
|
|
|
|
|
|
TiO2 + |
|
|
|
2TiO2 + |
|
|
|
|
|
|
|
2VO + |
|
|
|
|
|
|
|
WO2 + |
|
|
|
ZrO2 + |
|
|
Pentru diminuarea acestui pericol se actioneaza in sensul prelungirii duratei reactiei de reducere (prin incarcarea succesiva a amestecului), marind astfel Qp.
Se poate mari si Qt prin folosirea ca sursa de fier a fierului vechi. Un rol insemnat in conducerea corecta a regimului termic o are marirea cuvei (deci cantitatea de feroaliaj produs), datorita suprafetei specifice de pierdere de caldura. Daca Qe este prea mic, procesul de reducere s-a produs, feroaliajul nu se poate separa de zgura. In aceste conditii se ajuta procesul termic prin introducerea in amestec a unor oxidanti puternici.
Asa cum se vede in tabelul 3.5, acesti oxidanti pot fi oxizi superiori ai metalelor care intra in feroaliaj sau alte substante (peroxizi sau saruri puternic oxidante) care prin reducere cu aluminiu sa furnizeze necesarul de caldura.
In procesele de reducere cu aluminiu se degaja o cantitate mare de caldura.
Efectele termice a unor reactii secundare la elaborarea feroaliajelor
|
Reactia |
DH, in
|
Caldura cedata, in
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3BaO2 + 2Al = Ba3Al2O6 |
|
|
|
3CaO2 + 2Al = Ca3Al2O6 |
|
|
|
KClO3 + 2Al = Al2O3 + KCl |
|
|
|
3KClO4 + 8Al = 4Al2O3 + 3KCl |
|
|
|
NaClO3 + 2Al = Al2O3 + NaCl |
|
|
|
3NaClO4 + 8Al = 4Al2O3 + 3NaCl |
|
|
|
4NaNO3 + 10Al = 5Al2O3 + 2Na2O + 2N2 |
|
|
|
6KNO3 +10Al =5Al2O3 + 3K2O + 3N2 |
|
|
Folosirea de oxidanti suplimentari prezinta dezavantajul unui consum suplimentar de aluminiu, la care se adauga costul ridicat al oxidantului. Ei pot produce, prin reactii secundare exoterme, compusi care sa fluidifice zgura.
In unele cazuri, deficitul de caldura poate fi compensat prin preincalzirea amestecului de reactie (concentrat si pulbere de aluminiu). Preincalzirea trebuie facuta sub temperatura de aprindere, omogen in toata masa materialului, pentru a se evita supraincalziri locale, care pot conduce la declansarea procesului de reducere.
Reducerea cu aluminiu prezinta avantajul ca procesul - in marea majoritate a cazurilor - decurge fara aport exterior de caldura, iar atunci cand sunt necesare adaosuri exoterme, de cele mai multe ori poate fi oxidul de fier.
Aluminiul este un reducator foarte puternic, ceea ce inseamna ca poate reduce unii oxizi din steril, de aceea, la procesele aluminotermice sunt necesare concentrate curate, iar oxidul de fier, in caz ca este folosit, este indicat sub forma de arsura de fier curata.
Din proces rezulta Al2O3, oxid cu temperatura mare de topire, ceea ce conduce la zguri vascoase. Cum Al2O3 este oxid amfoter, apare si pericolul imobilizarii in zgura a unei parti din oxidul supus reducerii. De aceea, este necesar sa se foloseasca si un fluidificator, in proportii fixate cu discernamant, deoarece consuma caldura pentru incalzire si topire si mareste cantitatea de zgura.
Procese de afinare
Obtinerea feroaliajelor cu continut mic de carbon se realizeaza si prin oxidarea carbonului din feroaliajul carburat, proces care se aseamana cu afinarea fontei, oxidantul folosit fiind oxidul elementului de aliere, conform reactiei:
MenCm
+ ![]() MexOy
MexOy ![]() Me + m CO.
Me + m CO.
Procesul are loc, in general, la temperaturi ridicate, fiind aplicabil numai la feroaliajele la care elementele de aliere formeaza oxizi cu tensiune de disociere mai mare decat a CO, iar elementul respectiv, la temperatura procesului, are tensiunea de vapori mica.
Afinarea se poate produce si cu oxigenul din aer (in care caz in feroaliaj se dizolva azot) sau cu oxigen tehnic.
Datorita formarii de oxid de carbon in timpul afinarii, folosirea vidului (chiar de numai 50.70 torr) conduce la intensificarea procesului.
Pentru oxidarea carbonului se mai poate folosi si SiO2, care actioneaza astfel:
MenCm + m SiO2 n Me +m SiO + m CO.
Atat oxidul de carbon cat si SiO fiind gaze, folosirea vidului duce la accelerarea procesului.
Cu exceptia afinarii cu oxigen tehnic, procedeele de afinare a feroaliajelor carburate trebuie conduse in cuptoare electrice, deoarece sunt necesare temperaturi inalte.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |