
Ionul de hidrogen nu numai ca initiaza desfacerea structurilor reticulare, dar si concentratia sa influenteaza solubilizarea si precipitarea anumitor ioni pusi in libertate.
O concentratie ridicata a ionilor de hidrogen poate rezulta din oxidarea sulfurilor de fier (pirit, marcasit) in prezenta apei si frecvent in zone in care apele subterane sau de infiltratie ating valori foarte scazute ale pH-ului.
2FeS2 + 2H2O + 7O2 2FeSO4 + 2H2SO4
pirit apa sulfat feros acid sulfuric
Totusi, sulfurile nu sunt minerale frecvente in roci, iar influenta lor asupra proceselor de dezagregare-alterare este de mai mica importanta.
Ionii de hidrogen pot rezulta si din reactia dintre CO2 si apa, rezultatul fiind acidul carbonic H2CO CO2 joaca un rol deosebit de mare in reglarea pH-ului apelor naturale. Acest rol se datoreste ionului carbonat (CO3)2- care in prezenta CO2 liber, in solutii apoase, da nastere ionului (HCO3)-. Acesta, la randul lui, disociaza in apa si mareste concentratia ionului (OH)- determinand un caracter alcalin si modificand pH-ul spre valori de 8-9.
(CO3)2- + CO2 + H2O 2(HCO3)-
(HCO3)- + H2O H2CO3 + (OH)-
Acidul carbonic disociaza si astfel ionul H+ ce se formeaza modifica pH-ul spre slab acid.
H2CO3 (HCO3)- + H+
Acest echilibru se modifica ori de cate ori se schimba cantitatea de CO2 liber.
Prezenta bioxidului de carbon are totodata un rol important in prezenta carbonatilor, determinand formarea de bicarbonati solubili: Ca CO3 + CO2 + H2O Ca(HCO3)2
Mineralele argiloase, datorita valentele nesaturate ale ionilor de la suprafata, substitutiilor izomorfe din cadrul retelelor cristaline sau gruparilor hidroxil, au sarcini negative. Aceste minerale tind sa atinga starea de neutralitate prin adsorbtia de cationi, care, cu toate legaturile lor cu suprafata mineralelor, pot fi usor schimbati cu alti cationi din solutii.
Proprietatea mineralelor argiloase de a adsorbi cationi poarta numele de "capacitate de schimb cationic" (cation exchange capacity - CEC) si se exprima ca miliechivalenti (meq) adsorbiti de 100 g material argilos. In Tabelul 1. sunt prezentate intervalele valorice pentru capacitatea de schimb cationic a unor filosilicati (Wilson, 1987).
Tabel 1. Valorile capacitatii de schimb cationic (CEC) pentru unii filosilicati (Wilson, 1987; Yong & Warkentin, 1975 si Van Olphen, 1979 fide Hermanns Stengele & Plötze, 2000)
|
Mineralul |
CEC [meq/100 g] |
|
Caolinit | |
|
Halloysit | |
|
Illit | |
|
Clorite | |
|
Alofan |
|
|
Montmorillonit | |
|
Vermiculit |
Atunci cand ionul adsorbit este hidrogenul, mineralele argiloase se vor comporta ca niste acizi slabi sau "acizi coloidali", existand astfel o stransa legatura intre capacitatea de schimb cationic a acestora si pH-ul mediului. Astfel, caolinitul cu o capacitate de schimb cationic de 3-15 meq/100 g, atinge un pH de 4-5 la saturarea cu ioni de hidrogen, pe cand montmorillonitul, cu o capacitate de schimb cationic de 60-150 meq/100 g poate atinge un pH de
Materia organica coloidala are si ea capacitatea de a adsorbi ioni de hidrogen, comportandu-se ca 'acizi coloidali' in mod similar cu cei formati de mineralele argiloase.
Prezenta acestor "acizi coloidali" joaca un rol deosebit in transformarea structurii silicatilor. Experientele efectute pe cristale de anortit (Graham, 1941) au aratat cresterea valorii pH-ului in timp, prin indepartarea alcaliilor din structura initiala.
Conform reactiei de alterare a anortitului, calciul este indepartat continuu din sistem, reactia incepe sa se definitiveze, iar H+-montmorillonitul ramane ca reziduu. Daca H+-montmorillonitul se comporta ca un acid, mediului i se va imprima un pH scazut.
3Ca Al2Si2O8 + 6H2O 2H+2[Al2(AlSi3)10O(OH)2]- + 3Ca(OH)2
anortit montmorillonit
Daca caolinitul ar fi produsul rezidual, capacitatea de schimb cationic mai scazuta a acestui mineral ar determina o mai scazuta adsorbtie a ionilor de hidrogen si implicit un pH mai mare pentru mediu.
Din cele expuse rezulta ca pH-ul unui mediu nu este o variabila independenta in alterarea chimica, ci rezultatul mai multor factori:
a) compozitia si structura materialului initial;
b) prezenta apei, modul de deplasare a acesteia si relatia cu nivelul hidrostatic local;
c) rata levigarii (indepartarii) bazelor;
d) natura si in particular, capacitatea de schimb cationic a mineralelor secundare rezultate.
Un exemplu il constituie alterarea unor bazalte (Fig.).
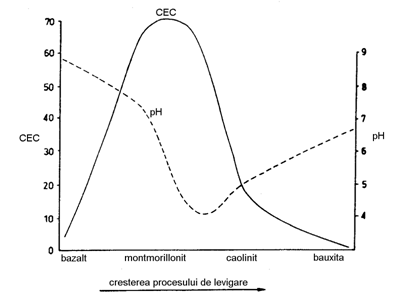
Fig. Modificare capacitatii de schimb de cationi (CEC) si pH in bazalte, odata cu intensificarea proceselor de dezagregare-alterare (Loughnan, 1969)
Montmorillonitul este produsul secundar obtinut intr-o prima etapa, insa pe masura ce "spalarea" (levigarea) creste in intensitate, acest mineral devine instabil prin pierderea unor constituenti solubili si va fi inlocuit de caolinit. Din diagrama se observa cum curba capacitatii de schimb cationic (CEC) atinge un maxim atunci cand montmorillonitul este mineralul dominant si apoi descreste spre zero odata cu predominarea caolinitului si a bauxitelor. Pe de alta parte, curba pH se comporta in mod contrar. Incepand de la valori alcaline, devine progresiv mai acida prin levigarea bazelor si atinge un minim la punctul de transformare a montmorillonitului in caolinit. De aici, capacitatea scazuta de adsorbtie a caolinitului si bauxitelor determina cresterea pH-ului spre valori neutre.
Nu numai compusii anorganici, de tipul mineralelor argiloase pot influenta pH-ul mediului. Materia organica din soluri este de asemenea capabila sa adsoarba ioni de hidrogen si sa imprime valori scazute pH-ului mediului. Studiile efectuate au aratat ca automat, acolo unde materia organica este prezenta, aciditatea mediului va fi independenta de mineralele secundare formate. Astfel, orizonturile bogate in materie organica din solurile podzolice au frecvent valori ale pH-ului sub 4, in ciuda faptului ca mineralul constitutiv dominant este caolinitul si nu montmorillonitul.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |