Pt majoritatea metalelor aflate in cond atm, starea metalica este dpdv termodinamic instabila. Tendinta metalelor de a trece in stare ionica esteoxidarea si un proces de coroziune. Acest proces difera mult de la un metal la altul si se poate caracteriza energetic prin variatia de ΔG - entalpia ce insoteste procesul.
In prezenta simltana a oxigenului si umiditatii la un pH 7, numa Au, P, Ir nu participa la actiunea coroziva si se pot gasi in stare pura in scoarta terestra. Exista si alte metale care au o entalpie libera ΔG>0 numai in absenta oxigenului acestea sunt metale seminobile Cu, Hg, Ag. Ele se pot gasi in natura, atat in stare nativa cat si combinata.
Restul metalelor au ΔG<0, reactia decurge spontan, de aceea in natura nu se pot gasi decat in forma combinata.
Al, Zn, trebuie sa fie dupa seria de activitati a tensiunilor electrochimice mai reactive decat Cr, Fe, practic in conditii atmosferice se constata ca Al si Cr sunt mai stabile decat Zn si Fe.
Termodinamica ne furnizeaza date despre desfasurarea proceselor de coroziune, ΔG reprezinta de fapt, variatia unei functii de stare(G) si despre obstacolele intalnite(viteza de reactie) tinand cont de unele cand solutia se imparte in solutii neelectrolitice, in soluri etc. Dupa modul ei de aparitie, coroziunea poate fi locala sau generala. Dupa modul de desfasurare a reactiilor, poroziunea poate fi chimica si electrochimica(chimica - e uscata; electrochimica - este umeda). Coroziunea apare in zonele anodice.
anod: Zno Zn2+ + 2e- (corodare) H2O H+ + OH-
 catod: 2H+ + 2e- H2↑
catod: 2H+ + 2e- H2↑
Zn2+ + 2OH- Zn(OH)2 (precipitat alb).
In coroziunea electrochimica, matalul reactioneaza cu electrolitul cu care este in contact, formand ioni sovatati(Zn2+ vin 3 (-+)), pot fi usor si greu solubili, atunci cand sunt usor solubili, trec in solutii, iar cand sunt greu solubili, formeaza precipitati.
Viteza de coroziune se poate exprima prin raportul pierderilor de masa pe unitate de suprafata si unitate de timp sau prin variatia densitatii curentului de coroziune A/cm2.
Viteza de coroziune poate varia in limite foarte largi daca exprimam in densitate de curent pt un metal nenobil intr'un acid tare, densitatea de curent de coroziune este de 1A/cm2.
La metalele nobile, aceasta este de 0,01 microA/cm2. Desi cunoscut de multa vreme in practica, fenomenul de coroziune nu a fost explicat decat tarziu din cauza ca intr'o masura foarte mare, procesul este specific metalelor dat considerat si depinde de pH,. Compozitia solutiei, accesul oxigenului, factori de care depinde si natura produsului, se pot obtine sare, oxid a metalelor. Concluzia este ca, distrugerea metalelor prin coroziune de faza lichida este un proces mixt de oxidare anodica a metalelor si simultan are loc un proces de reducere catodica, lucruri esentiale pt intelegerea procesului de coroziune.
Reactii ce au loc:
LA ANOD.
Ho Hn+ + ne-
Hn+ + H2O H(OH)2 + H+ + e-
LA CATOD.
H+ + e- 1/2H2
Proprietatile si comportarea produsa a metalului are o importanta esentiala in ceea ce inseamna cinetica reactiei de coroziune.
Daca produsul de oxidare este ionul solubil care odata format nu mai prezinta nici o forma protectoare, el ramane in solutie.
Daca produsul de oxidare este o sare greu solubila, el poate exercita o oarecare actiune protectoare. Uneori viteza de coroziune este lenta, gratie unui proces de depolarizare catodica.
Un exemplu se poate intampla la Fe, Al, Ca, Ni, care introduse intr'o solutie de H2NO4 formeaza un strat pasiv la suprafata, impiedicand coroziunea. Natura acestui fir pasiv a preocupat cercetatorii si a constituit obiect de studiu multi ani.
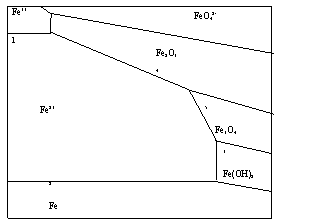
Stabilitatea metalului si a diverselor produse de oxidare ale acestuia sunt in general dependente de pH si de potentialul (E). Reprezentarea grafica a echilibrelor dintre metal, ion si oxid in diagrama potential (E)-pH in conditii izoterme constituie asa numitele diagrame Pourbaix. Aceste diagrame furnizeaza date termodinamice pretioase asupra fenomenului de coroziune.
 Completarea lor cu date cinetice ofera
calea intelegerii fenomenului si sugereaza caile ce trebuie alese pt prevenirea
fenomeului ce coroziune.
Completarea lor cu date cinetice ofera
calea intelegerii fenomenului si sugereaza caile ce trebuie alese pt prevenirea
fenomeului ce coroziune.
Diagramele Pourbaix pentru sistemul fier si apa
Liniile desenate reprezinta echilibrul dintre doua specii chimice diferite, iar suprafetele delimitate de linii indica domeniile de stabilitate termodinamica a speciilor.
Daca consideram de exemplu liniile orizontale notate cu 1 respectiv 2 carora le corespund urmatoarele echilibre:
Fe2+ → Fe3+ + e-
E = ( E0Fe2+ / EFe3+ ) + 0,059 lg [Fe3+][Fe2+]
Linia 2 corespunde echilibrului in care:
Fe0 ↔ Fe2+ + 2e-
E = ( EFe / EFe2+ ) + 0,859 lg [Fe0][Fe2+]
Ambele echilibre 1 si 2 implica transfer de sarcina desfasurandu-se fiecare echilibru la un potential bine definit. Deoarece ionii H+ nu participa la acest echilibru, acestea vor fi independente de pH ceea ce se explica prin orizontalitatea liniilor care le simbolizeaza.
Daca consideram in diagrama linia verticala 3, careia ii corespunde echilibrul: Fe2++2H20→Fe(OH)2+2H+. Acest echilibru nu implica nici un transfer de sarcina.
Se caracterizeaza deci printr-o valoare determita a potentialului in locul concentratiei sau activitatii ionice, intervine produsul de solubilitate al Fe(OH)2 (hidroxid feros).
Papa
= [H+
PFe(OH)2 = [Fe2+][
Acest echilibru nu este dependent de R ci este dependent de pH. Echilibrul este deci reprezentat in conditii standard normale pe verticala.
Liniile oblice 4 si 5 simbolizeaza echilibre in care sunt implicati simultan atat electroni cat si ionii de hidrogen.
Linia 4: 2Fe2+ + 3H20 → Fe23+ + 6H+ + 2e-
Linia 5: 3Fe2+ + 4H20 → Fe3O42- + 8H2+ + 2e-
Analiza diagramelor Pourbaix permite stabilirea limitelor de existena a starilor pasive, de imunitate si de coroziune a metalului luat in discutie. O forma simplificata tot pentru Fe este redata in figura; ceea ce inseamna ca sub linia 2, Fe este termodinamic inven.
 In mediul acid sau neutru traversarea dublului strat metal
electrolit de catre ionii de Fe, fiind impiedicat de concentratia mare de e-
si la suprafata metalului. Deasupra aceste linii
exista domeniul in care Fe se corodeaza.
In mediul acid sau neutru traversarea dublului strat metal
electrolit de catre ionii de Fe, fiind impiedicat de concentratia mare de e-
si la suprafata metalului. Deasupra aceste linii
exista domeniul in care Fe se corodeaza.
Daca in urma unei polarizari anodice sau in urma coroziunii naturale eletrolitul saraceste puternic in ioni de H+, pH poate sa creasca la valori ce situeaza metalul in zona de pasivare, Fe nu se dizolva deloc la pH cuprins intre 9-13 datorita filmului de hidroxid feros ce se formeaza pe suprafata lui.
Depasind anumite valori de pH si ale potentialului, starea pasiva poate sa dispara, oxidul dizolvandu-se oxidativ, aparand forma complexa FeO42- (ferot) aparand din nou fenomenul de coroziune.
- dupa aspectul fizic:
* coroziune continua
uniforma
neuniforma
* coroziune locala
pete de coroziune
pungi de coroziune
puncte de coroziune
- dupa mecanismul in care au loc procesele de coroziune
* coroziune chimica: mediu uscat
* coroziune electrochimica: mediu umed
Coroziunea chimica se supune legilor cineticii clasice.
Coroziunea electrochimica este o reactie eterogena pentru ca are loc la suprafata de separatia ca doua faze diferite.
Avand loc in mediu umed metalul este strabatut de un curent electric slab pe suprafate metalului formandu-se microanozi si microcatozi. La microanozi au loc distrugerile propriu-zise. La microcatod are loc degajarea hidrogenului.
Coroziunea electrochimica este influentata de o serie de factori care sunt caracterizati prin neomogenizati, care pot fi: neomogenizati la suprafata metalului; neomogenizati la structura si starea suprafetei metalului. Pentru un metal proeminentele joaca rol de anozi astfel incat viteza de coroziune este mai mare.
Neomogenitati ale peliculelor de protectie ale suprafetei metalelor, neomogenitatile mediului coroziv (presiune, temperatura, concentratie)
Campuri electice neuniforme.
Acoperirea metalului cu straturi protectoare
Aceasta se poate face cu un alt strat de metal (cuprare ), acoperire cu un strat de substanta anorganica care consta in formarea unor particule de oxizi; fosfati sau emailuri daca pelicula de oxid formate are volumul mai mare decat volumul metalului dezlocuit ea este continua, uniforma si asigura oarecare protectie.
Emailearea - acoperirea prin vitrificare
Acoperirea cu un strat de natura organica: lacuri si vopsele, rasini naturale si sintetice, materiale plastice, toate acestea se pot aplica atat constructilor metalice expuse la coroziune atmosferica cat si a celor aflate sub influenta unor agenti.
Prelucrarea mediului coroziv
Coroziunea poate fi micsorata si prin diminuarea caracterului agresiv al mediului care realizeaza prin deoxigenare, desulfurare, dezaerare sau prin adaugare de inhibitori de coroziune. Inhibitorii de coroziune sunt substante minerale sau organice care micsoreaza sau opresc coroziunea. Dupa modul de actiune avem: inhibitori anodici si catodici.
Drept inhibitori anodici se pot folosi substante oxidante: azotati, cromati, care micsoreaza dizolvarea anodica prin polarizarea anodului spre un potential mai pozitiv.
Inhibatorii catodici sunt substante care protejeaza spatiile catodice prin depunerea de precipitate greu solubile de hidroxizi sau carbonati sau prin formarea unor pelicule protectoare de Hg, atunci cand folosim inhibitori sarurile de Hg.
Inhibitorii mai pot fi clasificati dupa natura in inhibitori anorganici si organici
- dintre cei anorganici: hexamate fosfatul de Na care da rezultate deosebit de bune pt protejarea otelurilor si fontelor
- de natura organica: sunt substantele coloidale, sapunurile insolubile de metale grele, reziduurile petroliere sulfurate.
Metodele electrochimice de protectie
- protectie anodica
- protectie catodica
folosirea anozilor de sacrificiu
folosirea curentului exterior
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |