Termochimia este cea care are ca subiect de dezbatere caldura implicata in reactiile chimice O reactie chimica tipica poate avea forma similara reactiei chimice ipotetice prezentate mai jos:
a A + b B → c C + d D. (1)
(In ecuatia (1) literele mare reprezinta elementele sau compusii iar literele mici indica numeral intregi necesare pentru egalarea reactiei. Asa cum a mai fost de fapt definite anterior aceste notiuni.)
O reactie chimica reprezinta un proces termodinamic la fel ca orice alt proces de acest tip. Exista o stare initiala (reactanti) precum o stare finala (produsi). Putem calcula modificarile energiei interne entalpiei si asa mai departe pentru o anumita reactie. De exemplu,
ΔU = U produsi − U reactanti
si
ΔH = H produsi − H reactanti.
Un lucru devine foarte clar: 'reactantii' si 'produsii' din aceste ecuatii inseamna de fapt ca atat reactantii cat si produsii sunt entitati, izolate, separate si pure. In plus atat reactantii cat si produsii se gasesc la aceiasi temperatura si presiune. Astfel, de exemplu, ΔH anterior este entalpia a c moli de C (izolati si puri in containerul lor la temperatura, T si presiunea, p) plus entalpia a d moli de D (izolati si puri in containerul lor la temperatura, T si presiunea, p) minus entalpia a a moli de A (izolati si puri in containerul lor la temperatura, T si presiunea, p) minus entalpia a b moli de B (izolati si puri in containerul lor la temperatura, T si presiunea, p).
Din timp in timp vom adauga indicele o la H si U pentru a indica ca reactantii si produsii sunt in "starile lor standard". Adica ele sunt in cele mai stabile stari ale lor la temperatura T si presiunea p. De exemplu, starea standard a apei la 25oC si presiunea de 1 atm este apa lichida.
Daca reactia noastra decurge la temperature la V constant, precum intr-o bomba calorimetrica, dV =0 si ΔUV = qV.
Daca reactia decurge la presiune constanta, precum reactiile care au loc la presiune atmosferica, dp = 0 and ΔHp = qp.
Daca ΔHp < 0 spunem ca reactia este exotermica. Adica, sistemul cedeaza caldura vecinatatilor. Pe de alta parte, daca ΔHp > 0 spunem ca sistemul absoarbe caldura de la vecinatati.
Din definitia entalpiei gasim ca
ΔH = ΔU + Δ (pV), (2)
unde
Δ (pV) = (pV) produsi − (pV) reactanti.
Pentru lichide si solide Δ(pV) este foarte mic. Δ(pV) nu este neaparat mica pentru gaze, dar putem avea o valoare estimata rezonabila prin aproximarea acestei cantitati prin aproximarea gazului drept gaz ideal. Astfel:
Δ (pV)gaz ≈ (pV)gaz produsi − (pV)gaz reactanti ≈ n gaz produsi RT − n gaz reactanti RT = RTΔ n gaz,
unde Δn gas este diferenta dintre numarul de moli ale reactantilor si produsilor. Utilizand aceasta aproximatie se obtine:
ΔH = ΔU + RTΔ n gas. (3)
Totusi, trebuie sa fim atenti la modul in care intelegem aceasta ecuatie datorita faptului ca conditiile care trebuie sa le indeplineasca ecuatia trebuie sa fie identice in fiecare parte a ei. Deoarece ΔH este caldura pe care o masuram in desfasurarea reactiei la presiune constanta(ΔHp = qp) si ΔU este caldura masurata la volum constant (ΔUV = qV), este tentant (mai ales obisnuit)de a scrie ecuatia 3 ca
qp = qV + RTΔ n gas.
(4)
Totusi, ecuatia 4 nu poate riguros exacta deoarece q este raportat pentru doua conditii diferite, una la presiune constanta p si cealalta valoare pentru volum constant V. Putem avea un indiciu daca ecuatia 4 este o aproximatie destul de exacta daca ne vom referi la exemplul urmator.
Sa luam in calcul reactia:
2 C(s) + O2(g) → 2 CO(g),
(5)
care decurge la volum constant dV = 0.
Δ (pV) ≈ Δ (pV)gas ≈ RTΔ n gas = RT.
Caldura masurata va fi cea la volum constant qV. Acum sa gasim o modalitate de masura qp. Sa consideram reactia a se desfasura in urmatoarele doua etape
2 C(s) + O2(g)
2
CO(g)
→ 2 CO(g)
(6)
p1, V1, T,
qV p2,
V1, T,
ΔH2
p1, V2, T.
Prima etapa are loc la volum constant cu ΔUV = qV. De notat
cresterea presiunii. Cea de a doua etapa la volum constant va duce la
valoarea initiala a presiunii. Vom nota caldura celei de a doua
etape prin ΔH2. In consecinta este riguros
exact in a spune ca
ΔHp = ΔHV + ΔH2 = qV + RT + ΔH2. (7)
Totusi, termenul ΔH2 reprezinta entalpia expansiunii gazului la temperatura constanta. Ori, daca gazul este unul ideal, atunci valoarea acesteia va fi zero. Pentru gazele reale valoarea acestui termen este extrem de mica deci neglijarea lui nu va conduce la erori semnificative. Consecinta, putem utiliza fara a gresi prea mult ecuatia:
qp = qV + RTΔ n gas. (4)
Legea lui Hess stipuleaza ca daca se aduna sau se scad ecuatii ale reactiilor, atunci putem aduna respectiv scadea si ΔH sau ΔU lor pentru a obtine ΔH sau ΔU ecuatie globale a reactiilor. De exemplu: daca adaugam reactia
a A + b B → c C + d D. ΔH1, ΔU1
la reactia
e E + f F → g G + h H ΔH2, ΔU2
pentru a obtine ecuatia
a A + b B + e E + f F → c C + d D + g G + h H,
atunci, pentru ecuatia globala avem
ΔH = ΔH1 + ΔH2 si ΔU = ΔU1 + ΔU2.
Marea utilitate a legii lui Hess este ca nu trebuie sa intabelam
valorile ΔH ale fiecarei reactii in parte. Putem
obtine valoarea ΔH a unei anumite ecuatii a unei reactii particulare prin
adunarea sau scaderea ΔH unor reactii simple, definite drept reactii de formare. Vom
definii ΔfH o a unui compus drept
entalpia reactiei :
elemente pure izolate, in starile lor standard → un mol de compus in stare lui standard
De exemplu, formarea apei lichide este definita de ΔH o a reactiei:
H2(g) + 1/2 O2(g) H2O(l).
Prin definitie caldura de formare a unui element in stare standard este zero!
Pentru obtinerea ΔH o a ecuatiei ipotetice (1), va trebui sa adunam si sa scadem caldurile respective de formare
ΔrH o = cΔfHCo + d ΔfHDo− a ΔfHAo− b ΔfHBo. (8)
De exemplu ΔH o pentru reactia
CH4(g) + 2 O2(g) CO2(g) + 2 H2O(l), (9)
este data de
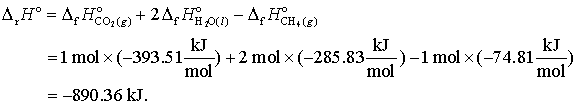
Tabele cu calduri de formare dau date privind valorile la temperatura standard de 25oC dar adesea este necesar sa cunoastem caldurile de formare pentru alte temperaturi. Daca cunoastem temperaturile de formare la presiune constanta vom putea calcula usor temperaturile de formare pentru alte temperaturi decat cea de 25oC. Vom utiliza urmatorul lant al rationamentului. Stim ca
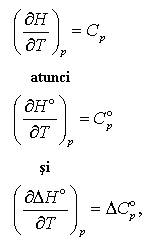 (10 a,b,c)
(10 a,b,c)
unde ΔCpo este definita pentru reactia noastra ipotetica de la inceput (1), ca
![]() (11)
(11)
Daca pregatim ecuatia (10 c) pentru integrare sub forma
![]() (12)
(12)
si efectuam integrala rezulta
![]() (13)
(13)
Pentru rezultate mai exacte va trebui sa utilizam dependenta de temperatura a caldurii de formare conform ecuatiilor (11) si (13), dar cel mai adesea putem aproxima caldura de formare drept constanta pentru un anumit domeniu de temperaturi, astfel incat ecuatia (13) devine
![]() (14)
(14)
Ca un exemplu si exercitiu totodata sa calculam caldura de formare a ecuatiei (9) la 95oC. ΔCpo pentru aceasta reactie este data de relatia
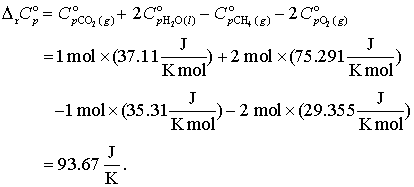 (15)
(15)
Atunci ecuatia (14) va da:
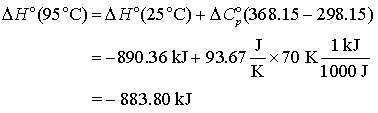 (16)
(16)
Sa remarcam faptul ca exista si o alta modalitate de a rezolva aceasta problema. Sa calculam ΔH o necesara racirii reactantilor la 25oC, ΔH o reactiei la 25oC, calcularea ΔH o pentru incalzirea produsilor la 95oC iar ulterior sa le insumam. Deoarece H este o functie de stare ΔH nu depinde de calea urmata de proces. Metoda este deosebit de utila mai ales atunci cand unul din componente sufera modificari de stare, undeva in domeniu de temperatura dat.
De exemplu, sa consideram pentru reactia anterioara o noua temperatura, peste 100oC. In acest caz va trebui sa luam in considerare si temperatura de vaporizare a apei lichide. Aceasta nu este deloc o chestiune dificila, dar necesita cateva etape in plus, incluzand utilizarea caldurii de vaporizare a apei. Deci daca temperatura reactiei depaseste 100oC va trebui sa efectuam calculele urmand etapele:
etapa 1 - racirea reactantilor de la
temperatura de reactie la 25oC,
etapa 2 - reactia la 25oC,
etapa 3 - caldura produsului CO2 de la 25oC la
temperatura de reactie,
etapa 4 - caldura apei lichide de la 25oC la 100oC,
etapa 5 - vaporizarea apei la 100oC,
etapa 6 - caldura apei sub forma de vapori de la 100oC la
temperatura de reactie.
Caldura reactiei la o temperatura superioara va fi suma ΔH celor sase etape, avand in minte avantajul ca aceasta nu depinde de calea urmata!
Ruperea unei legaturi chimice este un proces endoterm. In consecinta sistemului trebuie sa i se furnizeze energie pentru ca legatura sa poate fi rupta.
Formarea unei legaturi chimice este un proces exoterm. Energia eliberata in formarea legaturilor este eliberata vecinatatilor.
Putem estima ΔH pentru o reactie chimica prin adunarea energiilor de scindare a legaturilor, a tuturor legaturilor rupte si scaderea energiilor de formate a legaturilor nou formate, respectiv a tuturor acestora.
ΔH ≈ SE leg. rupte − SE leg. formate
Sa exemplificam pentru reactia in faza gazoasa: N2 + 3 H2 → 2 NH3. Din datele pe care le gasim deja inregistrate in tabele, valorile energiilor de legatura sunt:
N−N
945 kJ
H−H 436 kJ
N−H 388 kJ.
In reactie se rup o legatura N H si trei legaturi H H si se formeaza sase legaturi N H; valoarea aproximativa a lui ΔH va fi:
ΔH ≈ 1 × 945 + 3 × 436 − 6 × 388 = − 75 kJ.
Aceasta poate fi comparata cu valoare de − 92 kJ, determinata experimental. Dupa cum se observa metoda nu este una foarte precisa, dar ofera informatii acolo unde nu se pot accesa alte mijloace. Oricum caldura de reactie este indisolubil legata de energia ruperilor, respecv energia formarii legaturilor.
Daca ne vom uita in tabele care cuprind calduri de formare vom observa valori care corespund ionilor in solutii apoase, adica valori precum celei corespunzatoare specie Na+(aq). Fireste ne vom intreba de unde provin aceste valori si ce reprezinta ele. Din chimia echilibrelor stim ca este imposibil sa se prepare doar ioni Na+(aq), acest proces fiind insotit de procesul formarii ionilor Cl− (aq), pastrandu-se astfel neutralitatea solutiei, o solutie incarcata numai pozitiv sau numai negativ nefiind un lucru permis.
Caldurile de formare a solutiilor compusilor ionici solubili pot fi si ele masurate: Adica, putem masura caldura de formare a HCl(aq). Caldura de formare a formare HCl(aq) este definita ca ΔH o a reactiei
1/2 H2(g) + 1/2 Cl2(g) HCl(aq). (17)
Deoarece compusii ionici sunt complet disociati in solutie atunci este adevarat ca:
![]() (18)
(18)
Nu putem afla acum caldurile de formare a celor doi ioni in solutie, dar cunoastem suma lor. Prin conventie, s-a ales arbitrar valoarea zero pentru caldura de formare a ionului H+(aq). Adica:
![]() (19)
(19)
In consecinta caldurile de formare a celorlalti ioni in solutie apoasa pot fi determinate relative la caldura de formare a ionului H+(aq). Din start observam ca
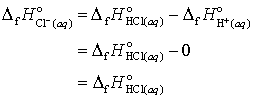 (20 a, b, c)
(20 a, b, c)
Aceasta conventie ne va permite calcularea tuturor celorlalti ioni in solutii apoase. De exemplu din masurarea caldurii de formare a NaCl(aq) si stiind ca:
![]() (21)
(21)
gasim ca
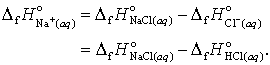 (22 a, b)
(22 a, b)
continuand astfel determinam caldurile de formare a altor ioni in solutie apoasa
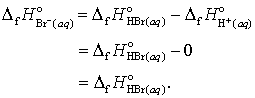 (23 a, b, c)
(23 a, b, c)
Avem acum suficiente date pentru a calcula caldura de formare a NaBr in solutie apoasa, fara a mai fi necesara determinarea directa, ci doar folosind tabelele
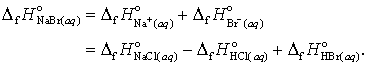 (24 a, b)
(24 a, b)
Deoarece s-a atribuit arbitrar valoarea zero pentru caldura de formare a ionului H+(aq), ecuatia (24 b) nu mai prezinta nici o importanta. In acest mod se poate construi un intreg tabel al caldurii de formare a ionilor in solutii apoase, valori relative la caldura de formare a ionului H+(aq).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |