
METODE DE PREVENIRE SI/SAU REDUCERE A COROZIUNII
1. Generalitati
Baza metodelor de prevenire si/sau reducere a coroziunii o constituie restrictionarea sau controlul portiunilor anodice si/sau catodice ale reactiilor de coroziune, schimbarea variabilelor mediului sau intreruperea contactului electric intre anozii si catozii locali. Metodele de prevenire si/ sau reducere a coroziunii includ: selectarea judicioasa a materialelor, folosirea de acoperiri, de inhibitori de coroziune si protectia anodica si catodica.
Metoda cea mai comuna de reducere a coroziunii este selectarea unor materiale adecvate pentru anumite conditii de mediu si aplicatii date. Rezultatele obtinute in operare si bazele de date cuprinzand rezultatele testelor provenite atat de la furnizor cat si de la fabricant, bazate pe datele obtinute in laboratoare sau instalatii, reprezinta o asistenta serioasa in procesul de selectare a materialelor [136].
Pentru a fi utilizate in aplicatia respectiva, materialele selectate trebuie sa fie rezistente atat la diferite forme de coroziune cat si eficiente ca cost. Pentru reducerea sau pentru obtinerea unor medii neoxidante, exista anumite aliaje care se prezinta satisfacator cum ar fi nichelul, cuprul si aliajele lor. In cazul conditiilor oxidante, sunt recomandabile aliajele de crom, in timp ce in mediile foarte oxidante, titanul si aliajele sale au o rezistenta superioara. Multe din costurile asociate coroziunii pot fi eliminate printr-o proiectare adecvata. In acest scop, proiectantul, fie trebuie sa fie specialist si in coroziune, fie trebuie sa coopereze indeaproape cu un inginer specialist in materiale si coroziune.
Acoperirile protectoare, care sunt folosite pentru a asigura o bariera eficienta in calea coroziunii, pot include: acoperiri metalice, nemetalice anorganice si organice si de conversie chimica. Inainte de aplicarea unei acoperiri eficiente pe metale sau aliaje, este necesara curatarea atenta a suprafetei pentru a indeparta murdaria, grasimile, sarurile si oxizii aflati sub forma de filme sau rugina. Acoperirile metalice pot fi aplicate prin electrodepunere, imersare in bai fierbinti, difuzie, metalizare sau sprayere in flacara, implantare de ioni si alte metode.
Una dintre modalitatile de protejare a metalelor active din punct de vedere al comportarii la coroziune este prin acoperirea lor cu filme pasive, avand un caracter protector fata de metalul neacoperit. Asa-numita pasivitate chimica se instaleaza atunci cand suprafata unui metal ramane neafectata intr-o solutie cu care ea are tendinta termodinamica de a reactiona.
Aliajele feroase se acopera instantaneu in aer cu un film subtire de oxid. Orice portiune a suprafetei ramasa neacoperita devine anod, fierul din metalul de baza trecand in solutie, concomitent cu reducerea catodica a O2. In cazul unei concentratii suficiente de O2, se produce pasivarea suprafetei initial neacoperite. In schimb, in absenta O2 sau a altui reducator catodic, pasivarea nu se poduce, solutia devenind coroziva fata de metalul de baza. Compozitia si structura filmului de oxid determina modul in care ionii se deplaseaza prin el; in schimb, transportul acestora in agentul apos de la interfata metal/ solutie determina viteza de dizolvarea a metalului.
In figura 1[136] este prezentata o curba potentiodinamica (potential/densitate de curent) caracteristica pasivarii chimice. Intr-o celula electrochimica clasica, catodul mai activ C1 furnizeaza destul curent la un potential suficient de inalt pentru a polariza anodul dincolo de valoarea potentialului Ep, pasivitatea instalandu-se la valoarea potentialului P1.
In cazul utilizarii unui catod mai putin activ C2, acesta nu poate pasiva anodul, dar conduce la o coroziune pana in punctul corespunzator potentialului activ A2. Daca suprafata este acoperita initial cu un film de oxid, astfel incat aria anodica este mult mai mica decat aria catodica, se poate produce o reactie catodica slaba sau niciuna, asa incat sa se produca un curent total destul de inalt, care sa mentina starea de pasivare a anodului, caruia ii va corespunde curentul de pasivare ip.
Examinand curbele din figura 1[136], observam ca o suprafata pasivata odata produsa, poate fi mentinuta pasiva asigurand conditii mai putin drastice decat cele mentinute pentru producerea pasivarii. Cele afirmate mai inainte se traduc prin aceea ca orice mediu electrochimic sau chimic mentine potentialul la suprafata metalului in domeniul pasiv, furnizand curenti foarte mici. Potentialul pasiv poate fi mentinut prin aplicarea unei energii constante din exterior intre metalul de pasivat si catodul auxiliar, ca si in cazul protectiei anodice. Acest lucru se poate realiza prin existenta in solutie, in apropierea suprafetei pasive a unui agent oxidant care, prin intermediul reactiei catodice: Ox + e Red, sa fie capabil sa furnizeze curenti foarte mici de pasivare.
Astfel, de exemplu, in cazul fierului pasivat chimic in solutii continand HNO3, acesta poate fi mentinut in stare pasiva si in alte solutii, utilizand mici concentratii de agenti slab oxidanti ca: O2, H2O2, Fe3+, Cu2+, cu conditia ca in solutia din imediata vecinatate a anodului sa nu existe depasivatori puternici, cum sunt, de exemplu, ionii de halogeni.
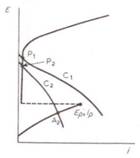
Fig.1[1] Curbele schematice potential-densitate de curent
Intreruperea partiala sau completa a pasivitatii este amorsata de acei factori care produc indepartarea partiala sau completa a filmului pasiv. Astfel, in solutii apoase la temperatura camerei, o asemenea indepartare poate fi efectuata prin reducere electrochimica, dizolvare chimica, atacarea metalului de baza in locurile in care exista imperfectiuni in film sau ruperea mecanica a filmului superficial.
Oxizii ferici care se dizolva destul de lent in solutii acide sunt relativ usor de redus la Fe2+ in multe tipuri de solutii acide prin asa-numita dizolvare reducatoare. Tratamentul catodic al filmelor pasive poate activa substraturile metalice. Daca filmul pasiv contine suficiente zone mai slab pasive sau daca agentul oxidant este insuficient, nu este necesara o f.e.m. exterioara pentru activarea procesului de reducere, filmul insusi devenind un reactant catodic.
In consecinta, va apare o scadere brusca a potentialului, care va incepe de la un potential mai putin nobil decat valoarea necesara pasivarii. Acest potential, asa-numit "potential de activare" este cunoscut sub denumirea de potential Flade. Zonele slab pasive ale filmului pot fi constituite de: prezenta unor fisuri mecanice si a unor incluziuni sau alte faze ale aliajului, acoperite cu filme care sunt mai permeabile la cationi decat restul filmului.
Cu cat metalele (aliajele) sunt acoperite cu filme superficiale mai uniforme, cu atat depasivarea suprafetelor este mai putin probabila.
Zonele slab pasive pot fi induse sau marite - intr-o masura mai mare sau mai mica - de mediu, ionii de Cl- fiind unii dintre cei mai puternici agenti de activare. Astfel, in solutia care contine atat ioni de Cl- cat si de O2-, este posibil sa aiba loc un schimb anionic, care va avea ca efect cresterea deficientei in cationi in cazul unui film care creste lent. Acest film va permite ulterior o difuzie mai usoara a cationilor prin vacante, promovand , astfel, o comportare anodica activa in zonele slab pasive. Ruperea electrochimica a filmelor datorita unei oxidari anodice puternice in domeniul de transpasivitate poate fi considerata o dizolvare oxidativa, prin analogie cu dizolvarea reducatoare.
Dizolvarea chimica obisnuita a filmelor de oxid este un proces favorizat din punct de vedere termodinamic, care are loc uneori in aceleasi solutii in care s-a facut pasivarea. Filmele cele mai pasive (protectoare) sunt formate din oxizi ai elementelor in valenta superioara datorita faptului ca ei sufera un proces de dizolvare foarte lent. Viteza de dizolvare a unor oxizi ca: Fe2O3, Cr2O3 si Al2O3 este, deobicei, mult accelerata prin cresterea temperaturii si in consecinta, pasivarea produsa in solutii reci de acid poate dispare la incalzirea acelorasi solutii.
Un alt factor important este viteza de dizolvare a unui oxid care prezinta defecte de structura. Astfel, oxidul feric contine deobicei o concentratie apreciabila de Fe2+ in reteaua lui, iar acesti ioni de Fe2+ sunt cei care constituie zonele in care se produce dizolvarea initiala, care este lenta, dar nu neglijabila, la temperatura camerei. Cand Fe2O3 se va forma la potentiale anodice situate mult peste valoarea potentialului reversibil din punct de vedere termodinamic, va avea loc pasivarea metalului conform reactiei:
2Fe + 3H2O Fe2O3 + 6H+ + 3e- (1)
Acest oxid, rezultat in urma reactiei (1), se va dizolva mai usor in solutii acide decat oxidul obisnuit, deficitar in oxigen.
Cand o solutie ataca lent filmul pasiv de pe o suprafata, dar are capacitatea de a ataca rapid substratul metalic, se va produce o erodare a filmului, insotita de ruperea acestuia in oricare din imperfectiunile filmului. In general, filmele pasive de oxid pot fi supuse unor degradari prin urmatoarele tipuri de forte mecanice: indoire, zgariere, impact, etc. Deoarece filmele sunt, in general, relativ fragile, exista o mica sansa ca ele sa ramana aderente, compacte si neporoase ca urmare a compresiei sau tragerii ductile. Deci, cand un film pasiv este folosit pentru protectia metalului, el trebuie sa aiba capacitatea de a se reface chimic sau electrochimic dupa producerea unei degradari mecanice.
Molibdatul de sodiu are un efect inhibitor asupra coroziunii aliajelor feroase, el fiind cercetat in special, datorita naturii sale netoxice si deci, ecologice. Indiferent de pH-ul mediului, el nu poate contribui la pasivarea otelurilor din cauza caracterului sau oxidant ineficient. In consecinta, pentru a realiza o pasivare eficienta este necesara prezenta unui alt cooxidant, avand o inalta putere de oxidare.
Multi compusi ai zincului, ca ZnO, ZnCl2 sau ZnSO4 au o eficienta inalta a oxidarii, in timp ce altii poseda un remarcabil efect sinergetic in prezenta altor cationi. Astfel, in timp ce unii cercetatori au semnalat efectul sinergetic al ZnCl2 in prezenta molibdatului, altii au aratat ca exista un efect sinergetic al sarurilor de Zn si molibdatului in prezenta Cl- si HEDP [96, 138]. Mecanismul de actiune al sarurilor de zinc a fost atribuit formarii unor produsi catodici greu solubili, cum ar fi hidroxidul sau oxidul de zinc, care vor acoperi suprafata metalului, prevenind astfel coroziunea [138]. Avand in vedere ca oxidul sau hidroxidul de zinc se formeaza in urma unei reactii slab catodice, cantitatea de produsi de reactie este foarte mica. De aici apare necesitatea folosirii unor cantitati mai mari din solutiile initiale, existand, totodata, posibilitatea unui efect advers, agresiv, datorat ionilor de Cl- si SO42- rezultati din sarurile de zinc.
Ca substanta cooxidanta este folosit deobicei NaNO2. Avand in vedere combinatia de ioni din solutie, este necesar sa precizam ca zincul este un inhibitor catodic, in timp ce molibdatul si nitratul sunt inhibitori anodici. S-a gasit ca molibdatul si nitratul, combinati in raportul 6:4 reprezinta compozitia optima care poate inhiba coroziunea otelului carbon in medii apoase neutre [138]. Mecanismul probabil al inhibarii in prezenta acestei concentratii de ioni se bazeaza pe formarea unui oxid protector(Fe2O3) pe suprafata metalului, conform urmatoarei reactii:
4Fe + 3NO2- + 3H+ 2Fe2O3 + NH3 + N2 (2)
Datorita caracterului sau oxidant, nitritul mentine oxidul superficial si contribuie la repararea oricarei imperfectiuni a acestuia, iar in acele locuri in care coroziunea a avut loc, creaza un nou film de oxid feric. Acest film superficial de oxid este ulterior protejat datorita molibdatului adsorbit sub forma de MoO42-, in cazul in care molibdatul este prezent in solutie impreuna cu nitritul. Prin furnizarea de sarcini negative filmului superficial exterior, se va ajunge ca speciile negative din solutie sa fie respinse, iar cele pozitive atrase . Cand in solutie exista, de asemenea, ioni de Zn2+, combinarea lor cu MoO42- este puternic favorizata, ceea ce va conduce la o accelerare a pasivarii ulterioare. Deci, ionii de Zn2+ se vor combina cu ionii de molibdat, formandu-se Zn2(OH)2MoO4 si respectiv Zn3(OH)2(MoO4)3 [141].
Efectul nitritului este confirmat de variatia pH-ului solutiei, intrucat pe masura formarii unui oxid din ce in ce mai protector, tot mai mult NH3 va fi eliberat in solutie, ceea ce va conduce la cresterea pH-ului solutiei. In cazul folosirii doar a molibdatului ca inhibitor, pH-ul solutiei va scade, favorizand formarea acidului molibdic si a izopolimolibdatilor, care vor promova scaderea in continuare a pH-ului solutiei. Monitorand potentialul in circuit deschis(OCP) timp de circa doua luni, s-a observat ca acesta a ramas in zona anodica, de aici rezultand faptul ca nitritul a fost substanta care a condus la deplasarea potentialului in directie pozitiva. Cu alte cuvinte, variatiile pH-ului si OCP-ului dovedesc, in mod clar, rolul semnificativ al nitritului, chiar daca prezenta lui in stratul pasiv nu a fost confirmata prin alte metode fizice[6,7]. In acest context, se poate presupune ca initial a luat nastere filmul de Fe2O3, a carui formare a fost puternic influentata de prezenta nitritului. Peste filmul de Fe2O3 se va suprapune un alt strat de molibdat de Zn. Prezenta acestui molibdat de Zn greu solubil a fost confirmata prin spectrele IR. Acest film duplex va conduce la o scadere a vitezei de reducere a oxigenului, creand, deci, o bariera in calea difuziei acestuia.
Zincul este un inhibitor catodic, iar molibdatul si nitritul sunt inhibitori anodici. In schimb, in prezenta intregului sistem de inhibitori, s-a gasit ca natura inhibarii este preponderent catodica. In cazul unei actiuni sinergetice Zn/anioni, anionii pot forma saruri insolubile bazice de Zn. In aceasta situatie, trebuie tinut cont de faptul ca compusii insolubili sau mai putin solubili sunt cei mai protectori, iar natura lor determina capacitatea lor de protectie.
In cazul fierului si aliajelor feroase, cinetica pasivarii nu a fost complet elucidata, ea fiind complicata - in special in solutii acide - datorita faptului ca se formeaza filme complexe formate din saruri si/sau oxizi. Acest film, asa-numit film prepasiv, poate fi un precursor al filmului pasiv[96, 138].
Pe baza rezultatelor experimentale obtinute, Godec[145] a putut calcula valoarea grosimii stratului Nernst - d - care reprezinta grosimea stratului de electrolit adiacent metalului in care difuzia nu este afectata de convectie. Aceste valori ale lui "d " au diferit cu un ordin de marime cand
s-a lucrat in doua solutii de pasivare cu pH-uri diferite: 2,46 si respectiv 3,31. Pornind de la aceste valori ale lui "d", Godec a concluzionat ca procesele de coroziune care au avut loc in solutiile respective au diferit prin urmatoarele caracteristici:
in cazul solutiei avand pH-ul egal cu 2,46, procesul de coroziune a inceput prin dizolvarea metalului de baza, a continuat pana la atingerea unei concentratii de saturatie a ionilor metalici in solutie, terminandu-se prin formarea unui strat prepasiv;
in cazul solutiei avand pH-ul 3,31, dizolvarea metalului de baza a fost urmata imediat de o precipitare sau de o oxidare, care s-a produs direct pe suprafata electrodului.
Parametrii luati in considerare in adoptarea unuia sau altuia dintre procese au fost valoarea potentialului de pasivare si continutul in Cr al aliajului. Inhibitorii, cand sunt adaugati intr-o concentratie mai mare decat concentratia-prag, vor produce scaderea vitezei de coroziune a unui material intr-un anumit mediu. Daca nivelul de inhibitor este sub concentratia-prag, coroziunea ar putea avea loc mai rapid decat daca inhibitorul ar fi complet absent. Inhibitorii pot fi organici sau anorganici, incadrandu-se in urmatoarele clase: inhibitori de pasivare sau oxidanti, de precipitare, catodici sau anodici, adsorbanti organici, in faza vapori si diverse alte clase de compusi. Urmatorii factori pot afecta eficienta si implicit selectarea unui anumit inhibitor: temperatura, viteza fluidului, pH-ul, salinitatea, costul, solubilitatea, speciile cu care interfera si metalul sau aliajul in prezenta caruia este folosit. In plus fata de cele aratate mai sus, exista anumite reglementari pe plan mondial care conditioneaza selectarea inhibitorilor functie de anumite criterii de toxicitate si respectiv depozitare.
2. Elaborarea unor solutii de repasivare a otelurilor carbon
In vederea elaborarii unor retete de repasivare a otelurilor carbon, era necesar ca probele respective sa fie filmate in prealabil prin autoclavizare si ulterior supuse operatiilor de decrustare. Decrustarea in regim dinamic a fost executata in conditiile specificate in procedura proprie[146], iar probele astfel decrustate au fost supuse unor pasivari chimice in zece tipuri de solutii a caror compozitie chimica este prezentata in tabelul 1[147].
In paralel cu aceste evaluari cinetice, s-a procedat la determinarea spectrofotometrica a fierului trecut in solutie dupa diferite perioade de autoclavizare. Metoda spectrofotometrica este bazata pe reactia de reducere a ionilor de Fe3+ la Fe2+ folosind clorhidratul de hidroxilamina, urmata de complexarea ionilor Fe2+ cu o-fenantrolina. Determinarile experimentale au fost executate pe un spectrofotometru de absorbtie UV-VIS SPECTRONIC GENESYS-2.
Tabelul 1[147]. Compozitia solutiilor de pasivare
|
Cod sol. pasivare |
pH-ul solutiei |
Compozitie solutie |
Cod curba |
|
P1(24h) |
0,2ml/l N2H4+ 1,02ml/l NH3+ + 0,1g/l Na2MoO4 |
PAS 3-5 |
|
|
P1- martor |
0,2ml/l N2H4+ 1,02ml/l NH3+ +0,1g/l Na2MoO4 |
PAS 4-16 |
|
|
P2(24h) |
0,2ml/l N2H4+ 1,02ml/l NH3+ +0,5g/l Na2MoO4 |
PAS 9-21 |
|
|
P3(24h) |
1ml/l N2H4+ 11ml/l NH3 + + 0,1g/l Na2MoO4 |
PAS 5-17 |
|
|
P4(24h) |
1ml/l N2H4+ 11ml/l NH3 + + 0,5g/l Na2MoO4 |
PAS 1-13 |
|
|
P5(24h) |
1ml/l N2H4+ 11ml/l NH3+ +0,5g/l(NH4)2MoO4 |
PAS 6-18 |
|
|
P6(24h) |
1ml/lN2H4+14ml/lNH3+0,1g/lKNO3+5,5g/lH3B4+ +0,5g/l(NH4)2MoO4+0,33g/l NaNO2 |
PAS 101-22 |
|
|
P7(30' la (50-60)oC apoi (30min) la (70-80)oC |
200ml/lHNO3+22g/lK2Cr2O7 + 0,33g/lNaNO2 200ml/lHNO3+22g/lK2Cr2O7 +0,33g/lNaNO2+5g/l NaOH |
PAS 7-191 |
|
|
P7"(24h) |
200ml/lHNO3+22g/lK2Cr2O7 +0,33g/lNaNO2+0,5g/l Na2MoO4 |
PAS11-231 |
|
|
P8(1h) |
5g/l NaOH +0,33g/lNaNO2 + 0,5g/l Na2MoO4 |
PAS 3-15 |
|
|
P9(24h) |
0,1g/lHEDTA+0,1g/lC6H8O7+ 0,1g/lNi(NO3)2+0,33g/lNaNO2+ 0,5g/lNa2MoO4+1g/lNa4EDTA+1mlNH3 |
PAS 12-24 |
Pentru evaluarea cineticii formarii filmelor superficiale pe otelurile carbon dupa expunerea lor la operatiile de repasivare chimica, s-a procedat la cantarirea periodica a probelor scoase din autoclave dupa diferite perioade, in vederea urmaririi oxidarii lor in timp, post-autoclavizare. Pentru studierea caracteristicilor filmelor superficiale formate pe otelurile carbon dupa operatiile de repasivare urmate de cele de autoclavizare, s-a utilizat microscopia metalografica si masuratorile de impedanta executate in solutia inerta de (acid boric + borat de Na)
2.1.Corelarea caracteristicilor electrochimice ale probelor repasivate cu tipul solutiei de repasivare
Intrucat pentru studierea caracteristicilor electrochimice ale probelor filmate, cea mai adecvata metoda este cea a spectroscopiei impedantei electrochimice (EIS), in continuare vor fi prezentate rezultatele aplicarii acestei metode:
Solutiile P1 si P2 au pH-uri similare (in jur de 10,6) reglate cu N2H4 si NH3, diferenta intre ele constituind-o concentratia inhibitorului de pasivare introdus (Na2MoO4), care este mai mare in solutia P2. Curbele Nyquist si Bode aferente probelor decrustate, repasivate in solutiile P1 si respectiv P2 sunt prezentate in fig.2 si 4[147]. Filmele superficiale formate pe probele repasivate in aceste solutii au caracteristici electrochimice similare, fapt demonstrat de tipul de circuit echivalent corespunzator tuturor acestor filme, care este R(CR)(CR).
Intre probele expuse in diverse solutii de prepasivare au fost remarcate urmatoarele diferente:
- valoarea impedantei totale si a rezistentei de polarizare(Rp) este mai mare in cazul probelor prepasivate in solutia care a continut o concentratie mai mare de inhibitor;
- starea initiala a suprafetei probelor prezinta o mare importanta, fapt dovedit de valorile mult mai mari ale impedantei si a rezistentei de polarizare(Rp) aferente probelor martor - slefuite - comparativ cu celelalte probe, decrustate initial (figura 3[147]).
|
|
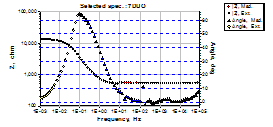
Fig.2[13] Curbele Bode si ale unghiurilor de faza aferente unui otel carbon decrustat, repasivat in solutia P1 si autoclavizat apoi 70 zile (24h in electrolit) |
|||||||||||
|
R(CR)(CR)
|
Component [unitate] |
Valoarea |
|
R[W.cm2] | |
|
C[F/ cm2] | |
|
R[W.cm2] | |
|
C[F/ cm2] | |
|
R[W.cm2] |
Fig.3[147] Curbele Bode si ale unghiurilor de faza aferente unei probe martor din OLC repasivata in solutia P1, autoclavizata 70 zile (24h in electrolit)
R(CR)(CR)
|
Component [unitate] |
Valoarea |
|
R[W.cm2] | |
|
C[F/ cm2] | |
|
R[W.cm2] | |
|
C[F/ cm2] | |
|
R[W.cm2] |
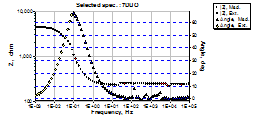
Fig.4[147] Curbele Bode si ale unghiurilor de faza aferente unui OLC decrustat, repasivat in solutia P2 si autoclavizat 70 zile (24h in electrolit)
Ca variante la solutiile de pasivare P1 si P2, au fost concepute alte doua tipuri de solutii, care au continut concentratii mult mai mari de N2H4 si NH3 si care, implicit, au avut pH-uri mai mari. Acestor doua noi variante - P3 si P4 - le-au fost adaugati inhibitori in concentratii similare cu cele adaugate in P1 si P2. Referitor la probele repasivate in solutiile P3 si P4 comparativ cu cele repasivate in solutiile P1 si P2, putem arata ca filmele superficiale formate post-autoclavizare pe probele decrustate in solutiile P3 si P4 au caracteristici electrochimice comune, fapt dovedit de tipul de circuit echivalent aferent tuturor, care este R(CR)(CR).
Filmele superficiale formate post-autoclavizare pe probele prepasivate in solutiile P3 si P4 au caracteristici electrochimice similare cu cele expuse in solutiile de pasivare P1 si P2, fapt dovedit de tipul de circuit echivalent aferent tuturor, care este R(CR)(CR).
Probele prepasivate in solutia P4 prezinta, insa, caracteristici electrochimice ceva mai bune, fapt evidentiat prin pozitia curbei aferenta impedantei filmului format in solutia de prepasivare P4(figura 5[147]).
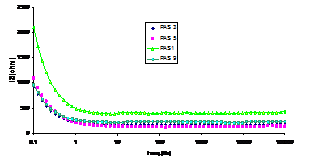
Fig.5[147] Curbele Bode aferente probelor autoclavizate, prepasivate
initial in solutiile: P1-PAS3, P2-PAS9, P3-PAS5 si P4-PAS1
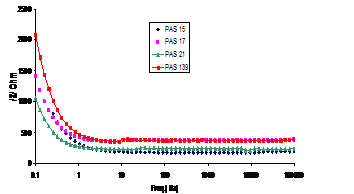
Fig.6[147] Curbele Bode aferente probelor autoclavizate, prepasivate initial in solutiile: P1-PAS15, P2-PAS21, P3-PAS17 si P4-PAS139 (24 h in electrolit)
Comparand curbele Bode aferente probelor decrustate, prepasivate chimic in aceleasi tipuri de solutii de pasivare (P1, P2, P3, P4), dar dupa 24h de mentinere in electrolit a probelor (fig.6[147]), constatam aceeasi ordine de amplasare a curbelor Bode, cu diferenta ca in acest caz se constata o departajare a curbelor aferente probelor repasivate in solutiile P1, P2, P3, impedantele scazand in urmatoarea ordine: P4, P3, P1, P2.
Suprapunerea aproape perfecta a curbelor Bode aferente probelor repasivate in solutia P4, inregistrate dupa 0,5ore si respectiv 24h de mentinere in electrolit, semnifica caracterul compact si protector al filmelor formate pe aceste probe.
Comparand amplasarea curbelor Bode aferente probelor prepasivate in solutiile P2, P4 si P5, care au continut concentratii similare de molibdati ai unor diferiti cationi, s-au remarcat urmatoarele:
- impedantele au scazut - dupa 0,5ore de mentinere in electrolit - in urmatoarea ordine: probe prepasivate in solutiile P4, P5, P2;
- dupa 24h de mentinere in electrolit, situatia s-a modificat in sensul ca curba aferenta probei prepasivate in solutia P5 s-a suprapus peste cea corespunzatoare probei prepasivate in solutia P4, curba corespunzatoare probei prepasivate in solutia P2 plasandu-se in mod constant in partea inferioara a graficului (fig.7[147]).

Fig.7[147] Curbele Bode aferente probelor autoclavizate, prepasivate initial in solutiile: P2-PAS21, P4-PAS139, P5-PAS18 (24 h in electrolit)
Alta varianta de solutie, care a continut concentratii identice de N2H4 si NH3, a fost cea in care s-au utilizat 0,5g/l de (NH4)2MoO4.Examinand curbele Bode aferente probelor prepasivate in solutiile P5 si P4, s-a constatat ca filmelor formate initial pe probele prepasivate in solutia P5 in care s-a folosit (NH4)2MoO4 ca inhibitor,le corespund valori mai mici ale impedantei decat cele aferente celor prepasivate in solutia continand Na2MoO4.
R(CR)(CR)
|
Component [unitate] |
Valoarea |
|
R[W.cm2] | |
|
C[F/ cm2] | |
|
R[W.cm2] | |
|
C[F/ cm2] | |
|
R[W.cm2] |
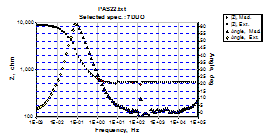
Fig.8[147] Curbele Bode si ale unghiurilor de faza aferente unui OLC decrustat, repasivat in solutia P6 si autoclavizat 70 zile (24 h in electrolit)
Faptul ca impedanta probelor prepasivate in solutia P5, mentinute 24h in electrolit, a crescut foarte mult egaland-o pe cea a probelor prepasivate folosind Na2MoO4 ca inhibitor, dovedeste porozitatea mare a filmelor formate pe probele prepasivate in solutia in care (NH4)2MoO4 a fost folosit ca inhibitor.(figura 7[13])
Luand ca baza compozitia solutiei P5, s-a adaugat un amestec de agenti oxidanti (un amestec de azotat si azotit) pentru a se prepara o alta solutie de prepasivare P6. Faptul ca probele repasivate in solutia P6 au prezentat post-autoclavizare valori ale impedantei si rezistentei de polarizare(Rp) comparabile cu cele ale probelor repasivate in solutia P5, care a continut (NH4)2MoO4 ca inhibitor, demonstreaza contributia nesemnificativa a acestor agenti oxidanti.(figura 8).
Au mai fost concepute alte doua variante de solutii care actioneaza in doua etape asupra probelor decrustate si anume:
- solutia P7 realizeaza o oxidare energica in mediu acid (pH <1) a suprafetelor probelor decrustate, urmata de o repasivare in mediu puternic alcalin (pH=12,5) in prezenta NaNO2 si a Ni(NO3)2;
- solutia P7'' realizeaza initial o oxidare energica in mediu acid (pH<1) a suprafetelor probelor decrustate, urmata de o repasivare in prezenta NaNO2 si a inhibitorului Na2MoO4.
Suprapunand in figura 9[13] curbele Bode aferente probelor repasivate in solutiile P7 si P7'', putem remarca urmatoarele:
- in urma prepasivarii probelor decrustate in solutia P7, se obtine un film subtire si compact, a carui impedanta si rezistenta de polarizare( Rp) nu variaza cu perioada de mentinere a probelor in electrolit;
- repasivand probele decrustate utilizand reteta P7", se obtine un film care are o impedanta mare comparativ cu filmele obtinute aplicand celelalte retete. Acest film, desi este protector fata de metalul de baza, poseda o oarecare porozitate, lucru demonstrat de aparitia unui element Warburg, in circuitul echivalent al filmului de pe proba mentinuta 24h in electrolit.
O alta solutie de pasivare a fost P8, care a realizat oxidarea probelor decrustate in mediu alcalin de NaOH, in prezenta Na2MoO4 si NaNO2.
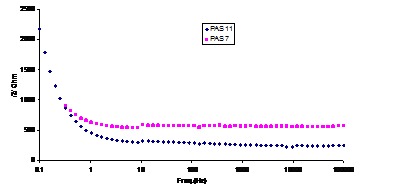
Fig.9[13] Curbele Bode aferente probelor autoclavizate, repasivate initial in solutiile: P7 (PAS 7) si P7"(PAS11) (0,5h in electrolit
O alta varianta la solutiile P7 si P7" a constituit-o solutia P9, in care caz, intr-o prima etapa, s-a realizat o indepartare completa a filmelor remanente post-decrustare, utilizand o solutie clasica de decrustare care continea H-EDTA si acid citric. Suprafetele astfel curatate si activate au fost introduse ulterior intr-o solutie care continea un amestec de substante oxidante - Ni(NO3)2 si NaNO2 -, un inhibitor de pasivare (Na2MoO4), toate dizolvate intr-o solutie care continea un agent de complexare a ionilor de fier trecuti in solutie(Na4-EDTA), al carei pH a fost reglat la valoarea 10,4, propice formarii unui film pasiv pe probe.
Filmele formate post-autoclavizare pe probele repasivate in solutiile P8 si P9 au prezentat caracteristici electrochimice similare intre ele, fapt demonstrat de amplasarea curbelor Bode si de circuitele echivalente identice. Impedantele filmelor formate pe probele prepasivate in solutiile P8 si P9 au fost comparabile ca valori cu cele ale filmelor rezultate post-pasivare in solutia P7, cu diferenta ca porozitatea filmelor formate post-autoclavizare pe probele prepasivate in solutiile P8 si P9 a fost ceva mai mare decat cea a filmelor formate post-autoclavizare pe probele prepasivate in solutia P7 (fig.10).
Comparand curbele Bode aferente probelor pasivate in solutiile care realizasera initial curatirea suprafetelor utilizand o varianta de amestec cromic (P7, P7") si respectiv o solutie de decrustare clasica care continea acid citric si EDTA (P9) cu cele ale probelor decrustate, pasivate direct intr-o solutie alcalina care continea agenti oxidanti si un inhibitor -(NH4)2MoO4(P6) - s-au constatat urmatoarele:
- dupa 0,5ore de mentinere in electrolit, valoarea cea mai mare a impedantei au avut-o probele pasivate in solutia P7", iar cea mai mica , cele pasivate in solutia P9;
- aceeasi ordine de scadere a impedantelor a fost respectata si dupa 24h de mentinere in electrolit a probelor, numai ca dupa aceasta perioada de mentinere in electrolit a probelor, curbele Bode s-au distantat unele de altele, valoarea impedantelor scazand in ordinea: P7", P6, P7 si P9 (fig.11[13]).
O explicatie a acestor variatii ale impedantelor consta in faptul ca amestecul cromic utilizat initial in reteta P7" asigura o curatire si respectiv o activare a suprafetelor metalice, care, venind ulterior in contact cu un agent oxidant si cu un inhibitor de coroziune, se vor oxida uniform;
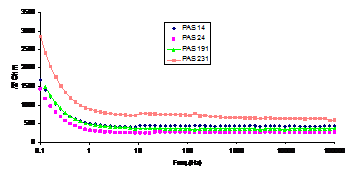
Fig.10[13] Curbele Bode aferente otelurilor autoclavizate, repasivate in solutiile: P7-PAS191, P7"-PAS231, P8-PAS14 si P9-PAS24 (24h in electrolit)
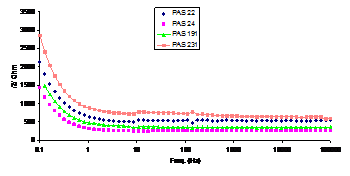
Fig.11[13] Curbele Bode aferente OLC autoclavizate, repasivate in solutiile: P6-PAS22, P7-PAS191, P7"- PAS231 si P9-PAS24 (24 h in electrolit)
Pe de alta parte, solutia de decrustare pe baza de H-EDTA si acid citric, fiind mai putin agresiva decat amestecul cromic, nu va curata la fel de bine suprafata ca si solutia P7". Oxidarea finala executata atat in prezenta agentilor oxidanti cat si a unui agent complexant - Na4EDTA -, va face ca la interfata metal/solutie sa aiba loc doua procese concurente: pe de o parte, formarea unor oxizi de fier care se vor depune, concomitent cu formarea unor complecsi ai fierului care se vor detasa de la suprafata si solubiliza. Avand in vedere ca o parte din ionii de fier din metalul de baza vor fi complexati si ulterior solubilizati, rezulta ca stratul superficial de oxid format in urma aplicarii solutiei P9 va fi mai subtire decat cel format ulterior aplicarii solutiei P7", situatie care se va reflecta, de altfel, si in valorile impedantelor filmelor superficiale.
Comparand curbele Bode inregistrate dupa 0,5h si 24h corespunzatoare probelor prepasivate in retetele P1,P2, P5 si P9, se observa ca in zona impedantelor superioare sunt grupate curbele aferente retetelor P5 si P9, iar in zona celor inferioare sunt grupate curbele aferente retetelor P2 si P1 (fig.12[13]).
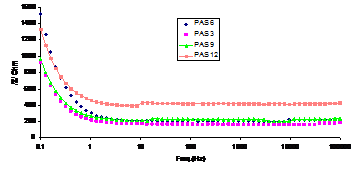
Fig.12[13] Curbele Bode aferente OLC autoclavizate, repasivate in solutiile: P1-PAS3, P2-PAS9, P5-PAS6 si P9-PAS12 (0,5h in electrolit)
Spre deosebire de celelalte situatii in care mentinerea probelor in electrolit timp de 24h a condus la o departajare a curbelor Bode pe intreg domeniul de frecvente, in acest ultim caz, curbele sunt departajate doar in domeniul frecventelor mici (intre 0,1 si 1 Hz). S-a constatat, totodata, ca impedantele cele mari au corespuns probelor prepasivate in solutia P5, iar cele mai mici, probelor prepasivate in solutia P2. Din aceasta comparare a curbelor Bode reiese faptul ca hotaratoare in ce priveste comportarea la pasivare a fost concentratia N2H4 si NH3 din solutiile de pasivare, care, atunci cand a fost mare, a condus la formarea unor filme superficiale pasive mai compacte si implicit mai protectoare fata de metalul de baza.
2.2. Evaluarea grosimii filmelor superficiale formate
pe probele prepasivate si autoclavizate
Dupa cum se vede din tabelul 1, solutiile de pasivare P1 P5 sunt relativ asemanatoare intre ele, compozitia lor diferind fie prin concentratia amoniacului si N2H4 utilizate pentru reglarea pH-ului, fie prin tipul, respectiv concentratia inhibitorului de coroziune. Aceste diferente minore existente intre compozitia solutiilor au influentat putin sau deloc caracteristicile filmelor superficiale formate post-pasivare pe otelurile carbon. Avand in vedere ca probele pasivate chimic au fost supuse ulterior unor autoclavizari in conditiile specifice de functionare ale circuitului secundar, peste filmele create in decursul pasivarii chimice s-au suprapus alte filme, contribuind astfel la ingrosarea primelor.
In general, filmele formate post-autoclavizare pe probele prepasivate chimic in solutiile P1 P5 au grosimi cuprinse intre cca.1mm si 3,3mm. Filmele cele mai groase s-au format pe probele prepasivate in solutiile P1 P3 (fig.13a), iar filmele cele mai subtiri si uniforme ca grosime au luat nastere pe probele prepasivate in solutia P4 (fig.13b)[13].
Solutia P6 are o compozitie de baza asemanatoare cu a solutiilor P3 P5, in care a fost adaugat in plus un amestec de azotat si azotit. Aceste ultime substante au contribuit la oxidarea mai energica a otelului carbon comparativ cu celelalte solutii alcaline, fapt demonstrat de grosimea mai mare a filmelor create in solutia P6, comparativ cu cele create in solutia P4 si P5. In plus, neuniformitatea grosimii filmului este mai accentuata in cazul probelor prepasivate in solutia P6(fig.13c) comparativ cu probele prepasivate in solutiile P3 P5.
O alta varianta de solutie continand acelasi amestec de azotat si azotit de sodiu a fost preparata folosind ca baza o solutie clasica de decrustare, in care s-a adaugat Na2MoO4, NaNO2, Ni(NO3)2 si amoniac. Ca si in cazul solutiei P6, prepasivarea in solutia P9 (fig.13d) a condus la crearea unui strat neuniform ca grosime, prezentand variatii intre 0,6 si 2,5 mm.
|
|
Fig.13a,b,c,d,e. Micrografiile filmelor formate pe otelurile carbon autoclavizate initial, decrustate, prepasivate in urmatoarele solutii: a-P2; b-P4; c-P6; d-P9; e-P8 si autoclavizate ulterior 70 zile (x 1000) |
|
|
|
|
|
|
|
|
|
|
|
Utilizand o solutie de repasivare cu un pH mai ridicat (P8), care contine NaOH in locul amestecului de (N2H4 si NH3) si folosind NaNO2 si un inhibitor de coroziune, s-au obtinut filme mai subtiri si mai uniforme in urma repasivarii in solutia P8 comparativ cu solutia P6 (fig.13e, 13c). De aici rezulta ca in solutii alcaline numai NaNO2 are un efect benefic asupra pasivarii otelurilor, nu si NaNO3.
Alte doua variante de solutii au fost preparate avand la baza o solutie continand 20%vol.HNO3 si K2Cr2O7. In timp ce intr-una din variante s-a adaugat doar o concentratie mica de NaNO2 si Na2MoO4 ca inhibitor de coroziune, in cealalta varianta s-a adaugat, in afara de NaNO2 si NaOH, astfel incat pH-ul final al acestei solutii a devenit puternic alcalin. Din cauza pH-urilor net diferite, filmele create in urma prepasivarii in aceste solutii au diferit atat ca uniformitate cat si ca grosime.
Bibliografie
Baldev Raj, et al., "Challenges in Materials Research for Sustainable Nuclear Energy" MRS Bulletin vol.33 (2008)
Bereznai G. "Nuclear Power Plant System and Operation: Chap.1: Overall Unit" Ontario, Canada (2008)
Nuclear Reactor Fuel - the current situation: Chap.1"How nuclear power works" Royal Society (1999)
Gong Hongqi, Hart R.S., "Moderator, Heat Transport and Steam Systems" (2005)
I.Prodea « Nuclear Electricity Share Growing -
A Key Factor for Sustainable Energetic Development of
G.Rocchini Corrosion NACE 43 p.326 (1987)
W.J.Lorenz, F.Mansfeld Corrosion Science 21 p.647 (1981).
E.C.Potter, E.M.W.Mann The Ist International Congress on Metallic Corrosion London (1961)
J.W.Barton, F.Arkless " Experience with Ferritic and Austenitic Steel of PWR Circuits" IAEA-SM-264/10 p.35-148 (1983)
J.Chen, B.Rosborg " The Possible Influences of Fuel Crud Build-up and Water Chemistry on Waterside Corrosion of Metals" IAEA-TEC-DOC 1128 p.257 (1999)
S.T.Costa Materials Performance July (1990).
F.Nordmann "Aspects
on Chemistry in French Nuclear Power Plants" The 14th International
Conference on the Properties of Water and Steam (
Data processing technologies and diagnostics for water chemistry and corrosion control in nuclear power plants (DAWAC)" Report of a Coordinated Research Project 2001-2005 IAEA-TEC-DOC 1505
Pourbaix M., "Atlas of Electrochemical Equilibria in Aqueous Solutions"
Computer Calculated Potential-pH Diagrams to 300oC" NP-3137, vol.2 EPRI, Palo Alto,
F.Sweeton, C.H.Baes " The solubility of magnetite and hydrolysis of ferrous ion in aqueous solutions at elevated temperatures", J.Chem.Thermodynamics 2 , p.479 (1970)
P.R.Tremaine, J.C. LeBlanc "The Solubility of Magnetite and the Hydrolysis and Oxidation of Fe2+ in Water at 3000C" AECL 6654 (1980)
G.A. Kanert, G.W.Gray, etc. "The Solubility of Magnetite in Basic Solutions at Elevated Temperatures "AECL 5528 (1976)
P.Taylor, D.Owen "Oxidation of Magnetite in Aerated Aqueous Media" AECL 10821 sau COG- 93 - 81(1993)
Baboian R., Ed. "Corrosion Tests and Standards: Application and Interpretation" ASTM Manual Series: MNL 20 (1995).
STAS 4203-74 "Metalografie.Luarea si pregatirea probelor metalografice"
Procedura SCN"Prelevarea si pregatirea probelor metalografice provenite din componente metalice corodate in instalatii nucleare".
M.Radulescu "Stabilirea parametrilor tehnologici pentru indepartarea depunerilor de pe conductele de alimentare din otel carbon" RI SCN(2003)
Procedura SCN"Evaluarea susceptibilitatii la coroziune a materialelor structurale utilizand metoda variatiei potentialului de coroziune in circuit deschis functie de timp" Ed.3 Act.0
Procedura SCN "Determinarea comportarii la coroziune a materialelor structurale prin metoda polarizarii lineare" Ed.3 Act.0
Procedura SCN "Determinarea comportarii la coroziune a materialelor structurale prin metoda polarizarii ciclice" Ed.3 Act.0
ASTM G61" Test Method for Conducting of Cyclic Potentiodynamic Polarization Measurements for Localized Corrosion Susceptibility of Fe, Ni and Co - based Alloys" (2005)
"Electrochemical Impedance: Analysis and Interpretation",
ASTM STP 1188, J.R.Scully,Eds. (1993)
Mansfeld F., Kendig M., Journal of the Electrochemical Society, Vol.135,p.828 (1988)
Kendig M.W., Scully, J.R., Corrosion Vol.46, No.1 (1990)
Szklarska-Smialowska, "Pitting of Metals" NACE International Houston
Amsuini et al., Corrosion/95, paper 14, NACE International (1995)
"Consensus on Operating Practices for the Control of Feedwater and Boiler Water Chemistry in Modern Industrial Boilers" ASME, New York.
N.H.Piacquadia, etc IAEA-TEC-DOC 667 vol.1 (1992)
S.UCHIDA, et al.,"Water chemistry data acquisition, processing, evaluation and diagnostic systems in PHWR future improvement of plant reliability and safety" Report at the 3nd Research Coordinated Meeting of the Coordinated Research Project on "Data Processing Technologies and Diagnostics for Water Chemistry and Corrosion in Nuclear Power Plants", Beijing (2004)
EPRI Nuclear Group (.Millett P., Wood C.,etc) "Plant-Specific Optimization of PHWR Water Chemistry" TR - 107329 (1997)
Science and Reactor Fundamentals. CNSC Technical Training Group (2003)
M.Radulescu, etc 'Influence of the Secondary Circuit Chemistry on the Characteristics of the Filmed Carbon Steel Components'. Manifestare Internationala Eger (Ungaria) (2001)
R.I.SCN "Diminuarea acumularii produsilor de coroziune pe componentele din otel carbon prin reglarea pH-ului in circuitul secundar cu etanolamina" (2007)
Procedura SCN "Evaluarea gravimetrica a coroziunii cupoanelor din otel carbon expuse in mediu apos la temperatura si presiune ridicata" Ed.2 Act.0 (2008)
RI SCN "Monitorarea coroziunii in circuitul secundar functie de tipul aminelor folosite pentru reglarea pH-ului mediului coroziv" (2008)
Gebhardt O., Journal of Nuclear Materials 203 p.17(1993)
Do Haeng Hur, Myung Sik Choi, etc. Journal of Nuclear Materials 305 no.2-3 p.220 (2002)
B.A.Abd - El Nabei, etc. Corrosion NACE 52 nr.9 p.671 (1996)
O. Radovici Proceedings of the 2nd European Symposium on Corrosion Inhibitors Ferrara (1965)
E.S. Ivanov "Inhibitors for Metals Corrosion in Acidic Media" Metallurgy Moscow (1986)
U. Bertocci "Electrochemical Noise Analysis and Its Application to Corrosion" Paper 24 Corr. NACE Huston Tx (1989)
N.Hackerman, etc. Journal of Electrochem.Soc.vol.113 (1966)
S.Ramachandran Corrosion NACE 55nr.3 p.259 (1999)
S.Ramachandran, etc.Journal of Phys.Chem.A 101 nr.1 (1997)
EPRI Nuclear Group (K.Fruzetti et al) "Multivariable Assesment of Flow Accelerated Corrosion and Steam Generator Fouling" (2003).
Corrosion Processes and Mechanisms" Ed. A.Turnbull and A.Griffiths (2000)
M.Radulescu, etc "Amines duality used as regulating substances of NPP secondary circuit water chemistry" Nuclear'09 Pitesti (2009)
M.Radulescu, etc "Considerations referring to the correlation between the chemistry of the secondary circuit and the physico-chemical characteristics of the superficial films formed on carbon steel pipes " ICSI Conf. Rm.Valcea (2003)
M.Radulescu, etc "Chimismul mediului apos-factor determinant al coroziunii componentelor din otel carbon din circuitul secundar" Conf.RAAN - Tr.Severin
"Coolant Technology of Water-Cooled Reactors" Vol.3: Activity transport Mechanisms in Water Cooled Reactors (WACOLIN CRP) IAEA-TEC-DOC 667 (1992)
INTERNATIONAL ATOMIC ENERGY AGENCY "High Temperature On-Line Monitoring
of Water Chemistry and Corrosion Control in Water Cooled Power Reactors" Report
of WACOL CRP - 1995÷1999, IAEA-TECDOC-1303,
IAEA "Coolant Technology of Water Cooled Reactors: An Overview", Technical Reports Series No. 347 (1993)
K.Mabuchi, Y.Horii " The effect of dissolved oxygen on the corrosion behaviour of carbon steel in high temperature water" Corrosion NACE 47 p.500 - 508 (1991)
P.S. Joshi, G. Venkateswaran , etc. " Simulated decomposition of Fe(OH)2 in the presence of AVT chemicals and metallic surfaces; relevance to low-temperature feedwater line corrosion" Corrosion NACE 49 p.300 - 309 (1993)
N.Fujita, C.Matsuura, etc. " The effect of silica on hydrogen evolution and corrosion of Fe in high temperature water" Corrosion NACE 46 p.804 - 812 (1990)
G.Visalakshi, G.Venkateswaran, etc."Compositional characteristics of magnetite synthesised from aqueous solutions at temperatures up to 523oK" Materials Research Bulletin 28, p.829-836 (1993)
J.A.Sawicki, M.E.Brett "Mossbauer study of corrosion products from a CANDU secondary system" Nuclear Instrumental Methods in Physics Research Serie B vol.76 p.254 (1993)
J.Y.C.Ho, M.E.Brett "BNGS-B Unit 7 Corrosion Product Transport Study" Ontario Hydro Report, Chemical Operations Department (1992)
V.M.Sedov, P.G. Krutikov ,etc. "Mossbauer Spectroscopy in the Phase-Composition Analysis of Corrosion Deposits in a NPS" Soviet Atomic Energy 46 p.396 - 399 (1980)
L.N.Moskvin, A.A.Efimov, etc."Application of Mossbauer spectroscopy to the determination of the phase composition of finely dispersed corrosion products of reactor materials in a water coolant" Soviet Atomic Energy 51 p.383 - 385 (1981).
ASTM G46 Standard Guide for Examination and Evaluation of Pitting Corrosion" (2005)
N.Sridhar,etc."Experimental Investigation of Localized Corrosion of High Level Waste Container Materials " CNWRA 93-004 (1993)
G.C.Palit Corrosion NACE 49 nr.12 p.977 - 991(1993)
M.Radulescu, etc., "Pitting Susceptibility of Some Carbon Steels from Secondary Circuit of a NPS CANDU" The 6th ICOSECS International Conference of the Chemical Societies of the South-East European Countries Belgrad (Serbia) (2006)
N.G.Thompson Corrosion NACE 44 nr.8 p.581(1988)
A.A.Sagues Corrosion NACE 44 nr.8 p.555(1988)
A.Misczyk, etc Corrosion NACE 53 nr.7 p.572(1997)
R.G.Kelly ASTM Pitting Corrosion (2007)
N.D.Green, M.G.Fontana Corrosion NACE 15 nr.1 p.59t (1959)
T.Shibata "Statistical and stochastic approaches to localized corrosion" Corrosion NACE vol.52, nr.11 (1996)
C.Gabrielli, F.Huet,etc.Corrosion NACE 46 nr.4 p.266 (1990)
B.E.Brown, H.H.Lu, etc.Corrosion NACE 48 p.970 (1992)
D.E. Williams, C.Westcott, etc. Journal of Electrochemical Soc.132 p.1804 (1985)
G.Bianchi, etc. Corrosion Science 10 p.19-27 (1970)
ASTM G100: Method of Conducting Cyclic Galvanostatic Polarization
S.Tsujikawa, Y.Sone,etc. "Corrosion Chemistry within Pits, Crevices and Cracks" A.Turnbull Ed.London U.K.(1987)
Y.Asakura, H. Karasawa, etc. Corrosion NACE 45 nr.2.p.119 (1989)
] G.S.Frankel, L.Stockert, etc. Corrosion NACE 43 p.429 (1987)
D.H.Lister, R.D.Davidson, etc. Corr. Sci. 27 nr.2 p.113 (1987)
H.Arbeau, H.Allsop, etc. Corr. NACE 54 nr.6 p.459 - 468 (1998)
M.Zmitko,etc. IAEA-TECDOC-1128 p.185 -194 (1999)
R.S.Rodliffe, M.V.Polley, etc. IAEA-TEC-DOC 429 (1987)
G.J. Bignold, R.Garnsey, etc. Corr.Sci. 12 p.325-332 (1972)
P.H.Effertz Proc. of 5th Int.Congr.on Metallic Corros.Tokyo (1972)
D.H.Lister, E.McAlpine, etc. EPRI-NP-3460 (1984)
N.D.G.Divisional Chemical Reference Manual Sect.B-3 "Boiler Steam and Water Systems" (1991)
Y.Liner, M.B.Carver, etc. "Mathematical Modelling of Material Transport and Sludge Formation in Nuclear Steam Generators" Proceedings of the Third International Conference on Simulation Methods in Nuclear Engineering ( Canada) p. 572-593 (1990)
J.W.Cleaver, B.Yates,etc. "A Sub-Layer Model for the Deposition of Particles from a Turbulent Flow" J.Chem. Eng. Sci. 31 (1975)
H.Namduri "Formation and Quantification of Corrosion Deposits in the Power Industry" Dissertation Thesis (2007)
Science and Reactor Fundamentals - Materials CNSC Technical Training Group
C.W.Turner, D.W.Smith "A Study of Magnetite Particle Deposition onto Carbon Steel and Alloy-800 between 25 and 850C and Predicated Rates under Operating Conditions" Ed: R.L.Baker, E.A.Havego ASME Vol.8 (1992)
C.W.Turner "Rates of Particle Deposition from Aqueous Suspension in Turbulent Flow: a Comparison of Theory with Experiment" Chem. Eng. Sci. 48 p. 2189 (1993)
V.G. Kritskij ,etc. IAEA - TECDOC-1128 (1999)
C.W.Turner, M.Godin "Mechanisms of Magnetite Deposition in Pressurized Boiling and Non-boiling Water" AECL 11046 (1994).
Y.C.Lu, etc "Electrochemical Aspects of Defining the Safe Potential/pH Zone for Corrosion Prevention of Carbon Steels Components", in Proc.of the 4th CNS International Steam Generator Conference, Paper #3 (2002)
J.Peybernes,etc. IAEA-TECDOC-1128 p.213-222 (1999)
R.N. Parkins, etc "Mechanistic Aspects of IGA SCC of Ferritic Steels", Corrosion NACE 52 p.363(1996)
M.Radulescu, etc 'Chemistry of the secondary circuit reflected in the physio-chemical characteristics of the filmed carbon steel components' Congresul de Coroziune Corrosion 2002 Colorado SUA)(2002).
S.Odar "Water Chemistry Measures to Improve SG Performance"
14th Intern. Conf. on the Properties of Water and Steam -
K.Makela, etc."Iron Content in the Feed Water for the SG Secondary Circuit" 14th
Intern. Conf. on the Properties of Water and Steam -
A.Stutzmann, L. Viricel, etc "
French Experience in OD IGA/SCC and Fouling of SG Tubes" Conf.of British
Nuclear Energy Society -
Ph.Berge,etc."PWR Secondary Water Chemistry and Corrosion" JAIF Conf. Japan (1988)
J.M.Boursier,etc."Contribution des expertises metallurgiques de tubes extraits a la comprehension de la corrosion en milieu secondaire des generateurs de vapeur d'EDF " Fontevraud IV Intern Symp. SFEN (1998)
J.Stubbe, etc. "Le plomb et le cuivre sont-ils impliques ?" Fontevraud III International Symposium SFEN (1994).
P.J.Millett, etc
"Investigation of the Redox Conditions in the Secondary System of PWRs" Proc.of SFEN International Conference on Chemistry in
Water Reactors,
A.Kishida et al. "The Causes and Remedial Measures of SG Tube IGA Attack in Japanese PWR" The 3rd Intern.Symp.on the Environmental Degradation of Materials in Nuclear Power Systems, (1987)
A.Stutzmann, etc." EDF Studies about Chemistry Environment Impact on OD Corrosion" JAIF Conference on Water Chemistry in Nuclear Power Plants, Japan (1998)
F.Vermorel, etc
"About the Hydrazine Effect on Flow Accelerated Corrosion"
Eurocorr'99
EPRI Steam Generator Progress Report, Rev15 (2000)
E. Rukenstein and D.C. Prieve J.Chem. Soc. Faraday Trans.II vol.69 p.1522 (1973)
Characterization of PHWR Steam Generator Deposits", EPRI, Palo Alto CA, TR-106048 (1996)
D.H.Charlesworth, Chemical Engineering Symposium Series, Vol.66, No.104, p.21 (1970)
I.Betova et al., Proc.of ICAPP Paper 7122, Nice, France (2007)
S.K.Beal, J.H.Chen, etc. "A Model of Sludge Behaviour in Nuclear Plant Steam Generators" EPRI NP-4620 (1986)
M.B.Carver, L.N.Carlucci, etc. "Thermalhydraulics in Recirculating Steam Generators. THIRST Code User's Manual" AECL 7254(1981)
G.Rocchini Materials & Corrosion 47 p.374 (1996)
S.Ramachandran, etc. Corrosion NACE 57 nr.6 p.508(2001)
J. Robertson, M.Manning Mater. Sci. Technol. 6 p.81 (1990)
M.Radulescu The Establishing of Main Parameters Characteristic to Chemical Descaling of Filmed Carbon Steels" RICCCE XV (2007)
I.L.Rosenfeld,etc. Protection of Metals 14 p.495 (1978)
I. Lukovits,etc. Corrosion NACE 53 nr.12 p.915 (1997)
P.Li, T.C.Tan, etc Corrosion NACE 53 nr.3 p.186 (1997)
F.B.Growcock Corrosion NACE 45 p.1003 (1989)
P.G.Abdul-Ahad,etc Corrosion NACE 45 p.978 (1989)
L.N.Putilova, etc. 'Metallic Corrosion Inhibitors' Pergamon Press New York(1960)
M.Radulescu, etc., "Corrosion Inhibitors
for Descaling Solutions: Structure - Efficiency Relationships " The 10th European Symposium on
Corrosion and Scale Inhibitors"
T. Szaner, A. Brandt Electrochemica Acta 26 p.1209 (1981)
Z.A.Foroulis Proceedings of 7th European Symposium on Corrosion Inhibitors Ferrara (1970)
U.R.Evans "Corrosion and Oxidation of Metals" St.Martins Press N.Y.(1960)
R.Rajagopalan, etc Surface Engineering vol.18 no.1 p.53 (2002)
Terry A.DeBold, etc Carpenter Technology Corp. "How to Passivate Carbon Steel Parts" (2005)
D.G.Kolman, S.R.Taylor Corrosion NACE vol.49 no.8 p.622(1993)
P.S.Joshi, G.Venkateswaran, etc Corrosion NACE vol.48 no.6 p.501(1992)
P.R.Roberge, E.Halliop,etc Corrosion NACE vol.48 no.6 p.447(1992)
Max Russell "Chemical Surface Treatments on Stainless Steel" (2004)
ASTM A380 "Cleaning, Descaling and Passivation of Stainless Steel Parts, Equipment and Systems"
R.Godec, etc Corrosion NACE 56 nr.7 p.694 (2000)
Procedura SCN"Omologarea tehnologiei de decrustare la scara de laborator a otelurilor carbon utilizate in circuitul secundar al unei CNE" Ed.3 (2004).
M.Radulescu "The Use of EIS Method to evaluate the Efficiency of Chemical Repassivation of Carbon Steels" SIEN-Bucuresti (2007)
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |