Lichidele spre deosebire de gaze au volum propriu dar nu au forma proprie (lichidele iau forma acelei portiuni a vasului pe care o ocupa). Mai mult, lichidele nu se contracta decat foarte putin, chiar si atunci cind asupra lor se aplica o presiune foarte mare.
Evaporarea. Cand un lichid cum este apa este introdus intr-un vas deschis, el trece cu timpul in aer sub forma de vapori; acest proces se numeste evaporare. Daca procesul are loc intr-un vas inchis evaporarea are loc pana cand aerul de deasupra lichidului ajunge sa contina un procent bine definit de vapori de apa, apoi, procesul aparent inceteaza: se spune ca aerul se satureaza cu vapori de apa. In fapt procesul continua iar la saturatie, numarul de molecule care se reintorc intr-o secunda din starea gazoasa este egal cu numarul celor care parasesc lichidul si trec in starea de vapori saturati (spunem ca intre cele doua procese s-a instalat un echilibru).
Presiunea de vapori. Presiunea vaporilor unui lichid este presiunea vaporilor saturati aflati in echilibru cu lichidul (pentru o temperatura data). De obicei, presiunea vaporilor se exprima in milimetrii co1oana de mercur, adica in torri si constituie o masura a tendintei unui lichid de a se evapora. Masuratorile experimentale au aratat ca presiunea de vapori creste odata cu cresterea temperaturii Lichidele care, la temperatura camerei, au o presiune mare de vapori se numesc volatile.
Punctul de fierbere. In timpul incalzirii unui lichid aflat la temperatura obisnuita, o parte din energia care i se furnizeaza serveste la cresterea temperaturii lichidului, iar o alta parte la formarea vaporilor la suprafata sa. Atunci cand presiunea vaporilor deasupra lichidului ajunge sa depaseasca cu putin presiunea atmosferica (care se opune acestui proces), intreaga energie termica furnizata serveste in continuare la trecerea lichidului in vapori Punctul de fierbere poate fi definit ca temperatura la care presiunea vaporilor lichidului depaseste cu foarte putin presiunea atmosferica. Punctul de fierbere masurat la presiunea de o atmosfera este numit punct normal de fierbere. Punctul de fierbere al apei scade cu altitudinea astfel:
- la nivelul marii - p.f.=100 oC;
- la 2037 m - p.f.= 93 oC;
- la 4418 m - p.f.= 86 oC;
- la 8848 m - p.f.= 71 oC.
Caldura de vaporizare si condensare. Deoarece suprafata unui lichid nu este traversata decat de moleculele care au viteza apropiata de cea maxima (adica "cele mai fierbinti"), lichidul devine mai rece atunci cand pierde aceste molecule. Pentru a intretine evaporarea trebuie ca lichidului sa-i furnizam caldura. Cantitatea de caldura necesara pentru a transforma (la temperatura constanta) 1 g de lichid in 1 g de vapori se numeste caldura de vaporizare. Reciproc, condensarea unui gaz sau a unor vapori in starea lichida pune in libertate o cantitate de energie egala exact cu caldura de vaporizare.
Solutiile sunt amestecuri omogene de doua sau mai multe substante si pot fi dupa starea de agregare: lichide, solide sau gazoase. In cele ce urmeaza ne vom referi la solutii lichide. Solutiile lichide presupun existenta unui solvent si a unei substante care se dizolva in acest solvent care de regula se numeste solvat (sau solut). Solvatul la randul sau poate fi: solid, lichid sau gaz.
Dizolvarea solidelor: cand un solid cristalin se dizolva intr-un lichid are loc trecerea substantei care se dizolva de la o stare ordonata la o stare mai dezordonata. Toate procesele din natura decurg in asa fel incat continutul in energie sa scada si gradul de dezordine sa creasca. Daca ar fi asa, ar insemna ca toate solidele sa se dizolve intr-un solvent oarecare sau sa se dizolve in aer adica sa sublimeze. Trecerii sistemelor organizate de particule intr-o stare mai dezordonata i se opun fortele care asigura coeziunea edificiului cristalin. Putem deci sa previzionam ca daca suma fortelor de interactiune intre moleculele solventului si particulele din cristal este mai mare decat suma fortelor de coeziune care tin particulele din cristal in stare ordonata atunci cristalul se va dizolva.
Sa consideram dizolvarea unui cristal de NaCl. Fiecare ion de sodiu (Na+) este inconjurat de 6 ioni de clor (Cl-) si fiecare ion de clor este anturat de 6 ioni de sodiu (Na+) pentru orice ion din interiorul retelei cristaline. La marginea cristalului acest aranjament nu mai poate fi respectat. Moleculele de apa (care pot fi asimilate ca dipoli - adica au centrul de masa al sarcinilor negative diferit de cel al sarcinilor pozitive) se orienteaza la marginea cristalului astfel: polul pozitiv al dipolilor apei se vor orienta in jurul ionului de Cl- iar cel negativ in jurul ionilor de Na+. Cand suma fortelor de interactiune ion-dipol depaseste interactia electrostatica ce tine ionii in aranjamentul ordonat, ionii parasesc edificiul cristalin si trec in apa sub forma de ioni hidratati (Figura 45). Cristalul de sare se dizolva.
NaCl (s) ↔ Na+(aq) + Cl- (aq)
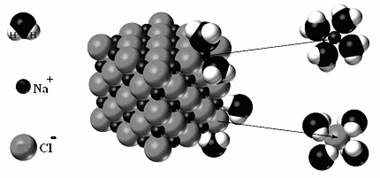
Figura 4 Dizolvarea unui cristal de NaCl in apa.
In concluzie solidele se dizolva in lichide in parte datorita tendintei naturale de a trece intr-o stare dezordonata si pe de alta parte datorita atractiei dintre particulele lor si cele ale solventului.
Dizolvarea lichidelor Lichidele au o tendinta naturala de a se dizolva unele in altele intrucat starile mai ordonate din lichidele pure se modifica si trec in starea mai dezordonata a amestecului. Alcoolul se dizolva in apa in timp ce benzina nu , aceasta deoarece fortele de interactiune intre moleculele alcoolului si ale apei sunt mai mari decat fortele reciproce intre moleculele de alcool si de apa (Figura 46). Daca doua lichide se dizolva unul in celalat se spune ca lichidele sunt miscibile.
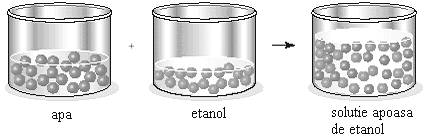
Figura 46. Dizolvarea a doua lichide unul in celalat
Atat in cazul dizolvarii solidelor cat si ale lichidelor in apa se pot intrevedea doua reguli:
Regula1: Substante asemanatoare se dizolva una in alta: solvatii polari se dizolva in solventi polari; solvati nepolari se dizolva in solventi nepolari
Regula 2: Majoritatea solvatilor ionici care au ioni cu sarcini mici sunt solubili in apa.
Datorita competitiei intre fortele de coeziune si fortele de atractie intre solut si solvent marea majoritate a substantelor au o solubilitate limitata. Un cub de zahar pus intr-un pahar cu apa nu se dizolva integral, ramane o parte solida nedizolvata iar solutia de deasupra partii solide se zice ca este saturata. Solutia saturata este intotdeauna in echilibru cu solutul nedizolvat. Dizolvarea in continuare a solutului se poate face fie prin schimbarea temperaturii fie prin adausul unei noi cantitati de solvent. Prin urmare o solutie poate fi definita ca solutie saturata atunci cand solvatul dizolvat se afla in echilibru dinamic cu solvatul nedizolvat:
Solvat nedizolvat + solvent ↔ solvat dizolvat
Solubilitatea unui solvat este cantitatea de substanta prezenta intr-o anumita cantitate de solvent (atunci cand solutia este saturata). Solubilitatea se exprima de obicei in grame substanta dizolvata in 100 g de solvent. Solubilitatea unui solvat este dependenta de temperatura. De regula cresterea temperaturii duce la cresterea solubilitatii (exista si exceptii). Influenta temperaturii asupra solubilitatii este data curba de solubilitate care are inregistraa pe abscisa temperatura, iar pe ordonata solubilitatea (Figura 47).
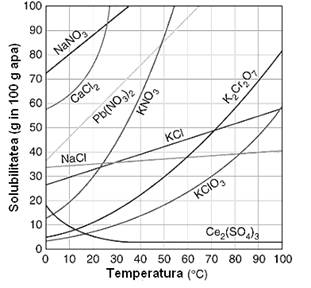
Figura 47. Curba de solubilitate pentru mai multe saruri
Factorul energetic La dizolvare trebuiesc avute in vedere urmatoarele energii implicate in procesul de solubilizare:
- energia necesara invingerii fortelor de atractie intre moleculele solvatului;
- energia necesara pentru a separa moleculele solventului suficient de mult pentru a face loc moleculelor de solvat;
- energia eliberata in urma interactiunii intre particulele de solvat si solvent;
Suma tuturor acestor energii dau caldura de dizolvare care este uneori pozitiva alteori negativa. Ca regula, semnul caldurii de dizolvare arata in ce sens variaza solubilitatea unei substante la modificarea temperaturii.
Factorul entropic: La dizolvare entropia creste ca urmare a demolarii edificiului solvatului si a deranjarii moleculelor solventului. Totusi ca urmare a efectelor de orientare ale moleculelor solventului in jurul particulelor de solvat are loc si un proces de ordonare care reduce gradul de dezordine. Gradul net de inducere al dezordinii depinde de marimile relative ale celor doua efecte.
Pentru a putea compara diferite solutii, trebuie folosite aceleasi modalitati pentru a le caracteriza. Concentratia solutiilor poate fi exprimata astfel:
1) Concentratia procentuala: reprezinta numarul de grame de solvat existenti in 100 ml de solutie.
2) Concentratia molara: (molaritatea) reprezinta numarul de molecule gram (moli) de solvat existenti in 1000 ml solutie.
3) Concentratia normala (valara): reprezinta numarul de echivalenti gram (vali) de solvat in 1000 ml solutie (mai rar folosita).
4) Titrul: reprezinta numarul de grame de solvat existenti in 1 cm3 de solutie.
5) Concentratia molala: reprezinta numarul de moli de solvat dizolvati in 1000 g de solvent.
6) Concentratia procentuala molara: reprezinta numarul de moli de solvat existenti in 100 moli de solvat si solvent.
7) Fractia molara: reprezinta raportul intre numarul de molecule de solvat si numarul total de molecule din solutie (solvat + solvent).
Unele proprietati ale solventului sunt modificate atunci cand are loc dizolvarea unui solvat in solvent si acestea sunt: - presiunea vaporilor sai;
- punctul de fierbere si
- punctul de congelare.
Aceste proprietati care depind de numarul particulelor dizolvate dar nu depind de natura lor, se mai numesc si proprietati coligative.
A) Micsorarea presiunii de vapori. Sa presupunem ca avem o solutie in care solventul nu este prea volatil si un solvat. Vaporii de deasupra solutiei sunt alcatuiti in exclusivitate din moleculele solventului (nu si ale solvatului). Raoult a observat ca: "presiunea de vapori deasupra unei solutii este egala cu produsul dintre fractia molara a solventului in solutie si presiunea de vapori a solventului pur la aceeasi temperatura". Experimentul realizat de Raoult este prezentat in Figura 48.
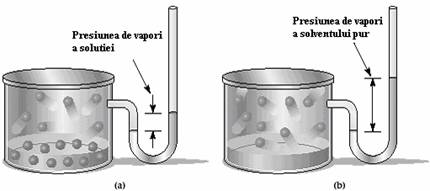
Figura 48. Presiunea de vapori a solventului pur (b) este mai mare decat
presiunea de vapori a solventului din solutie (a)
Daca notam cu Psolvent presiunea de vapori a solventului din solutie, cu Posolvent presiunea de vapori a solventului pur si cu Xsolvent fractia molara a solventului din solutie, atunci legea lui Raoult se poate scrie astfel
Psolvent = Xsolvent x Posolvent
O solutie care se supune legii lui Raoult se numeste solutie ideala. Solutiile se apropie de comportarea ideala atunci cand sunt suficient de diluate. In astfel de solutii, fractia molara a solvatului este proportionala cu concentratia sa molala asfel ca legea lui Raoult se poate scrie:
∆ Pvap = kp m
unde ∆Pvap este valoarea cu care se micsoreaza presiunea de vapori (Posolvent - Psolvent), kp este o constanta de proportionalitate iar m este molalitatea solvatului.
B) Urcarea punctului de fierbere. Un lichid fierbe atunci cand presiunea vaporilor sai de deasupra lichidului devine egala sau depaseste cu foarte putin presiunea atmosferica (care se opune evaporarii). Devine clar ca orice conditii care duc la micsorarea presiunii de vapori a solventului vor atrage dupa sine urcarea punctului de fierbere, deoarece lichidul va trebui sa fie incalzit la o temperatura mai inalta pentru ca vaporii sai sa-si redobandeasca presiunea initiala de vapori. Sa presupunem ca avem 2 solutii apoase in care concentratia solutiei S2 este mai mare decat a solutiei S3 (Figura 49). Curba reprezentata prin linii punctate prezinta variatia presiuniii de vapori a apei cu cresterea temperaturii (la presiunea de 1 atm). Se observa ca cele doua curbe (linie intrerupta si linie plina) ce reprezinta dependenta presiunii de vapori a solutiilor S2 si S3 sunt sub curba presiunii de vapori a apei. Prin urmare pentru ca presiunea de vapori sa egaleze presiunea atmosferica, solutiile trebuie sa fie incalzite la temperaturile T5 si T6 mai mari ca T4. Se poate arata ca variatia punctului de fierbere Δ Tf = Tf - Tfo (Tf este temperatura de fierbere a solutiei (S2 sau S3), Tfo - temperatura de fierbere a solventului, masurate in oC) este proportionala cu concentratia molala a solvatului (m) si este afectata de o constanta kf :
∆Tf = kf m
kf se numeste constanta molala a punctului de fierbere a solventului (in cazul nostru particular, al apei) sau inca constanta ebulioscopica. Ea este diferita de la un solvent la altul.
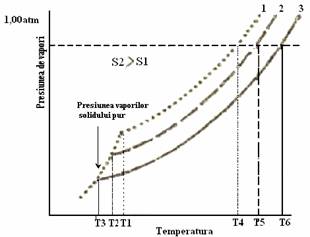
Figura 49. Dependenta presiunii de vapori a solutiilor S2 si S3 in raport de presiunea de vapori a apei.
∆Tc = ke m
unde: ∆Te = Tco - Tso reprezinta scaderea punctului de congelare (Tco - temperatura de congelare a solventului pur, Tso -temperatura de congelare a solutiei)
ke - reprezinta constanta crioscopica iar m- molalitatea solvatului
In situatia in care concentratia solutiei este asfel incat solutia este saturata la punctul de congelare, atunci la scaderea temperaturii cristalizeaza atat solventul cat si solvatul. Amestecul de solide astfel format se numeste eutectic.
D) Osmoza. Daca facem urmatorul experiment: cufundam un tub prevazut cu membrana semipermeabila (ce lasa sa treaca moleculele apei dar nu si pe cele ale solutului) ce contine o solutie apoasa de proteina (solvat) intr-un vas ce contine apa pura. Dupa cateva zeci de ore se observa ca nivelul apei din tubul ce contine solutia a crescut. Asupra membranei se exercita o presiune ce tinde sa egalizeze concentratiile celor doua lichide de o parte si de alta a membranei semipermeabile. Fenomenul este cunoscut sub numele de osmoza (Figura 50).
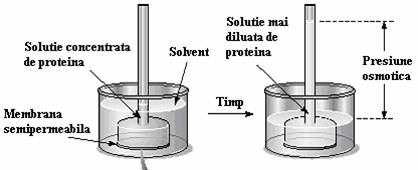
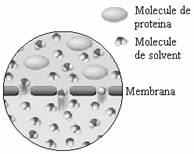
Figura 50. (a,b)Experiment ce pune in evidenta fenomenul osmozei
(c) detaliu microscopic al membranei de dializa
Presiunea care, aplicata unei solutii, contrabalanseaza cu putin tendinta solventului de a patrunde in ea printr-o membrana semipermeabila se numeste presiune osmotica. Aceasta presiune nu trebuie neaparat sa fie aplicata cu un piston, rolul pistonului il poate juca presiunea hidrostatica a coloanei de apa. Daca solutiile din cele doua parti ale membranei sunt identice ca si concentratie, atunci nu apare nici o presiune si solutiile se numesc izotonice (adica au aceeasi presiune osmotica).
Presiunea osmotica a unei solutii este aproximativ egala cu presiunea pe care solvatul ar exercita-o daca el s-ar afla sub forma de gaz care care ocupa acelasi volum ca solventul la aceiasi temperatura
πc = MRT
unde : p este presiunea osmotica, in N m-2;
c-concentratia, in mol m-3
R - constanta universala a gazelor
T - temperatura termodinamica, in K.
Aceasta ecuatie a fost formulata de catre van'Hoff si este similara cu ecuatia generala de stare a gazelor ideale.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |