
Am fost de acord deja ca lucrul, energia potentiala, energia cinetica si caldura reprezinta toate forme ale energiei. Istoric vorbind, nu intotdeauna caldura a fost acceptata ca reprezentand o forma a energiei dar incepand cu experimentarile contelui Rumford continuate ulterior de Joule, a devenit din ce in ce mai clar ca ea, caldura, reprezinta doar o alta forma de manifestare a energiei.
Sa ne reamintim de asemenea ca am definit energia interna, U, drept energia totala a unui sistem. Cu toate ca din punct de vedere al termodinamicii existenta atomilor sau moleculelor nu prezinta vreo importanta, putem spune ca energia totala a unui sistem este determinata de suma energiilor potentiale si cinetice ale tuturor particulelor care definesc sistemul. Aceasta afirmatie este in afara domeniului termodinamicii, dar ne este deosebit de utila pentru a primi o "simtire" intuitiva a ce reprezinta de fapt energia interna.
Sa ne mai reamintim ca energiile sunt intotdeauna masurate relativ la o referinta sau energie de origine. Originea, punctul de r3eferinta, nu are relevanta in cazul termodinamicii deoarece vom determina intotdeauna doar modificari ale valorii lui U si nu valoarea absoluta a lui U. Adica noi vom calcula
![]() .
(1)
.
(1)
sau cu alte cuvinte aceasta ecuatie stipuleaza ca 'modificarea energiei interne este egala cu energia interna finala minus energia interna initiala '. Aceasta ecuatie mai ne aduce aminte ca U este o 'functie de stare". Adica, modificarea lui U nu depinde de cum are loc modificarea (sau cu alte cuvinte de calea urmata) ci doar de starile initiala respectiv finala a sistemului.
Prima lege a termodinamicii este de fapt o ecuatie care pentru modificari finite poate fi scrisa
![]() .
(2)
.
(2)
Ecuatia (2) ne spune altceva, de o deosebita importanta. Stim ca U este o functie de stare si ca ΔU este independent de calea urmata. Totusi w nu este o functie de stare astfel incat w depinde de calea urmata de modificare. In afara de acesta suma lui w cu q este independenta de calea urmata. Singurul mod in care aceasta se poate intampla este daca q este de asemenea dependenta de cale! Dupa cum observam avem de a face cu doua entitati dependente de calea urmata de transformare a sistemului q si w.
Pentru o modificare diferentiala forma primei legi este
![]() . (3)
. (3)
valoarea lui w in ecuatia (2) sau a lui dw in ecuatia (3) include toate tipurile de lucru efectuat, expansiuni sau contractii, electric, cel depus cu marirea suprafetei, etc. In termodinamica majoritatea lucrului considerat este cel cu privire la contractie si expansiune al unui sistem, sau lucrul pV. Expresia pentru acest lucru este
![]() .
(4)
.
(4)
Daca dorim sa includem atat lucrul pV cat si alte tipuri de lucru vom putea exprima legea intai a termodinamicii prin expresia:
![]() . (5)
. (5)
Hai sa ne convingem ca ce se intampla daca se depune doar lucru pV . In acest caz legea I a termodinamicii poate fi exprimata ca:
![]() .
(6)
.
(6)
Daca admitem ca U sa fie o functie de T si V, atunci U = U(T,V). In cazul derivatei dU putem scrie,
![]() . (7)
. (7)
Pentru un proces care are loc la volum constant (dV = 0) ecuatiile (6) si (7) devin,
![]() (8)
(8)
si
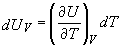 . (9)
. (9)
Dupa cum ne reamintim din discutia privind caldura si capacitatea calorica, caldura diferentiala la volum constant poate fi scrisa ca,
![]() (10)
(10)
astfel incat,
![]() .
(11)
.
(11)
Daca comparam ecuatiile (9) si (11), si recunoastem ca are loc aceeasi modificare a dUV vom vedea ca:
![]() .
(12)
.
(12)
Vom remarca ecuatia (12) drept definitia formala a capacitatii calorice la volum constant. Aceasta este mult mai satisfacatoare decat cea anterioara:
![]() .
(13)
.
(13)
Ecuatia (12) este o definitie mai buna a capacitatii calorice deoarece de obicei este mult mai usor sa definesti cantitati termodinamice in termenii variabilelor de stare precum U, T, V, p, etc., decat sa ne referim la faptul ca entitati precum q si w care depind de calea urmata de procesul de schimb.
Sau, ca alt argument, putem integra ecuatia (8) la volum constant pentru a obtine:
![]() .
(14)
.
(14)
Aceasta exprimata in cuvinte ar suna cam asa: pentru orice proces la volum constant caldura, q, este identica cu modificarea energiei interne, ΔU.
Se pare ca volumul V nu este cea mai convenabila variabila pentru lucru ori pentru constanta. Este mult mai usor de controlat presiunea p a unui sistem decat sa controlam sistemul prin volumul sau, in special in cazul lichidelor si solidelor. Ceea ce este necesar este cautarea unei functii noi, cu unitati energetice, care contine toate informatiile referitoare la energia interna, dar care sa poata fi controlate prin intermediul presiunii. O astfel de functie poate fi definita (creata) utilizand o transformata Legendre. Exista criterii speciale care trebuiesc indeplinite atunci cand se efectueaza o transformare Legrange, care din fericire in cazul nostru acestea sunt definite (nu este in scopul nostru de a face o discutie asupra proprietatilor matematice ale transformatei Legrange!) In cazul nostru vom defini o noua cantitate, H, denumita entalpie, care are ca unitate de masura unitati energetice, dupa cum se observa mai jos,
![]() .
(15)
.
(15)
putem arata ca H este o functie naturala a p (in acelasi sens in care U este o functie naturala a V), dupa cum urmeaza,
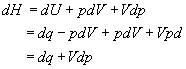 .
(16 a, b, c)
.
(16 a, b, c)
Una din marile beneficii ale entalpiei este cea ca ea permite utilizarea unei functii de stare, H, pentru a descrie caldura implicata in procese ce se desfasoara la presiune constanta mai degraba decat caldura, q, care nu este o functie de stare.
Pentru a exemplifica aceasta sa refacem pentru acelasi proces, discutat anterior in cazul dU, pentru dH. Fie H o functie de T si p. Putem acum scrie,
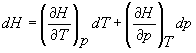 .
(17)
.
(17)
Consideram un proces la presiune constanta (dp = 0). Din ecuatia (16c) rezulta ca:
![]() (18)
(18)
si din ecuatia (17) avem:
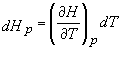 (19)
(19)
Stim, din discutia asupra privind caldura si capacitatea calorica, ca caldura diferentiala la presiune constanta poate fi de asemenea scrisa ca:
![]() (20)
(20)
astfel incat,
![]() (21)
(21)
Comparand ecuatiile (19) si (21), dar si recunoscand ca modificarea dHp este aceeasi in ambele cazuri, putem concluziona:
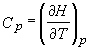 .
(22)
.
(22)
Putem privi ecuatia (22) ca definitie termodinamica formala a capacitatii calorice la presiune constanta. Aceasta definitie este mult mai satisfacatoare ca cea precedenta:
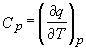 ,
(23)
,
(23)
deoarece ea defineste capacitatea calorica in termenii unei functii de stare, H, fata de cea exprimata in termenii q care nu este o functie de stare.
Daca vom integra acum ecuatia (8), putem integra ecuatia (21), la presiune constanta, pentru a obtine,
![]() (24)
(24)
Adica, exprimata in cuvinte, pentru orice proces la presiune constanta caldura, q, este aceeasi ca si modificarea entalpiei, ΔH. Aceasta ecuatie nu contine aproximari. Ea este valabila pentru toate procesele care se desfasoara a presiune constanta. Ecuatia (24) este efectiv mult mai eficienta decat echivalenta pentru volum constant deoarece noi efectuam reactiile noastre chimice mai degraba la presiune constanta decat la volum constant.
Oamenii se intreba deseori: 'care este semnificatia lui H?' Din pacate, raspunsul nu este de loc o descrie fizica simpla, intuitiva pentru entalpie precum este cea pentru energia interna (adica, energia interna reprezinta suma tuturor energiilor cinetice si potentiale ale tuturor particulelor aflate in sistem!). Cel mai apropiata descriere pe care o putem face pentru H este cea anterioara , unde ΔH este caldura (castigata sau pierduta) intr-un proces la presiune constanta. Din acest motiv entalpia este uneori numita drept "continutul de caldura".
Sa nu uitam ca la formularile initiale ale termodinamicii energia nucleului nu era inca recunoscuta si implicit cunoscuta. Astazi stim ca materia poate fi convertita in energie si viceversa. "Echivalentul energetic al materiei" este dat de faimoasa formulare a lui Einstein, E = mc , unde m este masa materiei si c viteza luminii. Deoarece viteza luminii are o valoare foarte mare, circa 3 x 10 m/s, chiar si o cantitate mica de masa este echivalenta unei cantitati foarte mari de energie. Strict vorbind afirmatia, 'energia se conserva' ar trebui sa fie inlocuita cu afirmatia 'energia plus energia echivalenta masei se conserva!' Adica, energia + mc se conserva. Conversia masei in energie sau a energiei in masa in reactiile chimice este asa de mica incat practic trece neobservata in problemele de chimie. In consecinta, pentru termodinamica chimica, simplu postulat ca energia se conserva este suficient.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |