PRIMUL PRINCIPIU AL TERMODINAMICII
Primul principiu al termodinamicii reprezinta aplicarea legii generale a conservarii energiei pentru procesele termice.
Ca data a stabilirii primului principiu al termodinamicii se considera anul 1842, cand Robert Mayer a enuntat echivalenta caldurii si a lucrului mecanic. In 1843 James Joule confirma experimental rezultatele lui Robert Mayer, utilizand aparatul din fig. 1.9; lucrul mecanic produs de caderea greutatii (1) pe distanta (h) este transformat in caldura prin frecare de catre agitatorul cu palete (4), care se roteste in interiorul vasului calorimetric (3), in care se gaseste apa. Experienta a aratat ca pentru un lucru mecanic de 1 kgf m se obtine o cantitate de caldura de 1/424,9 kcal (altfel zis, 1 kcal este echivalenta cu 424,9 kgf m).
|
|
Fig. 1.9 - Determinarea echivalentului caloric al lucrului mecanic 1-greutate; 2-termometru; 3-vas calorimetric; 4-agitator. |
Daca atat caldura cat si lucrul mecanic se exprima in Joule, experienta arata ca un lucru mecanic de 1J este echivalent cu o cantitate de caldura de 1J.
Aceasta formulare a primului principiu este cunoscuta sub denumirea de principiul echivalentei, fiind exprimata matematic de relatia (scrisa pentru unitatile de masura din S.I.):
Q = L sau Q-L=0.
In aceasta forma, primul principiu poate fi enuntat astfel: caldura poate fi produsa din lucru mecanic si se poate transforma in lucru mecanic, totdeauna in acelasi raport de echivalenta.
Aceasta forma a primului principiu al termodinamicii este valabila pentru transformari inchise (ciclice), in care sistemul revine la starea initiala (prin cedare de caldura catre mediul inconjutor, apa revine la temperatura initiala).
Fie un sistem ce evolueaza de la starea (1) la starea (2) - fig. 1.10 - fie pe calea (A), fie pe calea (B); pentru a transforma procesul deschis (1) (2) intr-unul ciclic, presupunem ca sistemul revine la starea initiala pe calea (C).
|
|
Fig. 1.10 - Schema deducerea primului principiu pentru transformari deschise |
Pentru cele doua transformari ciclice putem aplica principiul echivalentei dintre caldura si lucru mecanic:
Din cele doua relatii rezulta:
Q1A2 - L1A2 = Q1B2 - L1B2 = L2C1 - Q2C1,
sau
Q12 - L12 = ct. = DEtot,
unde DEtot reprezinta variatia totala de energie. Energia totala poate fi scrisa sub forma:
Etot = U + Ec +Ep,
in care U este energia interna a fluidului, datorata miscarii particulelor care il compun, Ec este energia cinetica, iar Ep este energia potentiala.
Neglijand variatia de energie cinetica si potentiala, rezulta:
Q12 - L12 = DU,
sau
Q - L = DU.
Se observa ca daca transformarea este ciclica (starea finala coincide cu cea initiala), DU = 0 si obtinem Q - L = 0.
Folosind marimile specifice, rezulta:
q - l = Du,
iar pentru procese infinitezimale:
dq = dl + du,
sau
dq = p dv + du,
pentru procese reversibile.
Energia interna U este un parametru de stare; prin conventie, la 00C si 760 mm Hg energia interna se considera a fi nula.
Pentru un proces izocor dv = 0 si rezulta:
dq = du
sau
q12 = Du,
deci putem spune ca energia interna reprezinta energia schimbata sub forma de caldura intr-un proces izocor.
Aceasta forma a primului principiu al termodinamicii se aplica sistemelor care schimba substanta cu mediul exterior.
Sa presupunem o masina termica* prin care circula un fluid, acesta intrand in masina prin sectiunea (1, fig. 1.11) si iesind prin sectiunea (2). Masina primeste cantitatea de caldura q12 si produce lucrul mecanic tehnic lt12.
|
|
Fig. 1.11 - Aplicarea primului principiu al termodinamicii pentru sisteme deschise |
Din ecuatia de conservare a energiei rezulta:
![]()
in care produsul p v reprezinta lucrul mecanic de deplasare, iar c1 si c2 sunt vitezele fluidului in sectiunile respective.
Presupunem c1 c2 si h1 h2si obtinem:
![]()
sau
![]()
in care u + p v = i reprezinta entalpia.
Relatia se poate scrie si sub forma:
![]()
sau, pentru procese infinitezimale:
![]()
Din relatia de definitie a entalpiei i = u + p v rezulta:
![]()
si pentru ca dq = p dv + du obtinem:
![]()
Ca urmare lucrul mecanic tehnic va fi dat de relatia:
![]()
Se observa ca daca dp =
0 (proces izobar), rezulta dq = di, deci entalpia este caldura schimbata intr-o
transformare ce are loc la presiune
Etalpia este de asemenea un parametru de stare; prin conventie, la 00C si 760 mm Hg entalpia se considera a fi nula.
Pentru gaze perfecte, energia interna si entalpia se determina cu relatiile:
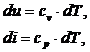 sau
sau 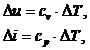
unde
cv este caldura specifica la volum constant, iar cp este
caldura specifica la presiune
Am vazut anterior ca:
dq = p dv + du,
![]()
de unde obtinem:
![]()
Din ecuatia termica de stare a
gazului perfect ![]() rezulta:
rezulta:
![]()
si tinand cont ca:
![]()
obtinem in final:
![]()
Cum cp/cv = k (exponent adiabatic), rezulta:
![]() si
si ![]() .
.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |