
STUDIUL SPECTRELOR DE EMISIE A ELEMENTELOR CU AJUTORUL SPECTROSCOPULUI
VERIFICAREA LEGII LUI BALMER
Scopul lucrarii. In
cadrul acestei lucrari se vor determina lungimile de unda ale
liniilor spectrale din seria Balmer a hidrogenului (![]() ) iar apoi se vor compara acestea cu lungimile de unda
calculate teoretic cu relatia:
) iar apoi se vor compara acestea cu lungimile de unda
calculate teoretic cu relatia:
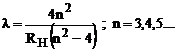 (1)
(1)
cu R![]() = 109677,58 cm
= 109677,58 cm![]() constanta lui Rydberg pentru hidrogen.
constanta lui Rydberg pentru hidrogen.
Conform teoriei cuantice a atomului (fundamentata de Niels Bohr, Louis de Broglie, Werner Heisenberg, etc.) electronii optici (de valenta) se afla in atom numai in anumite stari, numite stari stationare.
Prin absorbtie de energie (excitare) electronii trec dintr-o stare stationara cu energie mai mica intr-o stare stationara cu energie mai mare.
Revenirea se
face prin cedarea acestei energii, deci prin emiterea de cuante de energie de
marime h![]() , (unde h este constanta lui Planck, iar
, (unde h este constanta lui Planck, iar ![]() frecventa
radiatiei emise). Radiatia emisa apare in campul vizual al unui
spectroscop sub forma de linii.
frecventa
radiatiei emise). Radiatia emisa apare in campul vizual al unui
spectroscop sub forma de linii.
Efectuand observatii asupra spectrului vizibil al hidrogenului Johann Balmer a constatat ca dispunerea liniilor spectrale pe scala spectroscopului nu este intamplatoare. Numerele de unda ale acestor linii respecta relatia :
N = ![]() = Z
= Z![]() R
R ![]()
![]() -
- ![]()
![]() (2)
(2)
in care R = ![]() este constanta lui
Rydberg.
este constanta lui
Rydberg.
Pentru hidrogen R![]() = 109677,58 cm
= 109677,58 cm![]() ;
;
Z = sarcina nucleului (numarul de protoni); Z = 1 .
m = masa electronului;
e = sarcina electronului;
h = constanta lui Planck;
c = viteza luminii in vid (c = 3·108 m/s);
n = 3,4,5. = numar cuantic principal;
![]() = lungimea de
unda corespunzatoare liniei spectrale.
= lungimea de
unda corespunzatoare liniei spectrale.
Mai tarziu s-au descoperit si alte serii spectrale in spectrul hidrogenului, prezentate complet in figura 1, iar relatia (1) a fost generalizata sub forma :
N = ![]() =
= ![]() (3)
(3)
unde : k = l si n = 2,3,4, ....... Seria Lyman
k = 2 si n = 3,4,5, ...... Seria Balmer
k = 3 si n = 4,5,6, ...... Seria Paschen
k = 4 si n = 5,6,7, ...... Seria Brackett
k = 5 si n = 6,7,8, ...... Seria Pfundt
k = 6 si n = 7,8,9, ......Seria Humphreys.
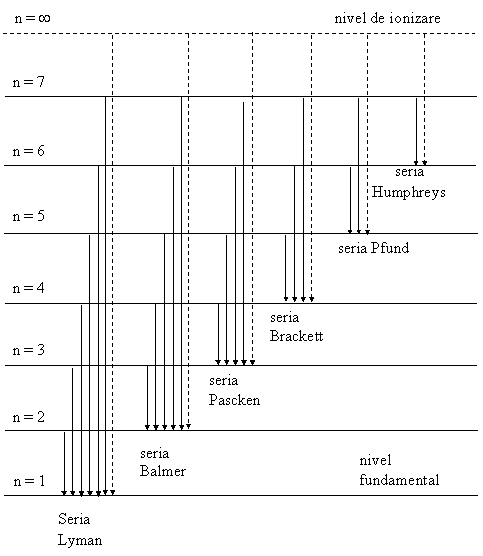
Fig. 1 Seriile spectrale ale hidrogenului
Pentru heliu Z = 2, iar relatia (2) devine :
N = ![]() = 4R
= 4R![]()
![]() (4)
(4)
In domeniul vizibil se pot observa doar liniile spectrale ale seriei corespunzatoare lui k = 4 si n = 5,6,7,.. pentru care numerele de unda respecta relatia :
![]() n = 5,6,7,.. (5)
n = 5,6,7,.. (5)
unde R![]() = 109722,27 cm
= 109722,27 cm![]() este constanta lui Rydberg pentru heliu.
este constanta lui Rydberg pentru heliu.
Lungimea de unda a liniilor spectrale va fi :
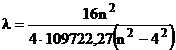 (cm) (6)
(cm) (6)
Pentru elemente cu numar mai mare de electroni, teoria dezvoltata nu mai este valabila, iar relatia (2) nu mai poate fi corect aplicata.
b. Descrierea instalatiei
Pentru efectuarea lucrarii vom folosi instalatia redata schematic in fig.3 - lucrarea Studiul dispersiei luminii; trasarea curbei de dispersie a unui spectroscop, formata dintr-o parte electrica si una optica.
Partea electrica este utilizata pentru excitarea atomilor de hidrogen, heliu, neon, argon, etc. utilizand procedeul descarcarii in gaze.
Impulsurile de tensiune se aplica electrozilor tuburilor de descarcari fixate pe suport. Datorita acestor impulsuri in tuburi apare fenomenul de descarcare, transformand tubul intr-o sursa luminoasa. Energia luminoasa radiata este tocmai energia eliberata in urma dezexcitarii atomilor.
Atentie ! In timpul schimbarii tuburilor, generatorul trebuie oprit, pentru evitarea electrocutarii.
Partea optica a instalatiei ilustrata in fig.2 - lucrarea Studiul dispersiei luminii; trasarea curbei de dispersie a unui spectroscop, este utilizata pentru analizarea luminii date de sursa luminoasa sub forma de spectru.
Lumina descompusa sub forma de spectru de catre prisma apare in ocularul "L" suprapusa peste scala de masura, sub forma indicata in fig. 4
lucrarea Studiul dispersiei luminii; trasarea curbei de dispersie a unui spectroscop.
c. Modul de lucru
Pentru etalonarea spectroscopului se folosesc tuburile de descarcare cu Hg si Ar, pentru. care se cunosc lungimile de unda ale liniilor spectrale.
1. Se aprinde lampa cu vapori de mercur(Hg).
2. Se aseaza spectroscopul cu fanta de intrare foarte putin deschisa la circa 1-5 cm de lampa de Hg si se regleaza ocularul spectroscopului pana se obtine o lungime clara a spectrului.
3. Se inchide fanta de intrare pana cand se obtin linii spectrale cat mai subtiri posibil in asa fel ca ele sa fie clar vizibile.
4. Se aprinde lampa de iluminat si se departeaza in asa fel, incat scala sa fie slab luminata pentru a nu estompa liniile spectrale.
5. Se indentifica si se noteaza dimensiunile corespunzatoare liniilor spectrale ale Hg din tabelul 1.
6. Se schimba lampa de Hg sau tubul cu vapori de Hg cu tubul de vapori de Ar dupa ce in prealabil s-a stins lampa de Hg sau generatorul de impulsuri.
7. Se indentifica si se noteaza apoi diviziunile corespunzatoare liniilor spectrale de Ar din tabelul 1.
Fara a face vreo
modificare la instalatie, se inlocuieste tubul de vapori de Ar cu
tubul cu vapori de H![]() si se noteaza diviziunile corespunzatoare
liniilor spectrale ale H
si se noteaza diviziunile corespunzatoare
liniilor spectrale ale H![]() in tabelul 2, indicandu-se pentru fiecare linie culoarea
si observatii privind intensitatea ei.
in tabelul 2, indicandu-se pentru fiecare linie culoarea
si observatii privind intensitatea ei.
d. Prezentarea rezultatelor
Rezultatele etalonarii spectroscopului cu (Hg, Ar, si Na) se trec in tabelul I.
Tab. I.
|
element |
diviziune |
culoare |
lungime de unda |
Observatii |
|
Hg |
galben |
contopite |
||
|
verde-galben |
linia reper |
|||
|
albastru |
iluminare mica |
|||
|
indigo |
2 linii contopite |
|||
|
violet |
2 linii contopite |
|||
|
Ar |
rosu |
prima linie;cap de serie |
||
|
verde |
iluminare mica |
|||
|
Na |
galben |
linie reper |
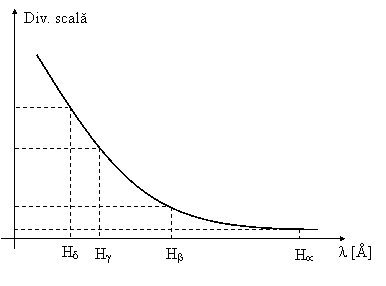
Utilizand datele din tabelul I completat, se traseaza pe hartie milimetrica curba de etalonare a spectroscopului λ = f (diviziuni scala ), ca in figura 2.
In tabelul II se vor trece diviziunile la care au fost observate liniile spectrale ale H2. Din curba de etalonare se vor citi lungimile de unda corespunzatoare acestora. Tot in acest tabel vor fi trecute lungimile de unda teoretice ale liniilor spectrale ale H2 din domeniul vizibil, calculate cu ajutorul relatiei (1), in dreptul liniei corespunzatoare determinata experimental.
Tab.II.
|
Experimental |
Teoretic |
||||
|
Obs |
Culoare |
Diviziunea |
n | ||
|
div | |||||
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |