Fizica cuantica
Inventia dispozitivelor semiconductoare a constituit cu siguranta o noua revolutie industriala. Aceste dispozitive au facut posibila miniaturizarea aparatelor electronice, incluzand calculatoarele personale, dezvoltarea echipamentelor medicale de diagnoza si tratament, aparitia dispozitivelor de telecomunicatii moderne si multe altele.
Dar in spatele acestor realizari remarcabile se afla o alta revolutie a stiintei in general: fizica cuantica. Fara aceasta noua intelegere a lumii, dezvoltarea dispozitivelor semiconductoare nu ar fi fost posibila. Fizica cuantica este insa un domeniu al stiintei extrem de complicat, iar acest capitol reprezinta doar o mica introducere. Fara o intelegere de baza a fizicii cuantice, sau cel putin o intelegere a descoperirilor stiintifice ce au dus la formularea acesteia, este imposibila intelegerea functionarii dispozitivelor electronice semiconductoare. Majoritatea textelor de electronica incearca sa explice semiconductorii cu ajutorul fizicii "clasice", lucru ce duce la o confuzie si mai mare, nu la intelegerea subiectului.
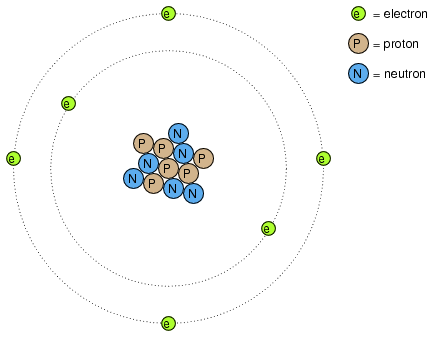
Majoritatea dintre noi am vazut modele ale atomului care arata aproximativ precum in figura alaturata (vezi subiectul discutat in volumul I).
Acesta este cunoscut sub numele de "modelul lui Rutherford". Centrul atomului este format din particule de materie minuscule denumite protoni si neutroni; electronii orbiteaza in jurul nucleului precum planatele in jurul Soarelui. Nucleul prezinta o sarcina electrica pozitiva datorita prezentei protonilor, neutronii neavand sarcina electrica, iar electronii ce orbiteaza in jurul nucleului poarta o sarcina negativa, intreg ansamblul fiind astfel echilibrat din punct de vedere al sarcinilor electrice. Electronii sunt atrasi de protoni la fel cum planetele sunt atrase prin intermediul gravitatiei de Soare, dar orbitele sunt stabile datorita miscarii electronilor. Acest model extrem de popular al atomului a fost prezentat pentru prima data de Ernest Rutherford, ce a determinat pe cale experimentala, in jurul anului 1911, ca sarcinile pozitive ale atomului sunt concentrate intr-un nucleu dens si de dimensiuni reduse, in contradictie cu modelul propus de J.J. Thompson, care sustinea ca aceste sarcini sunt distribuite egal in interiorul atomului.
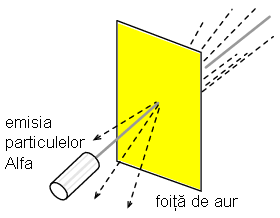
Acest experiment a presupus bombardarea unei folii subtiri de aur cu particule Alfa, incarcate pozitiv. Rezultatele au fost neasteptate. O mica parte din particule au fost deviate la unghiuri foarte mari. Cateva dintre particulele Alfa au fost deviate inapoi, la aproape 180o, dar majoritatea particulelor au trecut pur si simplu prin folia de aur nedeviate, indicand faptul ca cea mai mare parte a foliei era compusa din aer. Faptul ca o mica parte a particulelor Alfa au fost deviate la unghiuri foarte mari nu se putea explica decat prin prezenta unui nucleu minuscul, incarcat cu sarcina pozitiva.
Cu toate ca acest model al atomului era mai precis decat cel al lui Thompson, totusi, nici acesta nu era perfect. Au fost intreprinse, prin urmare, noi experimente pentru determinarea structurii atomice corecte, iar aceste eforturi au dus la descoperirile bizare al fizicii cuantice. Astazi, modelul atomului, asa cum este el inteles cel putin, este destul de complex.
Totusi, comparatia atomului "lui Rutherford" cu sistemul solar continua sa domine chiar si in mediile academice.
De exemplu, urmatoarea descriere este luata dintr-o carte de electronica:
Electronii negativi ce orbiteaza in jurul nucleului pozitiv sunt atrasi de acesta, ceea ce ne face sa ne intrebam: de ce electronii nu cad pe nucleul atomului? Raspunsul este ca electronii raman pe orbitele lor stabile datorita existentei celor doua forte egale si de sens contrar: forta centrifuga exercitata asupra electronilor aflati in miscare pe orbite ce anuleaza forta centripeta ce atrage electronii spre nucleu datorita sarcinilor opuse.
Urmand modelul lui Rutherford, autorul considera electronii ca fiind bucati solide de materie ce se deplaseaza pe orbite circulare, atractia fata de nucleul incarcat cu o sarcina de semn contrar fiind balansata de miscarea lor. Referirea la "forta centrifuga" nu este corecta din punct de vedere tehnic (nici chiar pentru planete), dar este usor de trecut cu vedere datorita popularitatii ei. In realitate, nu exista nicio forta care sa impinga un corp, orice corp, departe de centrul orbitei acestuia. "Iluzia" este data de faptul ca un corp ce are inertie tinde sa se deplaseze in linie dreapta, iar din moment ce o orbita este o deviatie (acceleratie) a deplasarii in linie drepta, exista tot timpul o opozitie fata de forta de atractia a corpului spre centrul orbitei, fie ca este forta gravitationala, atractie electrostatica, sau orice alta forta.
Insa, adevarata problema a acestei explicatii este idea ca orbitele electronilor sunt circulare. Faptul ca sarcinile electrice accelerate emit radiatie electromagnetica se stie inca de pe vremea lui Rutherford, iar acest lucru se poate dovedi pe cale experimentala. Din moment ce miscarea orbitala este o forma de acceleratie (corpul ce orbiteaza este intr-o acceleratie constanta fata de miscarea normala, liniara), electronii aflati in stare de orbitare ar trebui sa "arunce" radiatie precum o roata aflata in noroi. Daca electronii ar pierde energie in acest mod, acestia s-ar apropia din ce in ce mai mult de nucleu, rezultatul fiind o coliziune cu nucleul pozitiv. Totusi, acest lucru nu se intampla in general in atomi. Intr-adevar, orbitele electronilor sunt extrem de stabile.
Mai mult decat atat, experimentele cu atomi "excitati" au demonstrat ca energia electromagnetica emisa de un atom poseda doar anumite frecvente specifice. Atomii excitati de influente externe, precum lumina, absorb aceasta energie si emit unde electromagnetice de frecvente specifice. Cand energia emisa de un atom este descompusa in frecventele sale (culori) cu ajutorul unei prisme, spectrul culorilor este compus din linii distincte, acestea fiind unice elementului respectiv. Acest fenomen este in general folosit pentru identificarea elementelor atomice, si chiar si pentru determinarea proportiilor fiecarui element dintr-o compozitie chimica. Conform modelului lui Rutherford si a legilor fizicii clasice, domeniul frecventelor acestor atomi excitati ar trebui sa fie practic nelimitat. Cu alte cuvinte, daca modelul lui Rutherford ar fi fost corect, spectrul luminii emise de oricare atom ar aparea ca o banda continua de culori si nu doar sub forma catorva linii distincte.
Niels Bohr a incercat sa imbunatateasca modelului lui Rutherford dupa ce a studiat o perioada de cateva luni in laboratorul acestuia in 1912. Incercand sa armonizeze si descoperirile celorlalti fizicieni, precum Max Plank si Albert Einstein, Bohr a sugerat ca fiecare electron poseda o anumita energie specifica, iar orbitele lor sunt cuantificate, astfel ca fiecare dintre electroni poate ocupa doar anumite locuri in jurul nucleului. Pentru a scapa de implicatiile miscarii electronilor datorita legilor electromagnetismului si a particulelor accelerate, Bohr a considerat aceste orbite (orbitali) ca fiind stationare.
Cu toate ca incercarea lui Bohr de reconstruire a structurii atomului in termeni cat mai apropiati de rezultatele experimentale, a constituit un pas foarte important pentru fizica, acesta nu a fost totusi complet. Analizele sale matematice au condus la predictii mult mai bune a evenimentelor experimentale decat modelele precedente ale atomului, dar cateva intrebari despre modul ciudat al comportamentului electronilor inca nu isi gasisera raspunsul. Sustinerea faptului ca electronii existau in stari stationare si cuantificate in jurul nucleului era un pas inainte, dar motivul pentru care electronii se comportau astfel nu era inca cunoscut. Raspunsul acestor intrebari avea sa-l dea un alt fizician, Louis de Broglie, cu aproximativ zece ani mai tarziu.
De Broglie a propus ca electronii, precum fotonii (particule de lumina), manifesta atat proprietati ale particulelor cat si proprietati ale undelor. Bazandu-se pe aceasta interpretare, acesta a sugerata ca o analiza a orbitalilor electronilor din punct de vedere al undelor si nu al particulelor, ar raspunde mai multor intrebari legate de natura lor. Intr-adevar, acesta a reprezentat un nou pas in dezvoltarea unui model al atomului.
Ipoteza lui de Broglie a facut posibila introducerea suportului matematic si analogiilor fizice pentru starile cuantificate ale electronilor dintr-un atom, dar nici modelul acestuia nu era complet. In decurs de cativa ani insa, fizicienii Werner Heisenberg si Erwin Schrödinger, fiecare lucrand individual, au creat un model matematic mult mai riguros pentru particulele subatomice, plecand de la conceptul dualitatii unda-particula a lui de Broglie.
Avansul teoretic de la modelul stationar al undei propus de de Broglie la modelul matricial al lui Heisenberg la ecuatiile diferentiale ale lui Schrödinger, este cunoscut sub numele de mecanica cuantica si introduce o caracteristica aparent socanta a lumii particulelor subatomice, si anume probabilitatea sau incertitudinea. Conform teoriei mecanicii cuantice, pozitia exacta si momentul exact al particulelor sunt imposibil de determinat in acelasi timp. Explicatia acestui "principiu al incertitudinii" consta intr-o eroare de masura cauzata de obicei de procesul de masurare, si anume, prin incercarea de masurare exacta a pozitiei unui electron, are loc o interferenta cu momentul acestuia si prin urmare nu putem stii care a fost momentul acestuia inainte de efectuarea masuratorii, si invers. Implicatia surprinzatoare a mecanicii cuantice este ca particulele nu au de fapt o pozitie si un moment precis, ci aceste doua cantitati sunt echilibrate astfel incat incertitudinea lor combinata nu scade niciodata sub o anumita valoare minima.
Valoarea minima a incertitudinii pozitiei si momentului unei particule, exprimata de Heisenberg si Schrödinger, nu are nimic de a face cu aparatele de masura "neperformante", ci este o proprietate intrinseca a dualitatii unda-particula. Prin urmare, electronii nu exista in orbitele lor ca si "bucati" de materie precis delimitate, si nici macar sub forma de unde bine delimitate, ci sub forma de nori cu o distributie de probabilitati, ca si cum fiecare electron ar fi "imprastiat" pe o suprafata mare de pozitii si momente.
Pozitia radicala conform careia, electronii existau sub forma de nori, parea sa vina in contradictie cu principiile originale ale starilor cuantificate ale electronilor: faptul ca electronii exista sub forma "orbitelor" discrete si bine definite in jurul nucleului atomului. Aceasta din urma explicatie a fost cea care a constituit, pana la urma, punctul de plecare al mecanicii cuantice. Totusi, comportamentul "cuantic" al electronilor nu depinde de o anumita pozitie si moment, ci depinde de cu totul alta proprietate, numerele cuantice. Pe scurt, mecanica cuantica inlatura notiunile "clasice" de pozitie si moment absolut inlocuindu-le pe acestea cu notiuni ce nu au nicio analogie in viata reala.
Cu toate ca electronii exista sub forma de "nori" cu probabilitati distribuite si nu sub forma de materie discreta, acesti nori au unele caracteristicei ce sunt discrete. Oricare electron dintr-un atom poate fi descris de patru numere cuantice, si anume: numar cuantic principal, orbital, magnetic si de spin. Toate aceste numere luate impreuna determina starea unui electron la un moment dat.
Simbolizat prin litera "n", acest numar descrie stratul pe care se afla un electron. Invelisul electronic este un spatiu din jurul nucleului atomului, format din straturi, ce determina pozitiile in care electronii pot exista. Electronii se pot deplasa de pe un strat pe altul, dar nu pot exista in regiunile dintre straturi.
Numarul cuantic principal al electronului este un numar intreg pozitiv (1, 2, 3, 4). astfel, fiecare electron poate exista pe unul dintre aceste straturi, in functia de componenta atomului. Aceste valori nu au fost alese arbitrar, ci ca urmare a experimentelor cu spectre de lumina: diferitele frecvente ale luminii emise de atomii de hidrogen excitati, urmeaza o secventa matematica ce depinde de anumite valori intregi.
Fiecare strat poate sustine mai multi electroni. O analogie a acestei asezari poate fi imaginata daca luam in considerare un amfiteatru. Fiecare persoana trebuie sa aleaga un rand in care sa se aseze (nu se poate aseza intre randuri); la fel, fiecare electron trebuie sa "aleaga" un anumit strat in care sa se "aseze". Ca si in cazul amfiteatrelor, stratul exterior poate sustine mai multi electroni decat stratul interior, din apropierea nucleului. De asemenea, electronii tind sa se "aseze" pe cel mai de jos strat disponibil, la fel cum intr-un amfiteatru, oamenii cauta sa se aseze cat mai aproape de scena (in primul rand). Cu cat numarul stratului (numarul cuantic principal, n) este mai mare, cu atat energia electronilor ce-l ocupa este mai mare.
Numarul maxim de electroni dintr-un strat este descris de urmatoarea ecuatie:
![]()
Astfel, primul strat (n=1) poate fi ocupat de doar 2 electroni, cel de al doilea strat (n=2) de 8 electroni, al treilea (n=3) de 18 electroni.
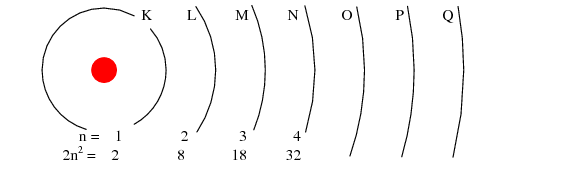
Straturile electronice (de la electron) ale unui atom au fost notate cu litere nu cu cifre. Primul strat (n=1) se noteaza cu litera K, al doilea (n=2) cu L, al treilea (n=3) cu M, al patrulea (n=4) cu M, al cincilea (n=5) cu O, al saselea (n=6) cu P si al saptelea (n=7) cu Q.
Fiecare strat este compus din substraturi. Substraturile sunt regiuni spatiale ce descriu locul in care pot exista "nori" electronici iar forma lor este diferita de la un substrat la altul.
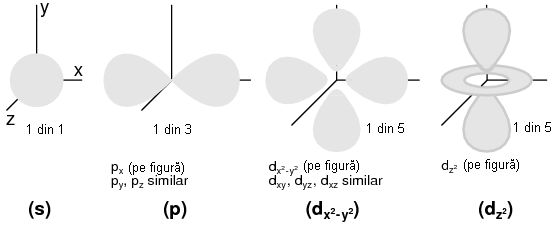
Primul substrat are forma unei sfere, daca il privim sub forma unui nor de electroni ce "inveleste" tridimensional nucleul atomic. Cel de al doilea substrat insa, este compus din doi "lobi" conectati impreuna intr-un singur punct in apropierea centrului atomului. Al treilea substrat este format dintr-un set de patru "lobi" aranjati in jurul nucleului.
Numarul orbital este un numar intreg, la fel ca si numarul principal, doar ca include si zero. Aceste numere sunt simbolizate prin intermediul literei l. Numarul substraturilor dintr-un strat este egal cu numarul cuantic orbital.
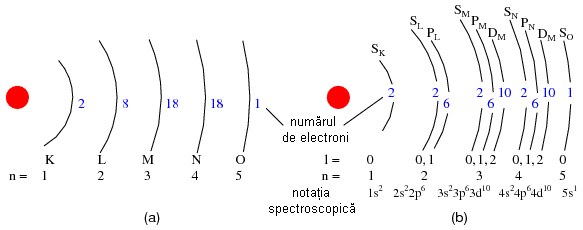
Astfel, primul strat (n=1) are un substrat, numerotat cu 0; al doilea strat (n=2) are doua substraturi, 0 si 1; al treilea strat (n=3) are trei substraturi, 0,1 si 2. O alta conventie, foarte des intalnita, este numerotarea substraturilor prin s (l=0), p (l=1), d (l=2) si f (l=3)
Numarul cuantic magnetic al unui electron determina orientarea formei substratului. "Lobii" substraturilor pot fi orientati in mai multe directii. Aceste orientarii diferite poarta numele de orbitali. Primul substrat (s; l=0) este o sfera fara posibilitatea de existenta a unei directii, prin urmare, in acest caz, avem doar un orbital. Pentru al doilea substrat (p; l=1) din fiecare strat, "lobii" acestora pot avea trei directii diferite.
Simbolul numarului magnetic este ml. Pentru a calcula numarul de orbitali din fiecare strat, utilizam urmatoarea formula:
![]()
De exemplu, primul substrat (l=0) al oricarui strat, contine un singur orbital, numerotat cu 0; al doilea substrat (l=1) al oricarui strat contine trei orbitali, -1, 0, 1; al treilea substrat (l=2) contine cinci orbitali, numerotati cu -2, -1, 0, 1 si 2; etc.
Proprietatea de "spin" a electronilor a fost descoperita pe cale experimentala. O observatie mai atenta a liniilor spectrale a reliefat faptul ca fiecare linie este de fapt o pereche de linii foarte apropiate una de cealalta, ipoteza fiind ca aceasta structura este rezultatul spin-ului fiecarui electron in jurul propriei sale axe. Atunci cand sunt excitati, electronii cu spin diferit vor emite energie sub frecvente diferite.
Numarul de spin este simbolizat prin ms. In fiecare orbital, din fiecare substrat al fiecarui strat, pot exista doi electroni, unul cu spin +1/2, iar celalalt cu spin -1/2.
Explicarea asezarii electronilor in atom cu ajutorul acestor numere cuantice poarta numele de principiul de excluziune al lui Pauli. Acest principiu spune ca, in acelasi atom, nu pot exista doi electroni care sa ocupe exact aceleasi stari cuantice. Cu alte cuvinte, fiecare electron al unui atom poseda un set unic de numere cuantice. Acest lucru impune o limita a numarului de electroni ce pot ocupa orice orbital, substrat sau strat.
O metoda practica si des intalnita de descriere a acestui aranjament consta in scrierea electronilor in functie de straturile si substraturile ocupate; aceasta conventie porta numele de notatia spectroscopica. Sub aceasta notatie, numarul stratului este un numar intreg pozitiv, substratul este o litera (s, p, d, f), iar numarul total de electroni dintr-un substrat (toti orbitalii si spinii inclusi) este reprezentat printr-un indice superior.
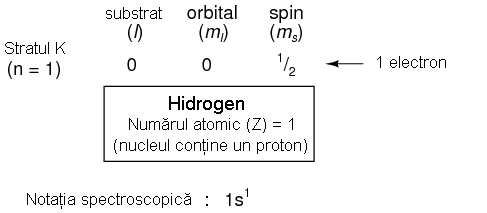
Alaturat prezentat aranjamentul electronic al atomului de hidrogen.
Cu nucleul format dintr-un singur proton, este suficient un electron pentru ca atomul sa atinga echilibrul electrostatic (sarcina electrica pozitiva a protonului este in echilibru cu sarcina electrica negativa a electronului). Acest electron ocupa stratul cel mai de jos (n=1), primul substrat (l=1), in singurul orbital (orientarea spatiala) al acelui substrat (ml=0), cu un spin de 1/2. Folosind notatia spectroscopica, hidrogenul, avand doar un singur electron in stratul inferior, se poate descrie prin notatia 1s1.
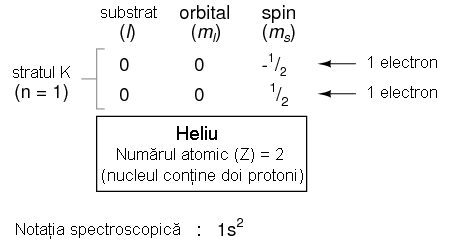
Trecand la urmatorul atom (in ordinea numarului atomic), avem elementul heliu.
Nucleul unui atom de heliu are in compozitia sa doi protoni, iar acest lucru necesita existenta a doi electroni pentru a echilibra sarcina electrica totala a atomului. Din moment ce ambii electroni, unul cu spin 1/2, celalalt cu spin -1/2, "incap" pe un singur orbital, configuratia atomului de Heliu nu necesita substraturi sau straturi suplimentare pentru cel de al doilea electron.
Totusi, un atom ce contine trei sau mai multi electroni, va necesita substraturi aditionale pentru toti acei electroni, din moment ce pe stratul inferior (n=1) incap doar doi electroni.
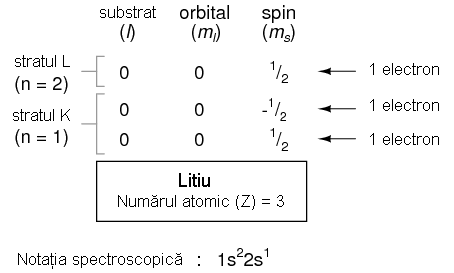
Sa consideram urmatorul atom, cel de litiu.
Un atom de litiu foloseste doar o fractiune din capacitatea stratului L (n=2), capacitatea totala a acestuia fiind de opt electroni (capacitatea maxima a stratului = 2n2, unde n este numarul stratului).
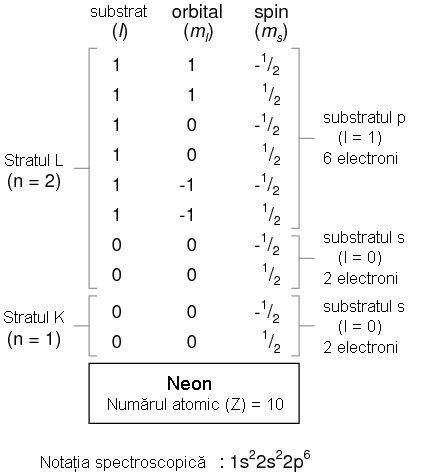
Daca examinam aranjamentul electronic al unui atom cu stratul L completat, putem vedea cum toate combinatiile de substraturi, orbitali si spini sunt ocupate de electroni. Elementul ce corespunde acestei configuratii este Neonul.
Adesea, atunci cand se foloseste notatia spectroscopica a unui atom, toate straturile ce sunt ocupate complet sunt ignorate, fiind scrise doar straturile neocupate sau stratul ocupat superior. De exemplu, neonul (prezentat mai sus), ce are doua straturi complet ocupate, poate fi descris pur si simplu prin 2p6 in loc de 1s22s22p6. Litiul, avand stratul K complet ocupat, si doar un singur electron in stratul L, poate fi descris prin notatia 2s1 in loc de 1s22s1.
"Ignorarea" straturilor inferioare, complet ocupate, nu este doar o conventie de scriere, ci ilustreaza foarte bine un principiu de baza al chimiei: comportamentul chimic al unui element este determinat in primul rand de straturile sale neocupate. Atat hidrogenul cat si litiul poseda un singur electron in straturile superioare (1s1 si 2s1), iar acest lucru se traduce printr-un comportament similar al celor doua elemente. Ambele elemente sunt reactive, si au o reactivitate similara. Conteaza mai putin faptul ca litiul poseda un strat complet (K) in plus fata de hidrogen. Comportamentul sau chimic este determinat de stratul sau neocupat, L.
Elementele a caror straturi superioare sunt ocupate complet, sunt clasificate ca elemente nobile, fiind aproape non-reactive fata de celelalte elemente. Aceste elemente au fost clasificate in trecut ca inerte, crezandu-se ca sunt complet non-reactive, dar acestea pot forma compusi cu alte elemente in conditii specifice.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |