Legatura chimica
Pana in acest moment nu am discutat in detaliu modul de
functionare al bateriilor, ci am presupus pur si simplu ca
acestea produc o tensiune
Am discutat in primul capitol despre conceptul de atom. Atomii sunt compusi din parti mai mici denumite particule. Particulele elementare dintr-un atom sunt electronii, protonii si neutronii. Fiecare dintre aceste particule joaca rolul ei in comportamentul atomului. Activitatea electrica implica miscarea electronilor, iar identitatea chimica (ce determina in mare tipul de material: coductor/izolator) este determinata de numarul protonilor din nucleu.
Dislocarea protonilor din nucleul atomului este foarte greu de realizat, de aici si stabilitatea identitatii chimice a atomilor in general. Indepartarea electronilor, in schimb, este mult mai usor de realizat. Dupa cum am vazut, frecarea este unul dintre procedeele prin care electronii pot fi "mutati" de pe un material pe altul, la fel este si caldura, procedeu evidentiat in cazul termocuplei.
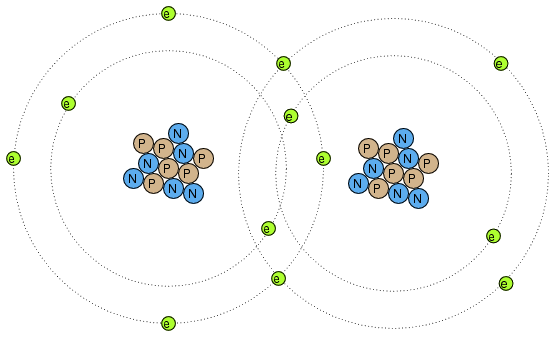
Electronii pot servi insa si unui alt scop: legarea atomilor intre ei. Aceasta legare a atomilor prin intermediul electronilor poarta numele de legatura chimica. O reprezentare simplificata a unei asemenea legaturi dintre doi atomi este cea alaturata.
Exista mai multe tipuri de legaturi chimice, cea de sus fiind o legatura covalenta, caracterizata prin impartirea electronilor de catre atomi. Deoarece aceste legaturi sunt bazate pe legaturi formate de electroni, ele nu pot fi mai puternice decat gradul de imobilitate al electronilor constituenti. Ceea ce vrem sa spunem este ca aceste legaturi chimice pot fi create sau desfacute de aceleasi forte ce induc deplasarea electronilor: caldura, lumina, frecarea, etc.
Atunci cand atomii sunt legati intre ei prin legaturi chimice, acestia formeaza materiale cu proprietati unice numite molecule. Desenul de mai sus, cu doi atomi de acelasi tip legati, este un exemplu de molecula simpla. Majoritatea moleculelor sunt formate insa din tipuri diferite de atomi. Chiar si moleculele formate din atomi de acelasi tip pot prezenta proprietati fizice radical diferite.
Insa, pentru studierea bateriilor, trebuie sa introducem un alt tip de legatura chimica, cea ionica. Aceasta difera fata de legatura covalenta prin faptul ca un atom al moleculei poseda un exces de electroni iar celalalt atom poseda un deficit de electroni; in acest caz, legatura dintre atomi este rezultatul atractiei electrostatice dintre cele doua sarcini diferite ("+" si "-"). Atunci cand legaturile ionice iau nastere din atomi neutrii, exista de fapt un transfer de electroni intre atomii pozitivi si negativi din punct de vedere electric. Este bine de stiut faptul ca moleculele contin de obicei ambele tipuri de legaturi chimice. Hidroxidul de sodiu (NaOH) este format dintr-o legatura ionica dintre atomul de sodiu (pozitiv) si ionul hidroxil (negativ). Ionul hidroxil formeaza o legatura covalenta (simbolizata prin bara) intre hidrogen si atomii de oxigen:
Na+ O-H-
Sodiul pierde doar un electron, sarcina lui fiind +1 in exemplul de mai sus. Daca un atom pierde mai mult de un electron, sarcina rezultata poate fi desemnata prin +2, +3, +4, etc. sau printr-o cifra romana in paranteze ce desemneaza starea sa de oxidare (pierderea electronilor), astfel: (I), (II), (IV), etc. Unii atomi pot avea mai multe stari de oxidare, si este bine sa precizam starea de oxidare in formula moleculara pentru evitarea confuziilor.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |