
Se considera un cilindru in care se gaseste un fluid compresibil si care are in orice punct acelasi nivel energetic. Moleculele care alcatuiesc sistemul termodinamic se deplaseaza dezordonat in toate directiile. Incinta fiind in repaos, energia potentiala (la un moment dat) este formata din energia totala a tuturor moleculelor din incinta, numita energie interna a sistemului, notata cu U. Se admite ca in momentul t energia interna a sistemului este U1. Daca pana in momentul t sistemul a primit caldura Q12 si a cedat energia mecanica L12, sistemul intrand apoi in repaos termodinamic, in momentul t energia moleculelor va fi: U2 = U1+Q12-L12. Daca apoi sistemul primeste L12 si cedeaza Q12, energia interna va reveni la valoarea initiala U1. Deci energia interna este o marime de stare (o marime calorica de stare) extensiva, deoarece depinde de numarul moleculelor cu masa finita din incinta, variatia energiei interne fiind:
DU = m·Du
unde u este enrgia interna specifica (J/kg)
Primul principiu al termodinamicii se scrie:
Q12-L12 = U2-U1= m·(u2-u1)
Pentru un schimb de energie realizat intr-un interval de timp d
dQ-dL = dU=m·du
Energia totala a unei molecule de masa mi dintr-un sistem termodinamic este:
ei = ecin+epot+erot+evibr
Energia interna a sistemului termodinamic unitar (N-nr de molecule) va fi:
U = 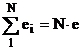
Calculul energiei interne nu se poate face dupa aceasta relatie care scoate in evidenta doar semnificatia fizica a energiei interne. Daca sistemul va primi energie, va rezulta o crestere pentru energia interna.
Moleculele care intalnesc incinta vor fi oprite din miscare si apoi accelerate. Presiunea sistemului este pusa in evidenta prin raportul dintre fortele de ciocnire si suprafata:
![]()
unde: m = mi·N - masa tuturor moleculelor;
Dw - este variatia totala a vitezei moleculei (franare +accelerare), considerata dupa directia normala la perete.
Atat timp cat gazele sunt foarte departate de zona de lichefiere, coeziunea este neglijabila, dimensiunile moleculelor sunt extrem de mici in comparatie cu distantele dintre ele. In aceste stari energia potentiala, de rotatie si de vibratie sunt neglijabile, deci:
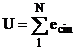
iar pentru sistemul unitar (mi = ct pentru fiecare molecula) se scrie:
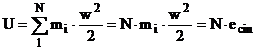
w - viteza medie a moleculelor fata de incinta.
Nu se poate determina starea energetica a sistemului prin calculul energiei interne dupa ecuatia de mai sus. Pentru calcul sunt necesare masuratori macroscopice ale unor marimi de stare. Se demonstreaza ca:
![]()
Presiunea poate fi masurata macroscopic prin intermediul peretelui elastic care se deformeaza sub actiunea fortelor de ciocnire. Se introduce:
![]() ;
; ![]()
r- constanta specifica a gazului.
Rezulta:
p·V = m·r·T
Aceasta este ecuatia termica de stare a gazului perfect.Ecuatia se poate reprezenta in coordonate p,V,T, obtinandu-se o suprafata termodinamica, adica locul geometric al tuturor starilor termice pe care le poate avea sistemul termodinamic(ST).
Gazul perfect este un gaz fictiv, fara natura chimica determinata, nelichefiabil, alcatuit din molecule sferice, perfect elastice, fara coeziune si fara inertie, fara viscozitate. Moleculele lui poseda numai energie cinetica si fac schimb de energie numai in timpul ciocnirilor.
Comportarea gazelor reale se apropie de a gazului perfect (la presiuni mici si temperaturi mai mari decat temperatura de condensare); deci aplicarea legilor gazului perfect conduce la rezultate suficient de precise in majoritatea cazurilor tehnice.
Legea lui Avogadro: In aceleasi conditii de presiune si temperatura, volume egale de gaze perfecte au acelasi numar de molecule.
Se definesc conditii normale fizice de presiune si temperatura:
pN = 760 mmHg =1,013 105 N/m2
TN = 273,16 K; tN = 0 oC
In aceste conditii (pN, TN) 1kmol din orice substanta are:
NA = 6,023 1026 (molecule) - numarul lui Avogadro.
M (kg) - masa molara.
VM = 22,414 Nm3-volum molar.
Pentru n kmoli ecuatia de stare se scrie(m = n.M):
p V = n R T
Pentru 1 kmol si conditii normale fizice rezulta:
pN VN = 1 R TN
Deci:
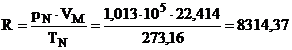
![]()
![]() [
[![]() - constanta specifica a gazului
- constanta specifica a gazului
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |