
Pentru un sistem tremodinamic motor, care functioneaza in atmosfera terestra, rolul de sursa calda si de sursa rece il reprezinta mediul atmosferic din zona punctului considerat; parametrii termici atmosferici variaza independent de vointa omului, deci in timpul transformarilor termodinamice ST este in dezechilibru termic si al presiunilor cu mediul exterior.
Asadar transformarile dirijate de om sunt dezechilibrate fata de mediul exterior si nu pot fi reversibile.
Se admite un sistem termodinamic format dintr-un gaz perfect care se destinde adiabatic de la V1 la V2, dupa care, printr-o compresie adiabatica, se revine la volumul V1(Fig.2.25). In starea initiala parametrii termici sunt: p1, T1, V1.
Sunt prezentate transformarile:
1-2ad - destindere adiabatica reversibila.
1-2 - destindere adiabatica cu frecare.

2-1ad - comprimare adiabatica reversibila.
2-1r - comprimare adiabatica cu frecare.
Se
noteaza e![]() ; p1 V1g
=p2ad V2g
p2ad =
; p1 V1g
=p2ad V2g
p2ad =![]()
In
starea 2ad: p2ad=![]() ; T2ad=
; T2ad= ![]()
Rezulta
L12 = U1-U2ad = m cv (T1-T2ad) > 0
Q12ad = 0; DS12ad = 0
Pentru transformarea inchisa 1 - 2ad - 1:
aLad = 0; aQ= 0; aDS = 0.
Prin frecare se pierde o energie mecanica care se transforma in caldura Qf primita de ST. In ipoteza ca rezistenta termica (Rt) a incintei este infinit de mare (incinta adiabatica), caldura de frecare Qf va provoca cresterea ireversibila a entropiei sistemului. Transformarile (1-2, 2-1r) vor fi adiabatice, dar nu vor fi izentropice.
Adiabata cu frecare poate fi asimilata cu o transformare de natura politropica numita "pseudopolitropa". Diferenta dintre politropa 1-2 si o pseudopolitropa consta in faptul ca, in timp ce relatiile dintre marimile termice de stare (p,V,T) respecta legile politropei, schimburile de energie sunt diferite.
Schimbul elementar de caldura pentru o politropa este:
![]()
Pentru destinderea politropica 1-2, dT < 0 si pentru dQ > 0 rezulta n < g. Deci destinderea adiabatica cu frecare respecta legile unei politrope cu
nI g
p2 =
![]() ;
; ![]()
Caldura de frecare va fi:
![]()
reprezentata prin aria de sub curba 1-2 pina la abscisa si se mai poate scrie:
![]()
Lucrul mecanic politropic reversibil este:
![]()
Caldura Qfd provine dintr-o pierdere de energie mecanica politropica si nu este schimbata cu exteriorul prin incinta (fiind acumulata de gaz), lucrul mecanic real fiind:
Lid = L12 - Qfd = m cv (T1-T2) = U1-U2
Si pentru ca U2 > U2ad, rezulta ca: Lid <Lad.
Variatia ireversibila a entropiei (pentru pseudopolitropa) este:
![]()
Se defineste un "randament intern" sau randament adiabatic:
![]()
Prin realizarea comprimarii adiabatice fara frecare 2-1ad:
p1ad= p2 eg >p1; T1ad = T2 eg > T1.
Pentru comprimarea adiabatica cu frecare 2-1r, caldura de frecare Qfc va fi:
![]()
si deoarece pentru compresie dT >0, rezulta ca n >γ. Se asimileaza adiabata ireversibila cu o pseudopolitropa de exponent n diferit de cel corespunzator destinderii :
p1r = p2 en > p1ad >p1; T1r = T2 en-1>T1ad >T1
Caldura de frecare se scrie:
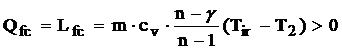
Lucrul mecanic politropic (reversibil) L21r este:
![]()
Lucrul mecanic real de compresie Lic al adiabatei cu frecare va fi:
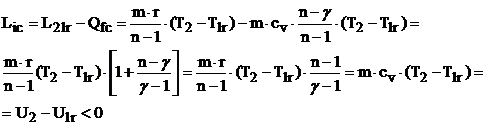
![]()
In concluzie, pe cursa de destindere se obtine mai putina energie mecanica decat ar corespunde destinderii reversibile, iar pe cursa de compresie se consuma mai multa energie mecanica decat pentru compresia reversibila. Randamentul adiabatic la comprimare va fi:
![]()
Variatia entropiei pe cursa de compresie este:
![]()
La revenirea volumului la valoarea initiala V1, presiunea si temperatura nu si-au mai reluat valorile initiale (p1, T1), avand:T1r > T1 si p1r > p1. Pentru a se reveni la starea initiala 1, sistemul trebuie sa cedeze exteriorului caldura Q1r, fara a fi necesar si un schimb de energie mecanica:
Q1r = m cv (T1-T1r)= U1-U1r < 0
Observatii:
-
Exteriorul a primit energia mecanica Lid
si a cedat sistemului energia mecanica Lic. Bilantul schimbului de energie mecanica
(considerat pentru mediul exterior) este: ![]() .
.
aL<0, deci exeriorul a cedat sistemului termodinamic lucru mecanic pentru readucerea acestuia la starea initiala V1 (dar: p1 p1r; T1 T1r).
Sistemul termodinamic (ST) a fost izolat termic cu exteriorul in timpul celor doua transformari adiabatice cu frecare 1-2-1r. Pentru revenirea la starea initiala sistemul trebuie sa cedeze caldura: aQ = Q1r.1 = U1-U1r < 0,
pe care o primeste exteriorul: aQ = U1r -U1 > 0 (pentru exterior).
Se observa ca bilantul de energie pentru mediul exterior este:aL = aQ
Astfel,
prin prezenta procesului de frecare, in mediul exterior ramane un
deficit de energie mecanica (aL),
egal in valoare cu un exces de caldura (aQ).
Variatia DSST
a sistemului datorita frecarii este (la revenire in starea
initiala): ![]()
Rezulta: DSE = - DSST >0 , DSE - variatia entropiei mediului exterior.
Micsorarea entropiei sistemului ΔSST corespunde cu cresterea entropiei DSE a exteriorului. Exista deci o degradare a energiei din forma mai valoroasa a ei (mecanica) in caldura.
Se considera o transformare termodinamica a ununi gaz de la V1 la V2 (Fig. 2.26). Se considera
Tp = f1(V) - temperatura medie a peretilor cilindrului;
Tg = f2(V) - temperatura gazului din cilindru.
Se admite ca pentru un volum Vm exista egalitatea : Tg = Tp. In consecinta, va exista un schimb de caldura intre gaz si perete (Qgp). Sunt doua situatii:
Tg > Tp, gazul cedeaza caldura, Qgp<0;
Tg < Tp, gazul primeste caldura, Qgp>0.
In diagrama Q-V curbele sunt trasate calitativ. Datorita acestui schimb de caldura gazul executa o transformare politropica (nu adiabatica) ireversibila (Qf > 0).
aQ = Ogp + Qf - caldura totala schimbata de gaz cu incinta.
 Se admite un punct in care Qf = Qgp
(aQ
=0). In acest punct (Va) pierderea de caldura gaz-perete (Qgp)
este compensata de caldura de frecare.
Se admite un punct in care Qf = Qgp
(aQ
=0). In acest punct (Va) pierderea de caldura gaz-perete (Qgp)
este compensata de caldura de frecare.
Schimbul elementar de caldura pentru gaz va fi(dTg<
![]()
Se deosebesc cazurile:
-
Vx < Va; dQ
< 0; n > g
(deoarece ![]() >Qf);
>Qf);
![]() -
Vx = Va; dQ = 0; n
= g
-
Vx = Va; dQ = 0; n
= g
- Vx > Va; dQ
> 0; n< g; ![]()
In concluzie, transformarea poate fi considerata o transformare politropica (pVn = ct) cu exponentul politropic variabil (n = f(V)). Calculul acestei politrope este imposibil de efectuat, aici s-a urmarit doar faptul ca transformarea politropica este o transformare generala a tuturor transformarilor termodinamice deschise.
Transformarile reversibile simple sunt asimilabile cu politrope cu exponent constant, iar cele ireversibile complexe prin politrope cu exponent variabil.
Pentru o diagrama trasata cu un dispozitiv de inregistrare (indicator mecanic) exista relatia:
pVf(V) = ct; n= f(V).
Se poate gasi o politropa simpla, suficient de apropiata de transformarea reala, si daca se aleg doua puncte 1 si 2 se poate calcula un exponent politropic mediu(Fig 2.27). Se obtine o "politropa medie", foarte des utilizata in proiectarea motoarelor sau agregatelor termice.
Exponentul politropic mediu se calculeaza din relatia:
p1 V1n = p2 V2n T n

Se considera o transformare ireversibila inchisa care se inchide printr-o interventie finita din partea exteriorului.In acest caz:
Q1 - caldura cedata de sursa calda;
Q2rev - caldura cedata sursei reci, daca ciclul ar fi reversibil;
Qf - caldura de frecare primita de sursa rece.
![]() ;
; 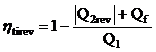 ; ht
irev < h
trev
; ht
irev < h
trev
Ciclurile reale nu pot fi calculate cu exactitate datorita complexitatii calculelor. Ciclurile reversibile (ideale) se folosesc drept cicluri de comparatie; ele nu pot fi realizate practic datorita proceselor ireversibile.
Se defineste un randament indicat:
![]()
unde: Lt - lucrul mecanic teoretic al ciclului ideal
Li - lucrul mecanic indicat al ciclului real.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |