Biotehnologiile au o sfera de aplicabilitate este foarte mare, cuprinzand diverse domenii medicina, agricultura, industria alimentara, industria farmaceutica. Orice manipulare a viului in folosul societatii inseamna biotehnologie.
In functie de tipul de celule cu care se lucreaza, deosebim: biotehnologii microbiene, vegetale si animale.
In functie de domeniul in care isi gasesc aplicatii produsele obtinute pe cale biotehnologica deosebim:
biotehnologii industriale: farmaceutice, alimentare si de depoluare;
biotehnologii agricole: vegetale si in zootehnie;
biotehnologii medical-veterinare.
Obiectul biotehnologiilor farmaceutice este obtinerea cu ajutorul microorganismelor a unor produse naturale de biosinteza si eventual modificarea lor prin semisinteza.
Cea mai inalta treapta tehnologica in obtinerea produselor bioactive o reprezinta ingineria genetica: intr-un microorganism banal se introduce informatia de preparare a unei anumite specii chimice active terapeutic, greu de obtinut altfel. Se poate prepara astfel insulina si interferon uman cu ajutorul bacteriilor si drojdiilor al caror ADN a fost modificat pe cale chimica. Medicamentele astfel obtinute sunt mai putin toxice si mai usor de prelucrat de catre organism.
Biotehnologiile farmaceutice au mai multe etape:
selectarea microorganismelor si ameliorarea performantelor lor:
deoarece in natura microorganismele sunt in asociere caracteristica mediului din care a fost prelevata proba, iar biotehnologia nu se poate aplica decat pe o cultura pura. Se practica mai multe metode: metoda Lister, metoda Linder, metoda Koch, metoda Naumov, etc. Pentru cresterea productivitatii se utilizeaza culturi pure de inalta performanta rezultate prin selectii repetate a celor mai bune tulpini si obtinere prin procedee de mutasinteza a mutantilor inalt productivi. Mutantii sunt indivizi care difera de populatia speciei prin unul sau mai multe caractere ce se transmit ereditar; noile caractere apar datorita modificarilor genetice care se produc de regula datorita socurilor termice, pasteurizarii sau carentei din mediu a unor principii utile dezvoltarii normale. Calitati urmarite la mutanti: productivitate marita, rezistenta la diversi agenti patogeni, la diferite valori de pH, asimilarea unor medii nutritive ieftine, termosensibilitate scazuta, etc.
pregatirea mediilor de cultura:
intrucat microorganismelor le trebuie asigurate conditii optime fizice (temperatura, agitare, vascozitate), chimice (compozitia mediului de cultura) si biologice (sterilizarea mediului).
Mediile de cultura sunt constituite din suporturi nutritive sterilizate care permit dezvoltarea si studiul unui microorganism, in afara nisei ecologice naturale. Biomasa este formata din 73-86% apa si restul este substanta uscata (C, N, O, H, P, S, K, Mg, Fe, Mn, Zn, Na, Ca, Cl, Si).
Mediile de cultura se clasifica in functie de:
consistenta: medii lichide, solide, semisolide;
compozitie:
medii naturale: din tesuturi animale sau vegetale sub forma de maceratii sau bulioane;
medii sintetice;
microorganismele cultivate (tipul respirator al acestora): medii pentru microorganisme aerobe sau anaerobe;
scopul si frecventa utilizarii
medii de uz curent,
medii speciale utilizate mai ales pentru izolarea microorganismelor la nivel la laborator: pot fi elective, selective, de imbogatire, de conservare, de identificare.
faza de biosinteza la care este utilizat mediul de cultura: medii laborator, pilot sau medii de cultura industriala;
destinatia finala a culturii dezvoltate mediile pot fi pentru cultura inocul sau pentru cultura de regim, numite si medii de fermentatie sau medii de biosinteza.
Deoarece fenomenele de spumare sunt frecvent intalnite in cazul culturilor aerate este necesara adaugarea in mediile de cultura a agentilor de antispumare, uleiuri sau grasimi animale cu p.t. scazute (ulei de floarea-soarelui si soia).
Concentrarea mediilor de biosinteza a enzimelor se realizeaza prin evaporarea in vacuum, care permite efectuarea operatiei la temperaturi relativ scazute (2550°C). In ultimul timp se practica cu succes procedeele de concentrare atermica, ultrafiltrarea si osmoza inversa.
sterilizarea:
este necesara pentru asigurarea omogenitatii populatiei culturilor intensive. Se sterilizeaza: aparatura, mediul de cultura, aerului si se foloseste o cultura pura. Procedeele de sterilizare utilizate sunt de natura fizica, mecanica si chimica si sunt alese in functie de materialul de sterilizat. Sterilizarea termica este metoda cea mai utilizata industrial: la temperaturi peste 600C incep sa se distruga formele termolabile iar la 1600C sunt distrusi si cei mai rezistenti spori bacterieni.
fermentatia:
cuprinde totalitatea proceselor biochimice prin care microorganismele isi procura energia, elaboreaza metabolitii (care reprezinta de regula scopul biosintezei) si se multiplica.
filtrarea:
filtrarea mediilor de sinteza ridica adesea probleme datorita compozitiei deosebit de complexe mediilor si aparitiei materialului biologic (bacterii, fungi) care complica fenomenul.
Se utilizeaza una din urmatoarele metode:
pe materialul filtrant, (panza de filtru, hartie) se aplica un strat subtire de material adjuvant (prin filtrarea unei suspensii apoase de adjuvant). Prin patul filtrant astfel format se executa operatia de filtrare;
adjuvantul se amesteca cu suspensia de filtrat; se executa filtrarea, recirculand primele portiuni de filtrat pana la limpezirea sa totala;
raclarea permanenta a stratului de adjuvant, cu ajutorul unor cutite speciale astfel incat stratul de adjuvant de filtrare este mentinut la o valoare optima, iar viteza de filtrare este mentinuta constanta. Aceasta varianta este aplicata in cazul filtrelor rotative.
O varianta a operatiei de filtrare mult utilizata in biotehnologie este filtrarea sterilizanta.
La prelucrarea suspensiilor se face mai intai o prefiltrare grosiera urmata apoi de filtrarea sterilizanta propriu-zisa. Pentru filtrarea sterilizanta se monteaza in filtru placile (din acetat de celuloza, azbest sau polimeri sintetici) cu diametru redus al porilor, executand apoi in mod normal operatia de filtrare.
separarea si purificarea:
Inainte de a fi purificate, substantele organice obtinute pe cale biotehnologica sunt in prealabil izolate din lichidul de cultura (daca sunt extracelulare) sau din biomasa (daca sunt intracelulare) intr-o forma partial purificata, aplicand metode de separare general valabile pentru toate produsele de biosinteza.
Prelucrarea primara a mediilor de biosinteza se face prin filtrare, centrifugare, decantare, concentrarea fazei lichide, dezagregarea celulelor, extractia, uscarea, atomizarea. Pot fi aplicate si procedee specifice: precipitarea cu solventi sau cu saruri anorganice, purificari si concentrari prin ultrafiltrare.
Echipamentele industriale implicate sunt complexe si specifice. Schema de flux variaza de la un preparat la altul, in functie de tehnologie.
Dificultatile provin din faptul ca produsele biologic active obtinute in general prin biosinteza sunt substante termolabile, ceea ce impune evitarea degradarii sau modificarii chimice a acestora. Pentru a alege cea mai adecvata metoda de separare a produselor biosintetizate, este necesar sa se cunoasca proprietatile fizico-chimice a acestora si anume:
solubilitatea: in apa sau in solutii diluate de saruri; in solventi polari (metanol, etanol, acetona); in solventi slab polari (cloroform, hidrocarburi);
stabilitatea in solutie (in functie de pH, efectul temperaturii; efectul solutiilor tampon; efectul solventilor organici) si stabilitatea in stare solida (in functie de temperatura, precum si efectul umiditatii asupra produsului).
proprietatile fizice: dializabilitatea prin membrane; adsorbtia pe suprafetele solide; migrarea in camp electric; sedimentarea in ultracentrifuge;
proprietatile chimice: stabilitatea fata de diverse enzime; stabilitatea la actiunea unor agenti chimici.
Pentru separarea produsului din mediile de biosinteza se aplica, in general, urmatoarele metode: extractia cu solventi organici; separarea pe schimbatori de ioni; cromatografia; adsorbtia.
Operatiile chimice cel mai des utilizate in biotehnologia enzimelor si aplicate industrial sunt: filtrarea, concentrarea, dezagregarea celulara si atomizarea.
Uscarea prin atomizare a mediilor de fermentatie cu activitate enzimatica se foloseste pentru materialele care in faza initiala sunt lichide (solutii suspensii, paste subtiri). Acestea sunt pulverizate in particule de dimensiuni mici, cand se obtin particule de dimensiuni intre 2 si 200 μm. Datorita dimensiunilor particulelor, operatia a fost denumita si atomizare in uscatoarele cu pulverizare. Uscarea are loc foarte repede, materialul nu are timp sa se incalzeasca peste limita admisibila si temperatura lui este apropiata de temperatura de evaporare a lichidului. Materialul uscat se obtine sub forma de pulbere si nu este necesara o maruntire ulterioara.
Cand substantele biologic active care intereseaza si care s-au format in cursul procesului de biosinteza sunt intracelulare, este necesara distrugerea membranei celulare semipermeabile si a peretelui protector in vederea recuperarii componentelor respective. Aceasta operatie se realizeaza prin procedee de dezagregare.
Dupa natura agentului de dezagregare utilizat, procedeele de dezagregare ale celulelor microbiene se clasifica in:
procedee mecanice: dezagregarea celulelor in mori coloidale sau in mori vibratoare, cand este posibil sa aiba loc o crestere a temperaturii materialului biologic, crestere evitata prin circulatia unui agent de racire prin mantaua aparatului.
procedee fizice nemecanice: decomprimare rapida, prin inghetare lenta, (datorita sporirii volumului apei la trecerea in stare solida) sau prin soc osmotic. Vibratiile ultrasonice cu frecvente de cca. 20000 Hz determina dezintegrarea celulelor microbiene.
procedee chimice: distrugerea componentelor lipoproteice ale membranei celulare prin actiunea detergentilor cationici sau anionici, sau a solventilor organici, determinand trecerea in faza lichida a unora dintre componentele biologic active.
procedee enzimatice: liza celulelor bacteriene poate fi indusa prin atacul enzimatic specific al legaturilor α-1,4 dintre moleculele de N-acetilglucozamina si acidul N-acetilmuramic.
Viteza de multiplicare a bacteriilor este exceptional de mare. Durata unei generatii - interval de timp dintre doua diviziuni succesive - este tipica pentru fiecare specie, dar poate varia la aceeasi specie in functie de conditiile de mediu, fiind, in general, cuprinsa intre 20 si 30 de minute.
Procesul multiplicarii populatiilor bacteriene este bine cunoscut. Acesta cuprinde mai multe faze care sunt descrise in continuare.

Curba de crestere a unei populatii bacteriene (Gh. Zarnea)
A → insamantare; A-B → faza de lag;
B-C → faza de accelerare a ritmului de crestere; C→ faza de multiplicare logaritmica;
D-E → faze de incetinire a ritmului de crestere; E-F → faza stationara;
F-G → faza intermediara de declin; G-H → faza de declin;
Faza de latenta sau lag este cuprinsa intre momentul introducerii germenului in mediul de cultura (inoculare) si momentul in care celulele acestuia incep sa se multiplice. In aceasta faza, numarul bacteriilor din inocul ramane neschimbat sau chiar scade temporar. Cultura nu este vizibila macroscopic. Aceasta faza dureaza in medie cateva ore. Faza de latenta apare ca o perioada de adaptare in noile conditii de cultivare. In aceasta perioada bacteriile viabile din inocul isi acumuleaza in celula metabolitii esentiali si sistemele enzimatice necesare cresterii. Durata perioadei de latenta variaza, deci, in functie de noile condilii de mediu pe care microorganismele le gasesc la transvazare. Cu cat aceste conditii noi (mediu nutritiv, temperatura, pH, aeratie) sunt mai apropiate de cele anterioare, cu atat perioada de lag este mai scurta.
Faza de multiplicare exponentiala sau de crestere logaritmica: aceasta faza este precedata de o perioada scurta (aproximativ 2h), de accelerare a ritmului de crestere, in care multiplicarea se produce cu o viteza progresiva marita. Dupa aceasta perioada, diviziunile sunt bine sincronizate, astfel incat numarul celulelor viabile se dubleaza brusc si la intervale regulate dupa o progresie geometrica 2, 20, 21, 22, 23, , 2n, adica are loc o crestere exponentiala. Capacitatea de crestere exponentiala se manifesta ca atare numai o scurta perioada de timp (2-3 ore).
Faza stationara maximala. Este faza in care numarul celulelor viabile este maxim si ramane constant o perioada de timp care dureaza de la cateva ore, la cateva zile, in functie de sensibilitatea bacteriilor la conditiile de mediu.
Faza de declin. Este faza corespunzatoare unei scaderi progresive a numarului celulelor viabile datorita mortii unui numar foarte mare de celule. Celulele din aceasta faza sunt batrane, aparand fenomene de involutie: celulele mici, sferice, deformate, gigante sau ramificate, care se coloreaza slab sau capata afinitate fata de colorantii acizi.
Fungii cresc sub forma de colonii, deoarece celule individuale la aceste microorganisme sunt conidiile. In cazul fungilor, se dezvolta un miceliu ramificat a carui lungime poate atinge 10-15 m.
Faze in cresterea unui miceliu pornind de la un inocul de spori sau de la un fragment micelian:
1. faza initiala de lag, care dureaza cateva ore; in aceasta faza are loc germinarea sporilor (cand inocularea s-a efectuat cu suspensie de spori) sau regenerarea hifelor rupte si lezate (cand inocularea s-a efectuat cu inocul vegetativ);
2. faza de crestere liniara, in care pe suprafata mediului apare o colonie circulara care creste liniar cu timpul. Ea are forma unei retele fine de hife ale carei marime si grosime depind de compozitia mediului nutritiv.
3. faza de invechire, care corespunde incetinirii vitezei de crestere determinata de efectul daunator al produsilor de metabolism eliberati de colonie.
Factorii de mediu, cei mai importanti, care influenteaza cresterea sunt:
concentratia substratului: marirea concentratiei de substrat in mediul de cultura poate conduce la sporirea numarului de celule microbiene, dar numai pana la anumite limite, multiplicarea acestora fiind incetinita de procese de inhibitie care au loc la nivelul celulei. De exemplu, pentru foarte multe bacterii, concentratia de 10-15% in sursa de carbon (glucoza, zaharoza) este inhibitoare, ele dezvoltandu-se bine la valori ale sursei de carbon sub 10% (in solutii foarte concentrate de zahar - dulceturi, siropuri - microorganismele, in general nu se dezvolta, acestea putand fi conservate pe o lunga perioada lunga de timp).
calitatea si cantitatea inoculului: in majoritatea cazurilor este necesar ca inoculul sa se situeze intre 3 si 10% din volumul total al culturii. La bacterii, cand se utilizeaza o cantitate mare de inocul, se micsoreaza faza de lag, datorita formarii si acumularii unor metaboliti intermediari esentiali care difuzeaza in celule si in mediul de cultura mai rapid decat in cazul utilizarii unui inocul mic. Uneori, insa, cantitati mari de inocul determina aparitia unui fenomen de autoinhibitie, datorita sensibilitatii celulelor bacteriene fata de unii produsi metabolici intermediari.
temperatura: in functie de domeniul de temperatura in care microorganismele ating viteza maxima de crestere acestea se clasifica in criofile, mezofile, termofile. Microorganismele industriale sunt in general mezofile: la temperatura 25-350 viteza de crestere este maxima.
pH-ul mediului de biosinteza: in general, microorganismele au un domeniu optim de pH pentru dezvoltare, in care viteza specifica de crestere atinge valoarea maxima. De exemplu, pentru anumite specii de drojdii domeniul optim de pH se situeaza intre valorile de H 4 si 5. In timpul dezvoltarii unei culturi microbiene apar deviatii ale pH-ului de la valoarea considerata optima, care poate avea urmari nedorite asupra procesului de biosinteza. Pentru corectarea valorii pH-ului la valoarea prescrisa se adauga diverse substante chimice acizi sau baze, alese in functie de diferiti factori.
agitarea;
concentratia oxigenului dizolvat: eficienta aerarii unui mediu de cultura este reflectata de concentratia de oxigen dizolvat, determinarea eficientei aeratiei putandu-se realiza prin mai multe metode: metoda sulfit, metoda polarografica de determinare a concentratiei oxigenului dizolvat in mediu, utilizarea electrodului cu membrana pentru masurarea concentratiei de O2 dizolvat si a consumului de O2. Valoarea maxima a ratei de consum a oxigenului (O2) coincide, de obicei, cu momentul atingerii concentratiilor ridicate de celule la microorganisme.
Cercetarile de obtinere a unui produs prin biosinteza incep cu lucrari de laborator care sunt prezentate in cele ce urmeaza.
Izolarea si selectia. Se izoleaza si se selecteaza un mare numar de microorganisme cunoscute din literatura de specialitate ca producatori ai compusului ce urmeaza a fi biosintetizat. In prima etapa se urmareste realizarea unei culturi pure prin tehnici microbiologice specifice (epuizarea ansei; dilutii succesive ete.). De obicei, microorganismele sunt cultivate pe placi Petri, pe medii solidificate cu agar-agar. Testele de identificare a compusului care ne intereseaza pot fi cantitative si calitative.
Intretinerea tulpinilor producatoare. Dupa faza de izolare si selectie, tulpinile producatoare se supun unor lucrari de caracterizare dupa criterii morfologice, biochimice, fiziologice, imunologice, toxicologice. Tulpina astfel caracterizata se inregistreaza intr-o colectie de microorganisme sub un numar de identificare. De obicei, aceste tulpini sunt supuse unor lucrari de selectie naturala si artificiala (mutageneza) in scopul obtinerii de tulpini mutante inalt producatoare.
Atat tulpinile parentale cat si tulpinile mutante sunt conservate, de regula prin liofilizarea si conservarea in azot lichid, formand asa-numita "cultura stoc" de la care se porneste procesul de biosinteza. De obicei, cultura stoc este pastrata la frigider, pe geloza nutritiva, in tub inclinat.
Cultura de inocul. Inoculul reprezinta o cultura microbiana in curs de multiplicare pe un substrat nutritiv corespunzator si in anumite conditii specifice de dezvoltare: pH, temperatura, agitare, aerare. Inoculul constituie materialul de insamantare al mediului de biosinteza propriu-zis, din etapa urmatoare. Transvazarea culturii inocul in mediul de biosinteza: se realizeaza in conditii aseptice, dupa o perioada de dezvoltare bine stabilita de catre microbiolog: varsta, cantitate, aspect microscopic).
Faza de biosinteza propriu-zisa se realizeaza in aparate speciale numite bioreactoare de diferite capacitati (10 l, 100 l, 1m3, 10 m3, 100 m3), fiind precedata de operatii de sterilizare a aparaturii utilizate si a mediului de cultura stabilit la nivel de laborator, ca fiind optim. Inceputul fazei de biosinteza este considerat momentul transvazarii culturii inocul in mediul de cultura sterilizat si racit la temperatura de cultivare a microorganismului producator.
Cand raportul intre cantitatea de inocul si cantitatea de mediu de fermentatie (numit raport de inoculare) nu permite pregatirea culturii inocul in laborator, este necesara introducerea unei trepte intermediare de cultivare, numite "cultura intermediara".
In faza de statie pilot tehnologia elaborata la nivel de laborator este verificata si optimizata pe instalatii de biosinteza de capacitate medie (pilot).
Pe baza datelor de cercetare obtinute la nivel pilot, se elaboreaza asa-numitul "proces tehnologic pilot" care urmeaza o faza de experimentare industriala si apoi productie propriu-zisa de enzima.
Datele furnizate de pilot constituie elemente de proiectare pentru instalatiile industriale.
Procesul de baza in biotehnologie este "procesul biologic", dupa cum procesul de baza in tehnologia chimica este "procesul chimic". Spatiul in care se desfasoara o reactie sau un proces chimic se numeste "reactor chimic". In mod asemanator, spatiul in care se desfasoara un proces biologic se numeste bioreactor. In bioreactor transformarea materiilor prime este realizata de sistemul enzimatic al microorganismelor vii, al celulelor animale si vegetale, sau de enzimele izolate din acestea. Bioreactorul asigura pe cat posibil valori optime de pH, temperatura, concentratia substratului, concentratia in saruri minerale, factori de crestere si concentratia in oxigen. Procesul biotehnologic industrial poate fi reprezentat schematic printr-o succesiune de etape de prelucrare fizice si biochimice.
Prima etapa include operatiile de pregatire si sterilizare a mediului de cultura, sterilizarea utilajelor si a aerului tehnologic.
Etapa a doua include, de fapt, biosinteza propriu-zisa, avand loc in final obtinerea produsului printr-un proces de fermentatie aeroba sau anaeroba.
Etapa a treia include operatiile de separare si conditionare a produselor de biosinteza.
Exista doua sisteme majore de cultivare a microorganismelor care s-au impus cu timpul in domeniul biotehnologiei:
in sistem submers: mediul de cultura este lichid, agitat si aerat;
in culturi de suprafata: in care mediul de cultura poate fi solid sau semisolid. In functie de omogenitatea fazelor se face clasificarea bioreactoarelor in:
omogene L-L,
heterogene L-S, G-L-S.
Din punct de vedere al continuitatii procesului se disting trei moduri de operare: discontinuu, semicontinuu, continuu.
Antibioticele reprezinta probabil cele mai importante produse comerciale obtinute prin biosinteza si sunt substante chimice produse de microorganisme, care omoara sau inhiba cresterea altor microorganisme.
La ANTIBIOTICE S.A. Iasi (infiintata in 1955) s-a produs prin biosinteza prima sarja de penicilina romaneasca la numai 25 ani de la descoperirea penicilinei de catre Fleming. Fabrica are fluxuri separate dedicate obtinerii prin biosinteza de nistatin si vitamina B12 pentru cate a si obtinut certificare GMP (Good Manufacturing Practice precum si avizare FDA (Food & Drug Administration - organismul american regulator in domeniul medicamentului) putand astfel sa comercializeze aceste produse pe pietele din SUA si Canada.
Penicilinele au fost descoperite in 1929 de Sir Alexander Fleming in urma observatiei referitoare la inhibarea dezvoltarii unei culturi de Staphylococcus aureus de catre mucegaiul Penicillium notatum. Abia in 1940 Chain, Florey si Abraham au reusit sa izoleze penicilina din mediul de cultura si sa o introduca in terapia antiinfectioasa.
Cele mai importante antibiotice d.p.d.v. istoric si medical sunt antibioticele cu nucleu β-lactam care includ: penicilinele, cefalosporinele si cefamicinele, toate importante d.p.d.v. medical.
Se numesc antibiotice cu nucleu β-lactam, deoarece contin un nucleu β-lactam:
peniciline naturale: penicilina G, hidroxibenzilpenicilina;
peniciline de semisinteza: propicilina, meticilina, oxacilina, ampicilina;
peniciline de biosinteza: penicilina G, penicilina V.
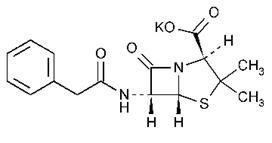
Penicilina G potasica
Biogenetic penicilinele deriva de la doi aminoacizi: cisteina si valina, care contribuie la formarea nucleului penam. Acest fapt a fost confirmat prin biosinteza penicilinei N (adiciclina: α-amino-adipoil-penicilina) in mediul de cultura al tulpinii producatoare Penicillium chrysogenum, prin utilizarea aminoacizilor marcati.
Biosinteza adiciclinei are 3 etape:
formarea unei dipeptide: α-amino-adipoil-cisteina;
formarea unei tripeptide: α-amino-adipoil-cisteinil-valina;
dehidrogenarea tripeptidei sub actiunea ciclazei (enzima din mediul de cultura al ciupercii producatoare).
Daca in mediul de cultura al unei tulpini Penicillium se adauga substante chimice cu rol de precursori pentru catena laterala (acid fenil-acetic sau fenil-acetamida) se obtine penicilina G, prin biosinteza dirijata. Daca precursorii introdusi sunt acidul fenoxi-acetic sau fenoxi-acetamida se obtine penicilina V.
Biosinteza dirijata a penicilinelor G si V are loc la scara industriala in fermentatoare. Tulpina producatoare este Penicillium chrysogenum mutant Q 1674. selectarea acestui mutant a permis cresterea randamentelor biosintezei dirijate de la 60 mg penicilina /litru mediu de cultura pentru prima tulpina producatoare, la mai mult de 20g/l pentru tulpina utilizata in prezent.
Mediul de cultura trebuie sa contina ca surse de C si N (precursori ai aminoacizilor cisteina si valina): glucide, extract de porumb. In mediul de cultura se introduc si saruri minerale: nitrat de sodiu, clorura de sodiu, sulfati de sodiu, magneziu, fier, carbonat de calciu fin divizat, precum si precursorii pentru catena laterala.
Producerea penicilinei este un proces puternic aerob, fiind necesara o aeratie eficienta. In timpul fazei de crestere se produc cantitati foarte mici de penicilina, dar, indata ce sursa de carbon este epuizata, incepe faza de producere a penicilinei, care poate fi extinsa pana la cateva zile, prin adaos de diferite componente din mediul de cultura.
Penicilina va f excretata in mediu, 1% din aceasta ramanand atasata de filamentele fungice. Dupa inlaturarea miceliului prin filtrare, filtratul va fi acidulat, iar antibioticul va fi extras cu acetat de amil sau acetat de butil.
Temperatura optima fermentarii este cuprinsa intre 24-270C, pH-ul este 5,5-7. Dupa un timp de fermentare de 4-5 zile, rezulta un lichid de cultura care contine aproximativ 3% antibiotic. Urmeaza o serie de etape de filtrare, precipitare a proteinelor si extractia rapida a antibioticului cu etil-metil-cetona sau eter la pH acid (acid fosforic) pentru a evita degradarea penicilinei. Schema biogenezei adiciclinei si a biosintezei dirijate a penicilinei naturale este urmatoarea.
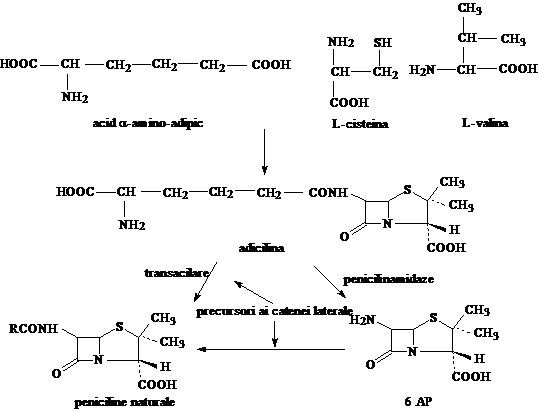
Tehnologia penicilinelor presupune:
- pregatirea mediilor si sterilizarea lor;
- fermentatia propriu-zisa in trei trepte: in inoculator (aclimatizarea microorganismelor producatoare la noile conditii de dezvoltare), in intermediar (incepe cresterea exponentiala) si in regim (continua cresterea exponentiala si se elaboreaza penicilina);
- filtrarea solutiilor native;
- separarea si purificarea penicilinelor.
Cefalosporinele au o structura moleculara foarte apropiata de a penicilinelor si aceasta inhiba sinteza peretelui celular la bacteriile Gram-pozitiv si prezinta un spectru larg de activitate antimicrobiana.
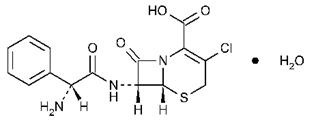
Cefaclor
In anul 1945, biologul Brotzu a izolat un mucegai numit Cephalosporium acremonium al carui filtrat de cultura s-a dovedit a avea proprietati antistafilococice. Din mediul de cultura au fost izolate trei antibiotice:
cefalosporina P, lipsita de interes ca antibiotic,
cefalosporina N identificata ca fiind identica cu penicilina N;
cefalosporina C a carei structura chimica a fost determinata de Abraham si Newton in 1961; cefalosporina C a reprezentat modelul structural care a stat la baza prospectarii cefalosporinelor de semisinteza.
Se realizeaza din aceeasi aminoacizi ca in cazul penicilinelor naturale. In mediul de cultura al ciupercii Cephalosporium acremonium, obtinerea Cefalosporinei C se realizeaza dupa urmatoarele etape:
formarea unei tripeptide: α-amino-adipoil-L-cisteinil-L-valina;
hidroxilarea unei grupe metil din restul izopropilic al valinei si acetilarea grupei hidroximetil rezultate;
ciclizarea oxidanta a tripeptidei.
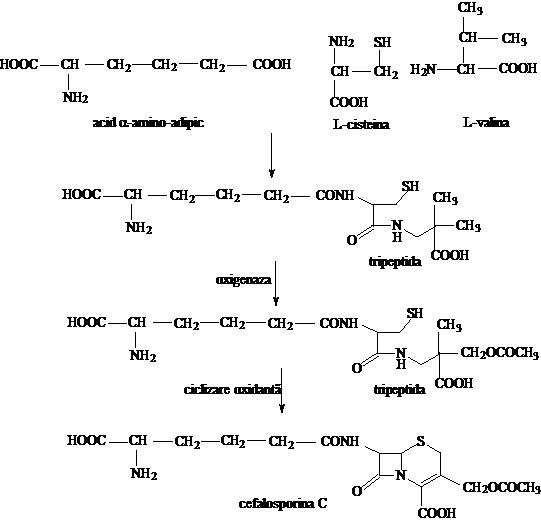
Spre deosebire de Penicillium, Cephalosporium acremonium nu poseda transacilaze si amidaze. Absenta transacilazelor nu permite incorporarea in catena laterala a unor resturi ale acidului acetic moosubstituit, cu obtinerea altor cefalosporine prin biosinteza dirijata.
Absenta amidazelor nu permite obtinerea in mediul de cultura a acidului 7-aminocefalosporanic, oricare ar fi conditiile de fermentare. Ca urmare, pana in prezent nu s-a reusit obtinerea altor cefalosporine prin procedeul biosintezei dirijate.
Obtinerea cefalosporinei C se realizeaza in mediu aerat, in culturi in profunzime, la pH 7 si o temperatura de 250C. dupa 7 zile are loc extractia antibioticului, la temperatura joasa.
Tetraciclinele au spectru larg de actiune inhiband aproape toate bacteriile Gram pozitiv si negativ. Structura de baza cuprinde un sistem de inele naftacen. Clortetraciclina contine un atom de clor, oxitetraciclina o grupare OH
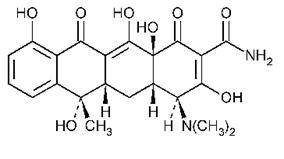
Tetraciclinele naturale se obtin pe cale microbiologica, utilizandu-se ca tulpini producatoare specii de Streptomyces. Mediul de cultura pentru cultura producatoare contine surse de carbon (glucoza, amidon) si de azot (aminoacizi, extract de porumb) precum si saruri minerale: fosfat tripotasic, fosfat trisodic, carbonat de calciu, sulfat de magneziu, saruri de mangan si crom.
Conditiile de fermentare difera in functie de tetraciclina de biosinteza care trebui obtinuta. Astfel, pentru clortetraciclina se imbogateste mediul cu clor, in timp ce in cazul tetraciclinei se impune introducerea de inhibitori de clorurare (mercatotiadiazol, tiocarbamati). La obtinerea demetilclortetraciclinei si demetiltetraciclinei se introduc inhibitori de metilare (sulfadiazina). Mediul de cultura astfel pregatit se sterilizeaza si se inoculeaza cu tulpinele cele mai active. Fermentarea se realizeaza in tancuri succesive, controlandu-se permanent temperatura si pH-ul care trebuie sa fie apropiat de neutralitate.
Oprirea procesului se realizeaza prin racire, dupa care se izoleaza antibioticul prin diverse metode:
precipitare cu ioni de calciu si magneziu;
extractie cu alcool, acetat de etil sau etil-metil-cetona;
absorbtie pe coloane cu schimbatori de ioni.
Ultima etapa a biosintezei consta in purificarea antibioticului prin liofilizare, sub forma de baza sau cloralhidrat.
In aceasta categorie intra: aminoglicozide, macrolide, tetracicline, etc.
Acestea sunt active chiar fata de procariote.
Antibiotice aminoglicozidice: sunt antibiotice care contin glucide aminate cuplate cu legaturi glicozidice de alti aminoacizi: streptomicina, kanamicina, gentamicina, neomicina, etc. sunt considerate antibiotice de rezerva, fiind folosite in lipsa altora.
Macrolide:contin inele mari lactonice legate cu nucleu glucidic. Cele mai cunoscute sunt: eritromicina, oleandomicina, spiramicina. Eritromicina inlocuieste penicilina , in cazul pacientilor alergici la aceasta.
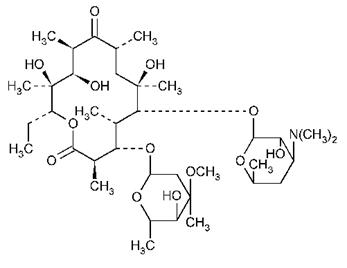
Eritromicina
In cazul eritromicinei sunt implicate peste 25 etape enzimatice.
in ultimii ani, ingineria genetica a facut eforturi considerabile legate de intelegerea principiilor si de punerea la punct a tehnicilor experimentate necesare identificarii si izolarii genelor, manipularii lor in vitro, clonarii si expresiei lor in celule-gazda corespunzatoare.
Conceptul de inginerie a genelor ('genetic ingineering') este utilizat pentru a desemna preocupari privind manipularea genelor, insertia genelor, ingineria plasmidelor, tehnologia genelor, etc.
Tehnicile prin care se realizeaza manipularea directa a ADN-ului prin clonare moleculara (tehnologia ADN recombinat), avand ca model transferul unor gene din celula animala in celule bacteriene cuprind mai multe etape:
- izolarea genelor naturale sau sinteza chimica a unor molecule de ADN, care codifica proteinele dorite;
- selectia unui 'vehicul' sau vector adecvat, capabil sa transforme genele respective si apt sa se replice autonom in celula receptoare;
- asigurarea conditiilor care permit exprimarea informatiei genetice straine in celula bacteriana;
- insertia genelor straine in structura genetica a moleculei vector si obtinerea unei himere moleculare;
- introducerea acesteia intr-o celula bacteriana si transformarea ei;
- selectarea celulelor modificate genetic din populatia de celule rezultate prin multiplicare.
Insulina este principalul hormon pancreatic si a fost descoperit in 1921 in paralel de fiziologul roman N. Paulescu si de canadienii Banting, Mac Leod si Best, acestia primind in 1923 premiul Nobel in fiziologie si medicina pentru izolarea insulinei si definirea rolului acesteia in diabetul zaharat. S-au elaborat procedee de fabricatie care permiteau extragerea insulinei din pancreasul de porcine si bovine iar firma Eli Lilly a fost prima care a comercializat insulina animala extrasa din pancreas (100 g insulina din o tona pancreas). In 1955 Sanger a stabilit structura chimica a insulinei: doua lanturi polipeptidice A si B formate din 21 si 30 de aminoacizi. In 1979 au fost sintetizate de Itakura genele corespunzatoare celor doua lanturi polipeptidice ale insulinei umane si astfel se dezvolta obtinerea insulinei biosintetice, realizandu-se cercetari farmacodinemice si experimentari clinice. Autoritatile competente au aprobat in 1982 comercializarea insulinei umane obtinuta prin tehnologia ADN recombinat. Aceasta insulina are aceeasi activitate ca si insulina inalt purificata din pancreasul bovin sau porcin si nu produce efectele secundare pe care le provoaca acestea.
In prezent exista doua procedee de obtinere a insulinei umane cu ajutorul bacteriilor modificate prin tehnologia clonarii genelor. Primul se bazeaza pe clonarea genelor corespunzatoare catenelor A si B ale insulinei sintetizate chimic si al doilea pe clonarea ADNc corespunzator proinsulinei (forma sub care se secreta insulina in pancreas = precursorul insulinei).
1. din structura insulinei mature s-a dedus structura genelor corespunzatoare in baza echivalentelor dictate de codul genetic. S-a stabilit ca pentru catena A a insulinei sunt necesare 63 de nucleotide inlantuite in mod specific iar pentru catena B 90 de nucleotide. In proiectul sintezei celor doua gene s-a mai prevazut atasarea la capetele lor a unor nucleotide care sa asigure cuplarea corecta a genelor de vector si prezenta semnalelor necesare pentru pornirea si oprirea exacta a transcrierii genelor. Cele doua gene astfel obtinute au fost inserate independent de catre un vector de clonare genetica. Moleculele de ADN recombinat rezultate au fost utilizate pentru transformarea celulelor de Escherichia coli, in care ADN-ul recombinat se replica si se sintetizeaza complexul β-galactozidaza-catena A a insulinei in celulele transformate cu ADN recombinat continand gena A si complexul β-galactozidaza-catena B in celulele transformate cu ADN recombinat continand gena B a insulinei. Cele doua catene ale insulinei sunt detasate de β-galactozidaza si dupa purificare se amescteca si prin simpla oxidare cu aer se cupleaza prin legaturi disulfurice si se obtine insulina
 2. obtinerea insulinei folosind
ADN recombinat ce contine gena pentru proinsulina are la baza
construirea unor plasmide care sa contina secventele
(genele) care codifica proinsulina sub forma ADNc (acid dezoxiribonucleic
complementar). ADN recombinat rezultat este utilizat pentru transformarea
bacteriilor Escherichia coli si celulele transformate produc o
proteina compusa din β-galactozidaza si
proinsulina, care elibereaza apoi proinsulina care va fi
convertita la insulina pe cale enzimatica.
2. obtinerea insulinei folosind
ADN recombinat ce contine gena pentru proinsulina are la baza
construirea unor plasmide care sa contina secventele
(genele) care codifica proinsulina sub forma ADNc (acid dezoxiribonucleic
complementar). ADN recombinat rezultat este utilizat pentru transformarea
bacteriilor Escherichia coli si celulele transformate produc o
proteina compusa din β-galactozidaza si
proinsulina, care elibereaza apoi proinsulina care va fi
convertita la insulina pe cale enzimatica.
Interferonii (IFN) au fost descoperiti in 1957 de catre cercetatorii englezi Aleck Isaacs si Jean Lindenman. Denumirea deriva de la fenomenul de interferenta virala observat de catre cei doi cercetatori. Initial au fost definiti ca substante proteice, elaborate de catre celule ca raspuns la infectia virala si care au proprietatea de a transfera altor celule rezistenta la agentul viral respectiv sau la alte virusuri. In 1986 Fradelizi includea interferonii in grupa imunohormonilor sau a limfokinelor pe baza proprietatii acestora de efectori celulari. In conceptia actuala fac parte din grupa citokinelor, substante responsabile de comunicarea intercelulara, cu rol in apararea antivirala si in modularea raspunsului imun.
Din punct de vedere structural interferonii sunt glicoproteine formate din 146-166 aminoacizi si lanturi polizaharidice cu acizi sialici terminali. La om exista cinci tipuri de interferoni: alfa, beta, gama, tau si omega. Cromozomul 9 contine genele pentru IFN alfa, beta, tau si omega iar pe cromozomul 12 se gasesc genele pentru gama. Se cunosc foarte multe tipuri si subtipuri de interferoni mai ales IFN alfa.
S-a aratat ca celulele produc constant prointerferon, iar inductia consta in stimularea formarii unui sistem activator ce converteste prointerferonul in interferon activ. A doua pentru biosinteza este ca interferonul este produs de novo. Informatia genetica pentru sinteza interferonului se gaseste la nivelul ereditar al celulelor, insa in mod normal sinteza lui este represata. Semnalul pentru sinteza IFN este ARN bicaternar si dublu spiralat, care apare in ciclurile de reproducere ale virusurilor animale. Formarea IFN are loc dupa contactul celulelor cu inductorii pentru IFN care sunt virali (virusuri, acizi nucleic, poliribonucleotide sintetice) sau non-virali (unele pirimidinone, unele antrachinone si fluorinone).
Principalele actiuni care arata utilitatea interferonilor sunt: actiunea antivirala, imunomodulatoare, antiproliferativa, antitumorala.
Initial tehnicile de obtinere pentru IFN s-au bazat pe producerea lui in culturi celulare (de leucocite, fibroblasti si limfocite transformate), dar cantitatile obtinute erau insuficiente si pretul de cost destul de ridicat. Ulterior s-a introdus tehnologia ADN recombinat care a rezolvat aceste probleme. Au aparut trei variante mai importante pentru productia industriala:
obtinerea interferonilor cu ajutorul bacteriilor cu genom modificat (procedeul Biogene);
obtinerea interferonilor cu ajutorul drojdiilor (procedeul Genentech Inc.);
obtinerea interferonilor cu ajutorul viermilor de matase (procedeu japonez).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |