Structura proteinelor
Comparativ cu acizii nucleici, proteinele sunt mult mai elastice ca structura. Ele deservesc multe roluri biochimice si biologice, mai ales in celula, drept componente enzimatice, elemente de structura. Multe din etapele metabolismului proteinelor sunt controlate si regularizare cu ajutorul enzimelor.
Fortele care vor stabili structura unei proteine sunt de tip covalent si necovalent.
Forte Van der Waals - forte necovalente care exprima atractia universala dintre doi atomi vecini. Ca marime, fortele Van der Waals sunt forte slabe, mult mai slabe decat fortele covalente, distantele fiind mai mari 3-4 Å. Totusi, prin cumulare, datorita numarului mare de interactiuni aceste forte pot capata un aspect cantitativ.
Forte hidrofobice - forte necovalente negative, datorat prezentei lanturilor hidrofobe in solutiile apoase. Aceste forte sunt printre cele care determina in mare masura structura unei proteine.
Forte electrostatice -fortele electrostatice determinand mai ales interactiuni intre doua lanturi peptidice cu sarcini diferite. Apa si ioni dizolvati in ea pot constitui "ecrane" pentru astfel de interactiuni, reducand astfel forta lor si distantele la care ar putea opera.
Dipol momentul - cauzat de perechi de sarcini distantate la distante mai mari, duce la aparitia unui camp electric. Este adesea utilizat de proteine pentru atragerea si pozitionarea substraturilor sau produsilor.
Legaturile de hidrogen - sunt interactiuni dipol-dipol in care sunt implicate molecule polare care contin hidrogen. Legaturile de hidrogen nu contribuie, in general, la stabilizarea neta a proteinei deoarece aceiasi grupare care formeaza legatura de hidrogen cu a alta molecula de proteina poate forma legatura de hidrogen cu apa in stare denaturata.
Distantele si unghiurile legaturilor covalente - sunt de fapt principalele proprietati care determina mentinerea moleculelor de proteine legate una de alta.
Proteinele pot fi constituite dintr-o singura polipeptida, sau din complexe de doua sau mai multe polipeptide. In functie de natura si tipul de asociere se pot distinge situatii de asociere a doua sau mai multe lanturi polipeptidice. Asocierea a doua polipeptide identice, formeaza un homo-dimer. Asocierea a doua polipeptide diferite formeaza un hetero-dimer. Complexul format de trei astfel de polipeptide se defineste trimer, cel cu patru tetramer si asa mai departe, pentamer, hexamer, etc. Deseori pentru a se descrie compozitia polipeptidelor se recurge la simboluri grecesti, aceasta nespunand insa nimic despre structura proteinei, asa cum se reprezinta mai jos.
|
Organizare subunitati |
Compozitie |
Exemplu |
|
ab |
Proteina constituita din doua lanturi polipeptidice separate, fiecare cu alta secventa de aminoacizi, deci heterodimer |
Insulina Lantul
'A' are 21 aminoacizi |
|
a2 |
Proteina constituita din doua lanturi polipeptidice separate dar identice, deci homodimer. |
Represor Lambda phage Cro Fiecare lant polipeptidic are 66 aminoacizi |
|
abg |
Proteina constituita din trei lanturi polipeptidice separate si diferite, deci heterotrimer |
Chimotripsina Lantul
a are13 aminoacizi Lantul b are 132 aminoacizi |
|
a2b2 |
Proteina constituita din patru lanturi polipeptidice separate si diferite, dar doua cate doua identice, deci un dimer de homodimeri |
g-Globulina Lantul
a are 214 aminoacizi |
La analiza peptidelor prin hidroliza acida, de obicei cu solutie 6N acid clorhidric prin fierbere, se pot determina cantitativ proportia din fiecare aminoacid dintr-o polipeptida. Exista insa unele probleme legate de acest mod de analiza a structurii cantitative a proteinelor si anume ca triptofanul este distrus, aspargina si glutamina sunt transformate in acid aspargic si acid glutamic, neputandu-se diferentia aportul acidului aspargic, respectiv asparginei, si la fel in cazul acidului glutamic si glutaminei. In consecinta, se pot determinata aproximativ ponderea aminoacizilor intr-o proteina, asa cum se exemplifica mai jos.
|
Aminoacid |
Concentratie in urma hidrolizei |
Concentratie normalizata |
Compozitie probabila |
|
Ala | |||
|
Cys | |||
|
Asx | |||
|
Glx | |||
|
Phe | |||
|
Gly | |||
|
His | |||
|
Ile | |||
|
Lys |
| ||
|
Leu | |||
|
Met | |||
|
Pro | |||
|
Arg | |||
|
Ser | |||
|
Thr | |||
|
Val | |||
|
Tyr | |||
|
Total aminoacizi: 127 |
|||
1. Structura primara
Structura primara este secventa de aminoacizi codata in acidul dezoxiribonucleic (ADN). Ea consta din forte peptidice covalente puternice care rar sunt rupte in operatii de procesare a alimentelor.
2. Structura secundara
Structurile locale sunt structuri ale periodicitatii structurale regionale care se intalnesc la o varietate de tipuri de proteine. Exista trei tipuri propuse pentru astfel de reprezentari:
a-helix, (elice a
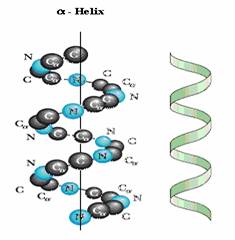
model spiralat, rezultat prin spiralarea catenei polipeptidice in jurul unui cilindru imaginar, fie in sensul acelor de ceasornic, a-helix de dreapta, fie in sens invers acelor de ceasornic, a-helix de stanga
Modelele pliate care pot aparea in doua variante. Primul caz este modelul paralel al structurilor pliate, caracteristic structurii structura b-keratinei

sau modelul antiparalel al structurilor pliate, caracteristic fibroinei din matase, in care capetele peptidice sunt asezate unul in fata celuilalt

3. Structura tertiara
Structurile secundare nu ascund suficient structurile hidrofobe si tind sa devina mai mult un detaliu decat o forta intrinseca. Este nevoie de o astfel de structurare incat partile hidrofobe sa fie si mai bine ascunse, partile hidrofile fiind cele expuse. "Impachetarea" biopolimerului pentru ca partile hidrofile sa fie cat mai expuse si partile hidrofobe sa fie cat mai "ascunse" se poate realiza in mod natural, prin ceea ce s-a definit a fi structura tertiara.
Structura tertiara reprezinta un nivel de organizarea rezultat in urma interactiunilor dintre resturile aminocizilor prezenti in polipeptide. Se sugereaza ca fiecare elice poate la randul ei sa se infasoare in jurul altei astfel incat sa apara conglomerate cu o arhitectura moleculara complexa asemanatoare unei funii formate din sapte fire torsoniate.
Mentinerea structurilor tertiare se realizeaza prin intermediul fortelor de atractie care apar intre radicalii din lanturile polipeptidice. Natura acestor forte poate fi de tipul:
fortelor de hidrogen, intre grupari OH fenolice (tirosina) alcoolice (serina) cu grupari carboxilice;
legaturi ionice, care apar intre grupe carboxilice ale aminoacizilor dicarboxilici si grupe aminice ale aminoacizilor diaminici, atunci cand distanta dintre grupari este cuprinsa intre 2-3 Å;
legaturi apolare de tip Van der Waal.
|
|
Doua imagini ale moleculei de b-lactoglogulina Se observa structura a-helix dar si cea pliata. De notat ca exista inca multe parti ale moleculei care nu adopta nici una din structurile definite de organizarea secundara ci au o structura oarecare. |
Aceasta diversitate de legaturi implicate in structurile biopolimerilor proteici determina labilitatea lor la o serie intreaga de factori externi sau celulari (pH, temperatura, presiune, reactanti chimici, etc.). Destramarea, chiar si in mica masura, a acestei organizari complexe, duce la pierderea proprietatilor biologice implicate de aceasta. Totusi se pot face modificari extrem de mici la astfel de structuri, de exemplu prin adsorptia unui compus cu masa moleculara simpla, fenomen ce poarta numele de efect alosteric, deosebit de important in activitatea enzimelor.
Structura secundara si tertiara au permis ca proteinele sa fie clasificate in doua mari clase: proteine fibrilare si proteine globulare. Pe langa acestea ar mai exista o clasa cu structura nedefinita.
Proteinele fibrilare au structura filiforma constituita din catene liniare, avand functii de sustinere si rezistenta mecanica. Reprezentanti ai acestei clase sunt proteine ca miozina, keratina din par, fibroina din matase.
Proteinele globulare contrar numelui, au forma tubulara cilindrica elipsoidala cu lungimea depasind 2-6 ori diametrul. Reprezentati ai acestei categorii sunt intalniti aproape in toate lichidele din organismul uman.
4. Structura cuaternara
Structura cuaternara a proteinelor reprezinta un mod superior de organizare si agregare a lanturilor polipeptidice care se realizeaza prin interventia acelorasi forte ca in formarea structurilor anterioare, dar interactiunile se refera acum la lanturi diferite. Cel mai citat exemplu in constituie hemoglobina, proteina transportatoare de oxigen din sange. Structura acesteia consta din patru secvente polipeptidice si patru grupe prostatice, denumite hem, care interactioneaza una cu cealalta formand structura globala.
|
|
Hemoglobina
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |