Chimia organica se poate defini cel mai simplu ca fiind chimia compusilor carbonului. Actul de "nastere" al chimiei organice este inca considerat anul 1828 cand Wöhler a sintetizat ureea din cianatul de amoniu:
NH4+ O-C N → H2N-CO-NH2
deoarece aceasta sinteza a dat o grea lovitura comunitatii stiintifice care mai era adepta a fortei vitaliste. In urmatorii 12 ani apar si se dezvolta laboratoare puternice in Germania si se pun bazele publicisticii stiintifice in domeniul chimiei organice (Justus Liebigs Annalen der Chemie). Chimia organica explodeaza pur si simplu dupa anul 1860. In numai 30 de ani s-au pus la punct metodele de analiza elementala precum si o intreaga industrie de aparatura de laborator. Totusi marile descoperiri ale chimiei s-au realizat doar cu mijloacele modeste ale secolului XIX (care in prezent ni se par rudimentare). O data cu cresterea spectaculoasa a numarului de compusi sintetizati si a circulatiei tot mai intense a revistelor de specialitate a aparut si nevoia sistematizarii materialului faptic si a corelarii structurii cu proprietatile substantelor nou sintetizate. O contributie majora au avut-o Dumas si Butlerov. S-a observat ca pe langa carbon, compusii organici mai contin si alte elemente mereu prezente in compusii (din materia vie) izolati, purificati si caracterizati. Totalitatea acestor elemente mereu prezente in acesti compusi sunt denumite elemente organogene (C, H, N, O, S, P, F, Cl, Br). In incercarea de sistematizare a compusilor organici s-a observat ca acestia pot fi formal obtinuti din hidrocarburi prin inlocuirea atomilor de hidrogen cu elemente organogene. De aceea poate chimia organica a fost definita inca din sec. XIX ca fiind chimia hidrocarburilor si a derivatilor acestora.
Hidrocarburile saturate care sunt componente ale titeiului s-au remarcat ca fiind lipsite de reactivitate de unde si denumirea de parafine (o alta intrebuintare decat cea legata de arderea lor sau folosirea ca solventi nici nu se prea intrevedea). O data insa ce un atom de oxigen a fost inserat intre un hidrogen si un atom de carbon dintr-o banala hidrocarbura insolubila in apa si nereactiva precum etanul, aceasta "noua hidrocarbura" ce contine doar un atom de oxigen in plus are cu totul alte proprietati. Hidrocarbura a capatat o functiune chimica. Astfel substantele organice se clasifica in hidrocarburi si substante cu functiuni. S-a aratat ulterior ca atomii sau gruparile de atomi care sunt sediul proprietatilor speciale aduse "hidrocarburii", pot fi la rindul lor sistematizate, iar aceste "sedii" au fost denumite grupari functionale.Astfel un numar impresionant de substante organice au putut fi sistematizate dupa caracteristica imprimata de aceste grupari functionale. Cele mai importante grupari functionale sunt prezentate in Tabelul 1 (a, b, c).
Tabel 1 a. Grupari functionale formate numai din atomi de carbon
|
Formula grupa functionala |
Clasa |
Exemplu |
Denumire IUPAC |
Denumire comuna |
|
|
Alchene |
H2C=CH2 |
Etena |
Etilena |
|
|
Alchine |
HC CH |
Etina |
Acetilena |
|
|
Arene |
C6H6 |
Benzen |
Benzen |
Tabel 1 b. Grupari functionale cu heteroatomi, monovalente
|
Formula grupa functionala |
Clasa |
Exemplu |
Denumire IUPAC |
Denumire comuna |
|
|
Derivati halogenati |
H3C-I |
Iodometan |
Iodura de metil |
|
Alcooli |
CH3CH2OH |
Etanol |
Alcool etilic |
|
|
Eter |
CH3CH2OCH2CH3 |
Dietil eter |
Eter |
|
|
|
Amine |
H3C-NH2 |
Aminometan |
Metilamina |
|
Nitro derivati |
H3C-NO2 |
Nitrometan | ||
|
Tiol |
H3C-SH |
Metanetiol |
Metil mercaptan |
|
|
Sulfuri |
H3C-S-CH3 |
Dimetil sulfura |
Dimetiltioeter |
Tabel 1c. Grupari functionale cu heteroatomi polivalente
|
Formula grupa |
Clasa |
Exemplu |
Denumire IUPAC |
Denumire |
|
|
Aldehide (R*=H) Cetone (R*=Alc,Ar) |
H3CCHO CH3COCH3 |
Etanal Propanona |
Acetaldehida Acetona |
|
|
Acizi carboxilici |
CH3COOH |
Acid etanoic |
Acid acetic |
|
|
Esteri |
CH3COOC2H5 |
Etanoat de etil |
Acetat de etil |
|
|
Amide |
H3CCONH2 |
Acetamida |
Amida acidului acetic |
|
|
Cloruri acide |
H3CCOCl |
Clorura de etanoil |
Clorura de acetil |
|
|
Anhidride |
CH3CO-O-COCH3 |
Anhidrida acetica |
Anhidrida acetica |
|
|
Nitrili |
CH3CN |
Etannitril |
Acetonitril |
Determinarea structurii substantelor organice este importanta intrucat permite elaborarea metodelor de sinteza a acestora dar si realizarea unor previziuni cu privire la proprietati si utilizari. Etapele parcurse in mod obisnuit sunt:
1. Analiza elementara: - calitativa
- cantitativa.
2. Determinarea formulei procentuale.
3. Determinarea formulei brute
4. Determinarea formulei moleculare
5. Determinarea formulei structurale
In locul metodelor chimiei clasice de stabilire a structurii, ce necesita timp si cantitati apreciabile de substanta, astazi se folosesc metode spectrale rapide, automatizate, care utilizeaza cantitati infime de substanta (1mg- 1 g sau chiar mai putin).
Determinarea structurii prin metode spectrale se bazeaza pe interactiunea materiei cu energia, energie ce este absorbita sau emisa de molecule, in portiuni bine determinate, numite cuante si a carei corelare cu structura interna a moleculelor este cunoscuta.
![]()
unde : ν - frecventa radiatiei
![]() - numarul de unda
- numarul de unda
h- constanta lui Planck
c- viteza luminii in vid
λ - lungimea de unda
E si E' sunt nivele energetice cuantificate ale moleculei.
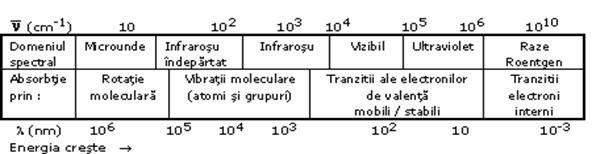
Absorbtia unei cuante electromagnetice determina imbogatirea energetica a moleculelor care trec din starea lor fundamentala intr-o stare excitata. Revenirea la starea initiala se face prin emisia de cuante de energie. Spectrul unei substante este o reprezentare grafica a intensitatii luminii abosrbite sau emise in functie de frecventa sau numarul de unda al radiatiei. Fiecare substanta are un spectru caracteristic, o 'amprenta', fapt ce permite determinarea structurii acesteia. In functie de radiatia absorbita molecula sufera diferite tranzitii care pot fi surprinse de "ochiul" aparatelor moderne dar nu pe intreg spectrul de energii. Corelarea domeniilor acestor energii cu metoda de investigatie este prezentata in Tabelul 2.
Tabelul 2. Domenii spectrale si metode spectrometrice aferente
Substantele formate din molecule care au aceeasi formula si care au atomii legati in acelasi mod intre ei sunt identice. Substantele formate din molecule cu aceeasi formula dar cu atomii legati in mod diferit intre ei, sunt izomere ( iar fenomenul poarta numele de izomerie). Izomeria poate fi de mai multe tipuri si este prezentata schematic in Figura 1:

Figura 1. Clasificarea principalelor tipuri de izomeri
Izomeria compusilor organici nu va fi tratata in totalitate dar se vor prezenta cateva aspecte care sa ilustreze cateva categori de izomeri.
A. Izomeri de constitutie. Acesti izomeri se caracterizeaza prin succesiunea diferita a atomilor sau a legaturilor in molecula. Ei pot fi:
- izomeri de functiune (inclusiv tautomerii) - difera intre ei prin gruparea functionala. De exemplu :
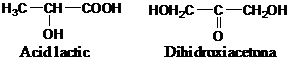
- izomeri de catena - difera intre ei prin tipul catenei (dreapta, ramificata, ciclica). De exemplu perechile izomere ciclice sau aciclice corespunzatoare formulei C4H8 :
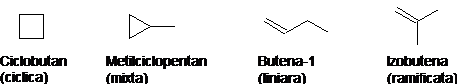
izomeri de pozitie - difera prin locul ocupat de un susbtituent pe un nucleu sau legatura multipla pe catena. De exemplu :
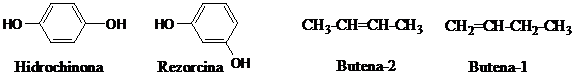
- izomeri de valenta - contin aceleasi grupari de atomi legate insa in mod diferit.
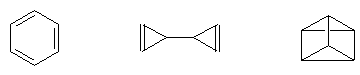
B. Stereoizomeri sau izomeri spatiali - sunt compusi cu constitutie identica dar se deosebesc intre ei prin aranjamentele spatiale ale atomilor. Prin configuratia unei molecule se intelege aranjarea atomilor in spatiu ( nu se iau in consideratie aranjamentele reciproce intre grupari de atomi ca urmare a rotirii in jurul simplei legaturi). O configuratie moleculara poate prezenta mai multe conformatii, insa conformerii unei molecule au intotdeauna aceeasi configuratie.
Enantiomeria sau izomeria de oglindire este caracteristica tuturor substantelor care se pot prezenta sub forma a doi enantiomeri (antipozi optici). Cei doi enantiomeri se deosebesc unul fata de celalalt ca si obiectul si imaginea sa de oglindire. Acesti izomeri nu sunt superpozabili (chiralitate) Figura 2.
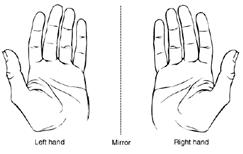
Figura 2.Relatia obiect-imagine de oglindire. Cele doua maini nu se pot suprapune.
Enantiomerii au toate proprietatile identice,exceptand comportarea lor fata de lumina plan-polarizata si fata de substantele optic active. Enantiomerii configurationali au configuratii diferite:
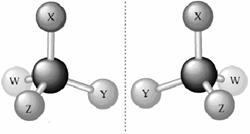
Enantiomerii conformationali sunt conformeri, ei isi datoreaza chiralitatea impiedicarii rotatiei libere in jurul unor legaturi simple. Un astfel de exemplu il constitue atropzomerii:

Pentru a defini structura enantiomerilor se folosesc regulile (CIP) de stabilire ale prioritatii substituentilor, gruparilor elaborate de Cahn, Ingold si Prelog
Diastereoizomeria sau izomeria de distanta incadreaza toate tipurile de stereoizomeri care nu sunt enantiomeri, adica toti stereoizomerii care difera intre ei prin valorile distantelor interatomice dintre atomii nelegati direct. Diastereomerii difera intre ei prin punct de topire, punct de fierbere, indice de refractie, spectrele in IR, UV, VIS, NMR, MS, etc. Un exemplu il constitue substantele cu doi atomi de carbon asimetrici diferiti care pot prezenta patru structuri cu configuratii diferite:

in care perechile I,II si III,IV sunt in relatie de enantiomerie; dar I,III ; I,IV ; II,III ; si II,IV sunt perechi de diastereomeri.
Izomerii geometrici apar ca o consecinta a impiedicarii liberei rotatii in jurul unei duble legaturi (C=C, C=N, N=N) si deci compusii ce contin astfel de duble legaturi sau compusii carbociclici sau heterociclurile saturate se incadreaza in aceasta categorie a diastereomerilor. Cei mai des intalniti sunt izomerii geometrici. Acestia difera intre ei prin prin configuratie :
cis - indica pozitia de aceeasi parte a planului legaturii duble sau ciclului a substituentilor identici (sau cu prioritate maxima, daca se aplica regula CIP).
trans - indica pozitia de o parte si de alta a substituentilor cu prioritate maxima, fata de planul legaturii duble sau ciclului.
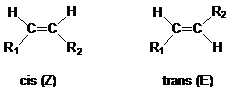
Substantele organice, naturale sau sintetice, sunt in permanenta valorificate in scopul imbunatatirii calitatii vietii si confortului zilnic. Aceasta valorificare presupune o multime de transformari chimice variate si aparent foarte greu de retinut. Totusi analiza atenta a carteristicilor fundamentale a acestor transformari le permit incadrarea in cateva tipuri mari de reactii. Acestea sunt :
- reactii de substitutie (S)
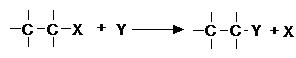
- reactii de aditie (A)
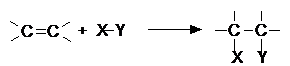
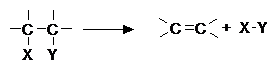
- reactii de eliminare (E)
- reactii de transpozitie (T)

Daca amintim si de reactiile de oxidare si reducere putem avea un tablou destul de complet al tipurilor de transformari cu care opereaza chimistul organician. Din punct de vedere al mecanismului, reactiile de substitutie si aditie, pe care le vom intalni cel mai des in expunerea proprietatilor compusilor organici sunt:
1) nucleofile (N) - in care, nucleofilul (de obicei un ion negativ sau un atom cu perechi de electroni neparticipanti) executa primul atac in etapa determinanta de viteza asupra unui centru de reactie polarizat pozitiv;
2) electrofile (E) - in care, electrofilul (de obicei un ion pozitiv sau o substanta cu deficit de electroni) executa primul atac in etapa determinanta de viteza, asupra unui centru de reactie cu densitate electronica marita;
3) radicalice (R) - ce se desfasoara prin intermediul unor radicali.
Substituentii prezenti in imediata vecinatate a centrului de reactie pot mari sau micsora densitatea electronica la acesta, prin efecte electronice sau pot sa impiedice accesul unui reactant la acesta prin efecte sterice.
Efectele electronice reprezinta deplasari ale electronilor implicati in legaturi covalente spre unul din cei doi atomi ai legaturii fapt ce determina aparitia in molecula organica a unor sarcini electrice raspunzatoare de transformarile ulterioare ale moleculei.
Efectul inductiv (poate fi +I sau -I) se manifesta prin deplasari ale electronilor σ iar efectul electromer (poate fi +E sau -E) prin deplasari ale electronilor π sau p.
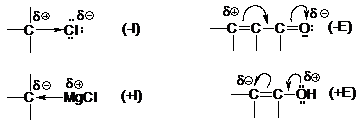
Exemple de efecte electronice
Efectul steric consta in impiedicarea unor reactanti de a accede la pozitii privilegiate ale moleculei, de catre diferiti substituenti voluminosi. Exemplu: in t-butil-benzen, pozitiile orto au o reactivitate micsorata fata de reactantii electrofili, comparativ cu pozitia para.

|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |