Cinetica chimica este ramura chimiei care se ocupa cu studiul vitezelor reactiilor chimice si cu mecanismele prin care reactantii sunt transformati in produsi. In timp ce termodinamica chimica poate oferi informatii asupra posibilitatii realizarii unei transformari chimice, cinetica furnizeaza informatii asupra vitezei cu care decurge transformarea chimica. Factorii care influenteaza vitezele de reactie sunt:
natura substantelor care reactioneaza;
concentratiile substantelor care reactioneaza;
temperatura la care are loc reactia;
prezenta unui catalizator.
Viteza de reactie se poate defini ca fiind cantitatea de substanta dintr-o unitate de volum care sufera o transformare in unitatea de timp (secunda, minut, ora, zi). Viteza de reactie este o marime variabila deoarece pe masura ce reactia avanseaza reactantii sunt consumati, iar produsii se formeaza in cantitati din ce in ce mai mari. Consideram o reactie de forma:
A + B → C
in care concentratiile speciilor chimice prezente, exprimate in mol/l sunt notate cu [A], [B] si respectiv [C]. Viteza de reactie se poate exprima fie ca viteza de formare a produsului C fie ca viteza de consumare a unuia dintre reactanti (A sau B):
vC = d[C]/dt respectiv vA = - d[A]/dt
In acest caz particular , datorita stoichiometriei reactiei vitezele de aparitie a lui C sau de disparitie a lui A sunt egale.
Daca stoichiometria reactiei este mai complicata relatiile intre vitezele de aparitie a produsului respectiv de disparitie a reactantilor vor fi afectate de coeficientii stoichiometrici asa cum va rezulta in continuare. Sa consideram o urmatoarea reactie:
A +3 B → 2C
Atunci intre vitezele de aparitie si disparitie a produsului de reactie respectiv al reactantilor exista urmatoarea relatie:
- d[A]/dt = -1/3(d[B]/dt) = ˝( d[C]/dt)
Masurarea unei viteze de reactie presupune colectarea de date ce privesc compozitia amestecului de reactie in chiar timpul desfasurarii reactiei. Acest deziderat este realizat prin:
a) Prelevarea de mici esantioane din amestecul de reactie la intervale regulate de timp si analiza acestora pentru determinarea concentratiei fie a unui reactant fie a unui produs de reactie
b) Stoparea reactiei prin:
- racirea brusca a amestecului de reactie;
- diluarea amestecului de reactie cu exces de solvent;
- anihilarea rapida a unuia dintre reactanti (ex. daca e acid cu o baza) urmata de determinarea concentratiei fie a unui reactant, fie a produsului de reactie.
Viteza de reactie trebuie privita ca o marime instantanee determinata de variatia concentratiei reactantilor (sau produsilor) Δc intr-un interval scurt de timp Δt.
Pentru exemplificare vom considera reactia de descompunere a acidului 2,4,6-trinitrobenzoic in trinitrobenzen si dioxid de carbon, care decurge dupa ecuatia:
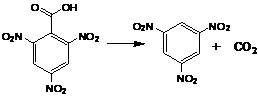
Desfasurarea procesului este urmarita prin prelevarea de probe, in care se determina variatia aciditatii amestecului de reactie prin dozarea rapida a acidului 2,4,6-trinitrobenzoic nereactionat. Datele obtinute sunt prezentate in Tabelul 8
Tabelul 8 Figura 54
|
|
Prin reprezentarea grafica a variatiei cantitatii de reactant prezenta in unitatea de volum in functie de timp se obtine o curba asa cum este prezentata in Figura
Prin calcularea raportului Δc/Δt la diferite intervale de timp pe baza curbei obtinute, se poate determina viteza de reactie pentru un anumit interval de timp foarte scurt Δt. Daca acest interval tinde spre zero se poate determina viteza instantanee de reactie la un anumit timp t.
Doua teorii asupra vitezelor de reactie:
a) Teoria ciocnirilor.
b) Teoria complexului activat.
Teoria ciocnirilor se bazeaza pe faptul ca
a) reactia dintre doua molecule are loc numai in urma ciocnirii acestora, cu conditia ca ciocnirea sa aiba o anumita violenta minima si
b) viteza reactiei este determinata de numarul de astfel de ciocniri violente care au loc in unitatea de volum si de timp.
Teoria complexului activat se bazeaza pe stabilirea unui echilibru intre moleculele care reactioneaza si intre un complex de asociatie cu energie foarte inalta, care contine ambele molecule si in interiorul caruia are loc redistribuirea norului electronic. Viteza de reactie este determinata de concentratia acestui complex si de viteza cu care el se descompune.
Teoria ciocnirilor. Pentru ca o reactie sa aiba loc intre doua molecule, acestea trebuie sa vina in contact-adica sa aiba loc o ciocnire intre ele. Pe baza teoriei cinetice a gazelor se poate calcula frecventa ciocnirilor intre moleculele gazoase. S-a gasit insa ca vitezele experimentale de reactie sunt de cateva mii de ori mai mici decat viteza de ciocnire. In plus, pentru o crestere a temperaturii cu 10 grade, frecventa ciocnirilor creste doar cu 1% sau chiar mai putin, in timp ce vitezele de reactie pot creste de doua ori sau chiar mai mult.
Teoria ciocnirilor explica aceasta neconcordanta, aratand ca nu este de ajuns ca moleculele sa se ciocneasca pentru a se produce o reactie; trebuie ca ciocnirea sa fie suficient de violenta, sa aiba o energie de cel putin 40 pana la 240 KJ pentru fiecare mol de astfel de ciocniri. Energia de activare este energia minima inmultita cu numarul lui Avogadro Eact = N Emin. Ea reprezinta energia frontala minima pentru un mol de ciocniri necesar pentru ca la ciocnire sa aiba loc o reactie.
Pentru reactiile de ordinul al doilea numarul de ciocniri violente este mai mare decat cel care corespunde vitezei observate experimental, ceea ce sugereaza ca sunt impuse si alte restrictii decat ciocnirea cu o anumita violenta minima. O astfel de restrictie ar putea fi ca moleculele sa se ciocneasca numai intr-o anumita orientare. Deoarece o astfel de orientare nu reprezinta decat una dintre foarte multele orientari, viteza de reactie poate fi mult micsorata.
Legea de viteza se determina experimental. Pentru stabilirea acesteia trebuie identificati toti produsii, toti intermediarii si eventual reactiile secundare ce insotesc procesul urmarit.
Fie reactia: A + B → C
Experimental s-a stabilit ca viteza de reactie depinde de concentratia ambilor reactanti printr-o expresie de forma:
v = k [A].[B] (*)
Coeficientul de proportionalitate k se numeste constanta de viteza si constituie o masura a efectului altor factori decat concentratia (temperatura, catalizatorul, natura reactantilor) asupra vitezei de reactie. O astfel de ecuatie este denumita legea de viteza sau inca ecuatia cinetica. Puterea la care se afla concentratia unui reactant din expresia legii de viteza reprezinta ordinul de reactie in raport cu acel reactant (ordin partial de reactie). O reactie in care legea de viteza este data de ecuatia (*) este de ordinul intai in raport cu reactantul A si de ordinul intai in raport cu reactantul B. Ordinul total de reactie este dat de suma ordinelor partiale de reactie. Pentru cazul particular descris de legea de viteza (*) ordinul total de reactie este egal cu 2.
Precizari
a) Atunci cand viteza de reactie nu depinde de concentratia nici unui reactant, reactia este de ordin 0 si expresia legii de viteza este:
v = k
b) Unitatile in care se exprima k se aleg in asa fel incat sa converteasca intotdeauna produsul de concentratie in concentratie per unitate de timp (mol/l.s).
c) Ordinul partial sau chiar total de reactie poate sa nu fie un numar intreg ci fractionar.
d) Legea de viteza nu poate fi dedusa direct din stoichiometria reactiei, ea se determina intotdeuna experimental.
e) Doar in unele cazuri legea de viteza reflecta stoichiometria reactiei.
f) Legile de viteza sunt exprimate prin ecuatii diferentiale si de aceea trebuiesc integrate pentru a obtine forma explicita a expresiei ce arata dependenta concentratiei in functie de timp. In Tabelul 9 sunt prezentate cateva exemple ale formelor integrate ale ecuatiilor cinetice:
Tabelul 9. Legi de viteza
|
Reactie exemplu |
ordinul* de reactie |
Legea de viteza |
Legea de viteza diferentiala |
Legea de viteza integrata |
|
A →B |
v = k |
d[A] = k. dt |
[A] = kt |
|
|
A +B→C |
I |
v = k [A] |
d[A]/[A] = -k.dt |
ln([A]/[A0])=-kt |
|
A +B→C |
II |
v = k [A]2 |
d[A]/[A]2 = -k.dt |
[A] = [A0]/(1+kt[A0]) |
*Se cunosc de asemenea si reactii de ordinul III.
O marime utila in aprecierea vitezei unei reactii chimice este timpul de injumatatire (t1/2), care reprezinta timpul in care concentratia reactantului scade pana la jumatate din valoarea sa initiala. Pentru a calcula timpii de injumatatire ai reactiilor de ordin I si II care au legea de viteza ca cea prezentata in Tabelul 9, se inlocuieste in expresia legii de viteza integrata [A] cu [A0/2] obtinandu-se pentru reactiile de ordinul:
unu, t1/2 = ln2/k
doi, t1/2 = 1/k[A0]
Se observa imediat ca in cazul reactiilor de ordinul I, timpul de injumatatire t1/2 este independent de concentratia initiala a reactantului !
S-a observat in majoritatea cazurilor ca ridicarea temperaturii accelereaza viteza de transformare a reactantilor in produsi. Tot experimental s-a aratat ca aceasta dependenta se exercita prin constanta de viteza iar ecuatia care exprima dependenta (numita si ecuatia lui Arrhenius) este de tip exponential:
k= A e-Ea/RT (*)
Unde: A - este factorul preexponential sau inca factor de frecventa
Ea - energia de activare
R - constanta generala gazelor
T - temperatura exprimata in oK
 A si Ea se mai
numesc si parametrii Arrhenius.
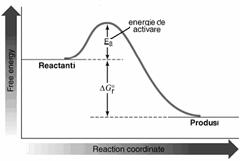
Marimea Ea se mai numeste
si energia de activare Gibbs si reprezinta energia minima pe care trebuie sa o aiba reactantii
pentru a forma produsii de reactie (Figura 55
A si Ea se mai
numesc si parametrii Arrhenius.
Marimea Ea se mai numeste
si energia de activare Gibbs si reprezinta energia minima pe care trebuie sa o aiba reactantii
pentru a forma produsii de reactie (Figura 55
Figura 55. Diferenta intre energia de activare si variatia energiei libere de reactie
Marimea e-Ea/RT poate fi interpretata ca reprezentand fractiunea de ciocniri care au energia suficienta pentru a produce reactia, in timp ce factorul preexponential ar reprezenta viteza cu care au loc ciocnirile indiferent de energia acestora.
Cunoscand dependenta constantei de viteza de temperatura se poate stabili energia de activare pentru o reactie data printr-o metoda grafica. Pentru aceasta se logaritmeaza relatia care devine:
ln k = lnA + (-Ea/RT) lne => ln k = lnA - Ea/RT
si se reprezinta grafic dependenta lnk (pe ordonata) functie de 1/T (abscisa) asa cum se prezinta in Figura . Se obtine o dreapta din a carei panta (tgα = -Ea/R) se poate calcula energia de activare, R fiind cunoscuta.
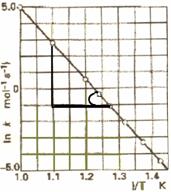
Figura 56. Determinarea prin metoda grafica a energiei de activare
Majoritatea reactiilor se desfasoara intr-o succesiune de etape numite reactii elementare deoarece implica una, maximum doua specii reactante (molecule, atomi sau ioni). Numarul de molecule (atomi, ioni) care participa simultan intr-o reactie elementara reprezinta molecularitatea reactiei. Reactia de descompunere a tetroxidului de azot este un exemplu de reactie monomoleculara.
N2O4 = 2 NO2
Reactia de sinteza a acidului clorhidric, este un exemplu de reactie binmoleculara:
Cl + H2 = HCl + H
Succesiunea de reactii elementare ce conduc de la reactanti la produsi constitue mecanismul de reactie al reactiei respective. In unele situatii produsul de reactie devine reactant intr-o noua reactie, in acest caz vorbim de reactii consecutive
A → B → C
Fie kA constanta de viteza din legea de viteza a transformarii lui A in B si kB , constanta de viteza din legea de viteza a transformarii lui B in C. Expresia legii de viteza ce descrie formarea compusului C este relativ complicata. Daca insa kB >> kA, altfel spus, transformarea lui A in B este mult mai lenta decat a lui B in C, viteza de formare a lui C depinde numai de cea mai mica dintre cele doua constante de viteza, adica de kA. In acesta situatie etapa A→B se numeste etapa determinanta de viteza. Reactii consecutive se intalnesc in principal in dezintegrarile radioactive si in caile metabolice ale metabolismului bazal.
Catalizatorii sunt substante care modifica viteza reactiilor chimice iar la sfarsitul reactiei se regasesc cantitativ neschimbati. Catalizatorii pot fi metale, oxizi metalici, acizi, baze, saruri sau enzime. Acestea din urma au o eficacitate pe care nici un catalizator sintetic nu a atins-o, marturie fiind rezultatele ilustrate in Tabelul 10 care privesc reactia de descompunere a apei oxigenate in apa si oxigen: H2O2 → H2O + 1/2O2.
Tabelul 10. Efectul catalizatorilor asupra reactiei de descompunere a H2O2
|
Catalizator |
Viteza de reactie relativa |
Energie de activare (kcal/mol) |
|
Fara catalizator | ||
|
Ioduri |
8 x 102 | |
|
Platina |
2 x104 | |
|
Catalaza |
3 x 1011 |
Reactia a carei viteza este influentata de prezenta catalizatorului este o reactie catalitica. Daca catalizatorul se afla in aceiasi faza cu reactantii si produsii de reactie atunci catalizatorul este omogen iar cataliza este omogena. Daca catalizatorul se afla in alta faza decat reactantii si produsii de reactie atunci catalizatorul este heterogen iar cataliza este heterogena.
Modul de actiune al catalizatorilor: daca energia de activare a unei reactii este mare, constanta de viteza este mica si numai o mica parte din ciocnirile moleculare conduc la produsii de reactie. Catalizatorul micsoreaza energia de activare a reactiei, marind astfel valoarea constantei de viteza si implicit viteza de desfasurare a reactiei. (Figura 56)
|
|
|
Figura 56. Catalizatorul micsoreaza energia de activare a reactiei
Daca reactia catalizata este de echilibru, atunci catalizatorul va accelera atait reactia directa cat si reactia inversa. Catalizatorii nu modifica pozitia echilibrului chimic si accelereaza doar reactiile care sunt termodinamic posibile.
Fie reactia : R ↔ P. In cazul in care produsul de reactie are actiune catalitica asupra propriei lui formari spunem ca reactia este autocatalizata. In expresia legii de viteza apare explicit concentratia produsului:
v = k[R] [P]
Reactiile autocatalizate apar ca etape in reactiile oscilante, reactii care respecta mecanismul Belousov Zhabotinski si care se intalnesc in caile metabolice importante (glicoliza de exemplu).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |