IZOTOPI SI UTILIZARILE LOR
ISTORIC
In teoria atomica, impusa de John Dalton in 1801, al doilea postulat preciza: 'Atomii aceluiasi element sunt identici unul cu altul si au aceeasi masa'. Acest principiu a fost unanim acceptat timp de un secol. Singurul aspect care contrazicea acest principiu il reprezenta inversiunea de ordine in sirul maselor atomice ale elementelor. Astfel, argonul, cu masa atomica 39,948, are numarul atomic 18, fata de potasiu, care are numarul atomic 19 si masa atomica 39,102; situatii similare se intalnesc in cazul cuplurilor cobalt - nichel, telur - iod si toriu - protactiniu.
Dovezi privind existenta izotopilor a produs studiul radioactivitatii metalelor grele, descoperita de Henry Becquerell in 1896. Studiile efectuate de sotii Curie au dus la descoperirea a doua elemente noi, caracterizate de radioactivitate inalta: poloniul si radiumul. In 1910 a devenit clar ca anumite procese radioactive pot duce la transformarea unui element in altul. Studiile lui Sir Ernest Rutherford asupra transformarilor radioactive au condus inevitabil la concluzia ca exista specii atomice identice in ceea ce priveste proprietatile lor chimice, dar cu mase diferite. Acest lucru a fost confirmat de obtinerea de plumb din surse radioactive, care, desi perfect pur, prezenta mase atomice care difereau prin valori imposibil de explicat prin eventuale erori experimentale. Cel care a denumit izotopi speciile atomice ce difera ca masa, dar sunt identice chimic, ocupand deci acelasi loc in tabelul periodic, a fost chimistul englez Frederick Soddy, in 1913. Denumirea lor provine de la cuvintele grecesti isos, insemnand 'acelasi' si topos, insemnand 'loc' Nu mult dupa acceptarea existentei izotopilor in cazul metalelor grele, au aparut indicatii cu privire la existenta izotopilor si in cazul elementelor stabile, lipsite de radioactivitate. Generalizarea acestei teorii asupra elementelor care nu prezinta radioactivitate a avut loc ulterior, ca urmare a studiilor lui J. J. Thomson, efectuate in 1913. Pe baza experimentelor lui Thomson, in 1919 William Aston construieste primul spectrograf de masa. In principiu, un spectrograf de masa este compus dintr-o sursa de ioni, sub forma de fascicol liniar, care este deviat de la traiectoria rectilinie de un sistem combinat de campuri electrice si magnetice (Figura 1). Devierea este cu atat mai mare cu cat masa este mai mica, respectiv cu cat raportul sarcina/masa este mai mare. Spectrele obtinute, in cazul elementelor care prezinta izotopi, sunt caracterizate de doua sau mai multe linii spectrale, in functie de numarul de izotopi ai respectivului element.
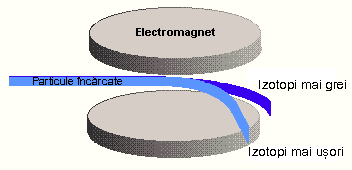
Figura 1 Principiul spectrografului de masa
Cu ajutorul spectrografului de masa Aston a descoperit 213 izotopi ai elementelor neradioactive.
DEFINI}II
|
Izotopii sunt specii de atomi care au acelasi numar de protoni in nucleu, diferind prin numarul de neutroni, deci prin numarul de masa. Denumirea acestora se face indicand in stanga simbolului elementului corespunzator numarul atomic si numarul de masa: Cei trei izotopi ai litiului, caracterizati de acelasi numar de protoni, dar cu numar diferit de neutroni (3, 4 si respectiv 5) sunt prezentati in Figura 2. |
|
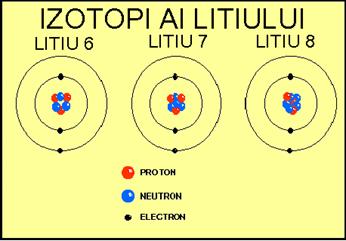
Figura 2
Termenul de nuclizi este utilizat
pentru a descrie anumiti izotopi, in special in cazul in care se urmareste
sublinierea proprietatilor nucleare, si mai putin a celor chimice. Termeni
utilizati frecvent in asociere cu anumite particularitati ale structurii nucleului
sunt: izotoni - izotopi ai diferitelor elemente cu acelasi numar de
neutroni (![]() si
si ![]() sunt izotoni, deoarece
ambii au cate 20 de neutroni in nucleu); izobari - izotopi ai
diferitelor elemente cu acelasi numar de masa (
sunt izotoni, deoarece
ambii au cate 20 de neutroni in nucleu); izobari - izotopi ai
diferitelor elemente cu acelasi numar de masa ( ![]() si
si ![]() sunt izobari, deoarece
clorul are 17 protoni si 20 neutroni, deci 37 nucleoni, ca si argonul, care are
18 protoni si 19 neutroni) si izomeri - izomeri identici din toate
punctele de vedere cu exceptia continutului energetic al nucleului si modul in
care se dezintegreaza radioactiv (cel dintai exemplu de izomerie nucleara
a fost dat de O. Hahn la elementul protactiniu).
sunt izobari, deoarece
clorul are 17 protoni si 20 neutroni, deci 37 nucleoni, ca si argonul, care are
18 protoni si 19 neutroni) si izomeri - izomeri identici din toate
punctele de vedere cu exceptia continutului energetic al nucleului si modul in
care se dezintegreaza radioactiv (cel dintai exemplu de izomerie nucleara
a fost dat de O. Hahn la elementul protactiniu).
Printre elementele cu cei mai multi izotopi se afla plumbul, cu 10, si xenonul, cu 9 izotopi.
Nu toate elementele prezinta mai multi izotopi, 21 fiind monoizotopice. Dintre cele care exista intr-o singura forma (sau care prezinta in mare majoritate un anumit izotop) se pot enumera: beriliul, fluorul, sodiul, aluminiul, fosforul, scandiul, magneziul, cobaltul, arsenul, itriul, niobiul, rodiu, iodul, cesiul, praseodimul, terbiul, aurul si bismutul. Aproape toate au Z impar.
Fenomenul de izotropie explica existenta maselor atomice fractionare ale elementelor. Proportia de izotopi care intra in alcatuirea unui element mixt natural este intotdeauna aceeasi, indiferent de originea lui .
Ca a urmare numarului identic de protoni din nucleu, izotopii unui aceluiasi element sunt caracterizati de proprietati extrem de asemanatoare, ceea ce face ca separarea lor sa fie dificila. Printre metodele care permit separarea izotopilor se pot enumera:
distilarea fractionata, bazata pe faptul ca acei compusi ce contin izotopi mai grei au tensiune de vapori mai mica;
centrifugarea, care se bazeaza pe diferenta de masa - moleculele mai grele se vor aduna la periferie;
termodifuziune, care are la baza distributia moleculelor dupa masa intr-un amestec gazos continut intre doi pereti verticali, dintre care unul mai cald si unul mai rece;
difuziunea prin pereti porosi, care are la baza inversa proportionalitate intre viteza de curgere a unui gaz printr-un orificiu ingust cu densitatea acestuia;
separarea electromagnetica, care utilizeaza principiul spectrografului de masa;
separarea prin schimb chimic - la circulatia unei solutii de sulfat de amoniu printr-o coloana, in contracurent cu amoniac gazos, are loc un schimb intre 15NH3 din faza gazoasa si ionii 14NH4+ din solutie, rezultand in sporirea abundentei de 15NH3 de peste 150 de ori.
IZOTOPI RADIOACTIVI
Criteriul de impartire al izotopilor in radioactivi, respectiv stabili, este tendinta lor de a se modifica spontan, emitand radiatii a b sau g. Razele a si b au fost puse in evidenta in 1899 de E. Rutherford, iar cele g de catre P. Vilard. Natura acestor radiatii difera: particulele a sunt atomi de heliu diionizati (nuclee de heliu), razele b sunt formate din electroni in deplasare, iar razele g sunt vibratii electromagnetice, analoge razelor luminoase si razelor X, dar cu lungime de unda mult mai mica.
In conditii speciale, cum ar fi cele existente intr-un reactor nuclear sau intr-un accelerator de particule, nici un izotop nu este stabil. Un criteriu general de comparare a stabilitatii in reprezinta raportul dintre masa componentelor atomului (protoni, neutroni, electroni) si masa atomului insusi. Cu cat aceasta diferenta este mai mare, cu atat acel izotop este mai stabil. Aceasta diferenta, (care poarta denumirea de defect de masa), reflecta energia de legatura a nucleului atomic, care se poate exprima cu ajutorul relatiei lui Einstein, E = Dmc2, unde Dm este defectul de masa.
Dintre izotopii naturali, 50 sunt radioactivi, dezintegrandu-se in timp. In urma acestui proces, izotopul radioactiv trece intr-un izotop stabil. De exemplu, tritiul (3H), trece, in urma emisiei unui electron, in 3He.
|
Elementele ce prezinta radioactivitate naturala sunt cele de la poloniu (Z=84) la uraniu (Z=92). Elementele transuranice cu numere atomice cuprinse intre 92 si 109 sunt obtinute artificial si sunt de asemeni radioactive. Pe langa elementele grele, exista si elemente usoare (cu numar atomi mai mic de 83) care prezinta izotopi radioactivi. Este vorba de 40K, 50Va, s.a. Pentru oricare sursa radioactiva, viteza cu care se emit radiatiile descreste continuu, definindu-se durata de injumatatire ca perioada de timp in care viteza emisiilor radioactive se injumatateste. Variatia in timp a activitatii unui element radioactiv este prezentata in Figura 3. |
Figura 3 |
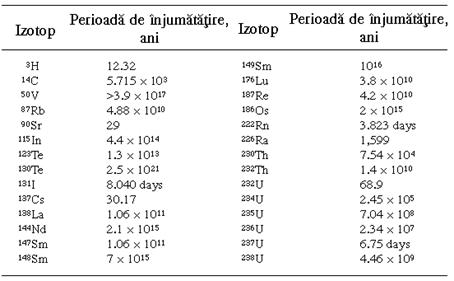
Pentru izotopii cunoscuti, durata de injumatatire variaza intre 10-7 secunde si 1016 ani. Valorile perioadei de injumatatire pentru cativa izotopi radioactivi semnificativi sunt prezentate in tabelul 1.
Izotopi
radioactivi se pot obtine si pe cale artificiala, prin iradierea unor elemente
cu particule a. Frecvent izotopii astfel obtinuti
se noteaza cu un asterisc, pentru a evidentia provenienta lor artificiala: ![]() . Acest izotop se obtine prin iradierea izotopului 25Mg.
Numarul izotopilor artificiali - radioizotopi - este mult mai mare decat
al izotopilor radioactivi naturali.
. Acest izotop se obtine prin iradierea izotopului 25Mg.
Numarul izotopilor artificiali - radioizotopi - este mult mai mare decat
al izotopilor radioactivi naturali.
Tabel 1
In natura exista si izotopi stabili, in numar de 275, in special in cazul elementelor usoare. Cativa dintre cei mai importanti sunt prezentati in Tabel 2.
Tabel 2.
|
Element |
Protoni |
Numar de neutroni |
||||||||
|
Hidrogen |
H |
H |
H | |||||||
|
Heliu |
He |
He | ||||||||
|
Litiu |
Li |
Li | ||||||||
|
Beriliu |
Be | |||||||||
|
Bor |
B |
B | ||||||||
|
Carbon |
C |
C |
C |
|||||||
|
Azot |
|
N |
N |
|||||||
|
Oxigen | ||||||||||
</div> Izotopii prezentati in tabelul 1 sunt relativ stabili, in sensul ca durata lor de injumatatire este foarte mare, in cazul 1H fiind de 1066 ani.
UTILIZARI ALE IZOTOPILOR RADIOACTIVI
Domeniile de utilizare ale radioizotopilor sunt diverse, cele mai importante fiind:
in medicina:
diagnosticare fara chirurgie;
radioterapie a cancerului;
reducerea durerilor in cancerul osos;
sterilizarea instrumentelor medicale;
aplicatii medicale si dentare ale razelor X;
diagnosticare prin rezonanta magnetica;
depistare radioscopica al tumorilor;
in biologie si protectia mediului:
investigarea cailor de raspandire a agentilor poluanti;
urmarire a animalelor in habitatul natural;
cercetari in cresterea plantelor.
in procesele industriale:
polimerizarea materialelor plastice;
masuratori ale proceselor de curgere;
testari nedistructive ale calitatii componentelor metalice;
testarea densitatii in producerea de uleiuri.
in procese de asigurare a securitatii:
detectoare de fum;
sterilizarea alimentelor;
eradicarea daunatorilor;
semnalizare in cladiri.
in domeniul energetic:
producerea energiei
Utilizari ale radioizotopilor in medicina
Terapie prin radiatii
Terapia prin radiatii, numita si radioterapie sau radiologie terapeutica, utilizeaza surse de radiatii pentru tratamentul unor boli. Pentru aceasta sunt utilizate radiatiile ionizante, care penetreaza adanc in tesuturi si interactioneaza, fizic si chimic, cu celulele bolnave, distrugandu-le. Celelalte forme de radiatii, infrarosii si ultraviolete, se pot utiliza in lampi in tratamentul artritei sau a neurozei, pentru a reduce inflamatiile.
Radioterapie se utilizeaza pentru tratamentul cancerului. Intr-o perioada anterioara era utilizata si pentru boli ale tiroidei, acnee si tumori benigne, dar complicatiile severe legate de bolile de piele si cancerul pielii indus radioactiv au dus la completa renuntare la utilizarea acestor proceduri.
Administrarea radiatiilor se poate face prin implantare in tumori de substante radioactive sau prin expunerea corpului la surse externe de radiatii de energie mare. Ambele metode au dus la rezultate bune in tratarea cancerului. Celulele canceroase sufera ruperi de legaturi moleculare, esentiale pentru cresterea celulelor. Efectele sunt variabile, rezultatele fiind mai bune in cazul tipurilor de cancer cu evolutie mai rapida.
Implantarea de surse radioactive se practica in cazul tumorilor usor accesibile sau de mici dimensiuni. Se utilizeaza radiumul sau radonul, sau izotopi radioactivi ai cesiului, cobaltului, aurului, iridiumului si tantalului. Aceste elemente, ce emit radiatii g, sunt inglobate etans in tuburi de sticla sau metal pentru a usura inserarea in organism. Implanturile pot fi temporare sau permanente. Doza de radiatie este redusa si continua, ceea ce ofera celulelor sanatoase timpul de a se reface in urma afectarii lor de catre radiatii in timpul distrugerii celulelor bolnave. Avantajul acestei metode il constituie stricta localizare a actiunii la zona bolnava, fara a afecta zone sanatoase.
Radiatiile externe trebuie sa penetreze tesuturile pentru a ajunge la tumori, ceea ce face ca tesuturi normale sa fie afectate, dar cresterile rapide de celule bolnave sunt mai usor stopate. Tratamentul presupune 10 - 20 sedinte de iradiere, pe durata a cateva luni. Acest gen de terapie este frecvent utilizat in asociere cu indepartarea chirurgicala a tumorilor. Avantajul fata de metoda implantului de substante radioactive este ca pot fi tratate tumori greu accesibile.
Medicina nucleara de diagnostic
In medicina de diagnostic, a carei aparitie dateaza din mijlocul deceniului al saptelea al acestui secol, radioizotopii se administreaza pentru localizarea organului intern care trebuie studiat. Un detector extern produce imagini a distributiei interne a radioactivitatii, care depinde de comportarea biologica a izotopului administrat si de modul in care functioneaza organul sub investigatie. Pentru aceasta radiatiile g emise sunt transformate in impulsuri electrice care sunt modulate, amplificate si procesate de un computer care produce o imagine spatiala a organului. Echipamente de data recenta pot produce sectiuni transversale ale organului studiat. Se obtin in acest mod harti ale distributiei functiilor in organism sau intr-un anumit organ intern. Tipica in acest sens este utilizarea iodului radioactiv (131I) pentru studiul functiilor glandei tiroide.
Extrem de sofisticate sunt echipamentele PET (positron emission tomography), ce utilizeaza radioizotopi ce emit pozitroni. O imagine tomografica a creierului este prezentata in Figura 4, iar in Figura 5 este prezentat un tomograf.
|
Figura 4 |
Figura 5 |
Utilizarea radiatiilor ionizante pentru diagnostic
Radiatiile ionizante sunt utilizate pentru vizualizarea de scanari radiologice in vederea diagnosticarii unei afectiuni. Este vorba de radiatiile X, care sunt radiatii de mare energie, produse intr-un tub Roentgen, a carui schema de principiu este prezentata in Figura 6. Acestea iau nastere daca in calea razelor catodice produse intr-un tub de descarcare cu vid inaintat se introduce o placa metalica (anod sau anticatod). Anticatodul emite radiatii X, care au mare putere de penetratie, pot impresiona placile fotografice, produc fluorescenta anumitor saruri si pot ioniza aerul.
|
Figura 6 |
Figura 7 |
O imagine obtinuta cu ajutorul razelor X este prezentata in Figura 7
Similara cu investigarea cu ajutorul radiatiilor X este tehnica MRI (Nuclear Magnetic Resonance) care permite vizualizarea nu doar a oaselor, ca in primul caz, ci si a tendoanelor, muschilor, sangelui.
Utilizarea izotopilor radioactivi in sterilizare
Proprietatea radiatiilor ionizante de inhibare a proceselor de multiplicare celulara este folosita pentru distrugerea microorganismelor. Se realizeaza prin iradiere sterilizarea echipamentului medical chirurgical. Cel mai frecvent se utilizeaza 60Co si, mai rar, 137Ce, care pot steriliza produse gata ambalate, prevenindu-se astfel o contaminare ulterioara. Aceasta asigura si un avantaj economic, deoarece producerea obiectelor ce trebuie sa fie sterile nu trebuie realizata in conditii sterile, ci normale.
Tehnicile de sterilizare cu ajutorul radioizotopilor au inlocuit tehnicile utilizate anterior, de tratare cu etilenoxid, care sunt actualmente interzise in U.S, Japonia, E.U., ca urmare a faptului ca se produc reziduuri cancerigene.
UTILIZARILE IZOTOPILOR IN BIOLOGIE
|
Element |
Numarul de masa al celui mai abundent izotop neradioactiv |
Radioizotop |
Timp injuma-tatire |
Utilizari |
|
Hidrogen |
Tritium(3) |
12,4 ani |
Trasor pentru studii metabolice, |
|
|
Oxigen |
18 (neradioactiv) |
Studii metabolice si determinarea temperaturii marilor ancestrale prin intermediul raportului 16O/18O, |
||
|
Carbon |
5,745 ani |
Studii metabolice si datarea pieselor arheologice, |
||
|
Fosfor |
14,3 zile |
Trasori metabolici si ecologici, Studii ale nucleotidelor, acizilor nucleici, |
||
|
Sulf |
87,9 zile |
Proteine marcate |
||
|
Cobalt |
5,3 ani |
Terapia cancerului, sursa de radiatii g |
UTILIZARI ALE IZOTOPILOR STABILI
Utilizarea de molecule marcate cu
izotopi care nu sunt prezenti in mod curent (cel mai frecvent radioizotopi)
permite observarea transformarilor lor in reactii chimice sau biologice. In
acest scop se pot folosi si izotopi care nu sunt radioactivi. Un exemplu in
acest sens il constituie mecanismul reactiei de hidroliza a esterilor, care a
putut fi stabilit doar prin folosirea in locul apei obisnuite a apei marcate ![]() , cand s-a constatat ca la sfarsitul reactiei
izotopul 18O se regaseste integral in molecula de acid, ceea ce
indica faptul ca reactia are loc dupa mecanismul I, si nu dupa mecanismul II (Figura 8).
, cand s-a constatat ca la sfarsitul reactiei
izotopul 18O se regaseste integral in molecula de acid, ceea ce
indica faptul ca reactia are loc dupa mecanismul I, si nu dupa mecanismul II (Figura 8).
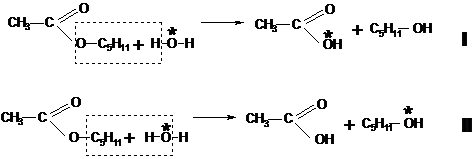
Figura 8
Bibliografie
Endiclopedia Britannica Multimedia Edition, 1999
Ganescu, I, Chimie pentru definitivat, Editura Didactica si Pedagogica, Bucuresti, 1989.
Nenitescu, C. D., Chimie Generala, Editura Didactica si Pedagogica, Bucuresti, 1972
Niac, V., Niac, G., Chimie pentru bacalaureat, Editura Dacia, Cluj, 1973
O'Connor, P. R., Davis, J. E., Haenish, E. L., MacNab, W. K., McClellan, A. L., Chimie: experiente si principii, Editura Stiintifica si Enciclopedica, Bucuresti, 1983
Rabega, C., Rabega, M., Chimie pentru admitere in facultate, Editura Albatros, Bucuresti, 1973
Risavi, I, Ionescu, I, Chimie si probleme de chimie, Editura Tehnica, Bucuresti, 1971
Strajescu, M., Cosma, M, Chimie anorganica, Editura Dacia, Cluj, 1975
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |