
Legaturi intermoleculare (Forte van der Waals)
Sub aceasta denumire sunt cuprinse toate fortele care actioneaza intre molecule stabile. Aceste forte actioneaza intre molecule sau ioni si sunt mai slabe decat cele amintite sub denumirea de legaturi chimice. Exista doua componente ale acestor forte, una de atractie si alta de respingere. Daca consideram doar fortele care intervin in atractie acestea pot fi de trei tipuri:
a. Fortele London (forte de dispersie) care apar de exemplu intre moleculele monoatomice ale gazelor rare, dar care sunt cele mai generale, manifestandu-se intre orice tipuri de molecule, indiferent de simetria acestora sau chiar intre particule solide eventual suprapuse peste fortele amintite anterior.
b. Fortele Debye (forte de inductie) care apar in urma interactiunii unui dipol permanent al unei molecule cu un dipol indus intr-o alta molecula.
c. Fortele Keesom (numite si forte de orientare) rezultate din de atractia dintre sarcini electrice (prezente in cazul ionilor poliatomici), dintre dipoli (la moleculele cu dipolmoment permanent) sau dintre multipoli sau orice combinatii ale acestora.
Acestea au cateva caracteristici comune:
sunt forte de atractie slabe ce apar chiar la configuratii moleculare stabile,
intensitatea acestor forte este reflectata de punctele de fierbere ale substanteor respective.
Fortele London pot aparea datorita unor fluctuatii a electronilor fata de pozitia de echilibru fie spontane fie sub actiunea unor radiatii luminoase. Aceste fluctuatii dau nastere la asanumitii dipoli temporari. Acestia pot induce intr-o molecula invecinata fara dipol un "dipol temporar indus". Schematic, procesul de formare al dipolului temporar este:
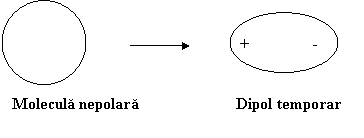

Apoi dipolul temporar induce la randul sau intr-o alta molecula fara dipol permanent un dipol temporar indus acestia atragandu-se reciproc.
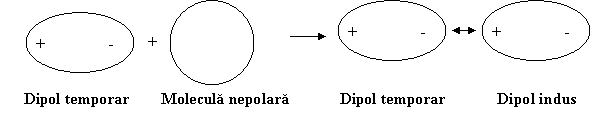
 Energia
potentialǎ a legǎturii nou formate, EpL, este puternic dependentǎ de polarizabilitatea
α si invers proportionalǎ cu puterea a 6-a a distantei
dintre centrele de greutate ale moleculelor invecinate, r:
Energia
potentialǎ a legǎturii nou formate, EpL, este puternic dependentǎ de polarizabilitatea
α si invers proportionalǎ cu puterea a 6-a a distantei
dintre centrele de greutate ale moleculelor invecinate, r:
 EpL=-3α2hνo/4r6
EpL=-3α2hνo/4r6
unde h este constanta lui Planck iar νo este frecveta de oscilatie a dipolului temporar. Se observǎ cǎ aceste forte scad foarte repede cu distanta r.
Fortele Keesom - de orientare - se manifestǎ numai in cazul moleculelor cu dipoli permanenti care se atrag reciproc astfel ca polul pozitiv al moleculei sǎ se pozitioneze in dreptul polului negativ al moleculei invecinate (vezi fig. 3.15).
Energia potentialǎ a acestui tip de forte intermoleculare, EpK, este datǎ de ecuatia:
EpK = -2μ12μ22/3kTr6
 unde μ1, μ2
sunt dipolmomentele celor douǎ molecule implicate, k este constanta lui
Boltzmann, T - temperatura absolutǎ si r - distanta dintre
centrele de greutate ale celor douǎ molecule. Se poate observa cǎ
fortele de orientare depind de valoarea momentului dipolar al moleculelor
si scad de asemenea proportional cu puterea a 6-a a distantei r dintre
molecule.
unde μ1, μ2
sunt dipolmomentele celor douǎ molecule implicate, k este constanta lui
Boltzmann, T - temperatura absolutǎ si r - distanta dintre
centrele de greutate ale celor douǎ molecule. Se poate observa cǎ
fortele de orientare depind de valoarea momentului dipolar al moleculelor
si scad de asemenea proportional cu puterea a 6-a a distantei r dintre
molecule.
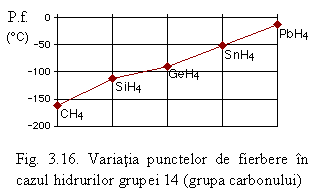
Un exemplu edificator privind efectul acestor forte este dat de hidrurile grupei 14 (vezi Fig. 3.16). Se poate observa cǎ in cazul acestor hidruri punctele de fierbere (P.f.) cresc regulat cu masa, respectiv cu volumul, moleculelor. In cazul hidrurilor polare fenomenul prezintǎ unele exceptii. Astfel in cazul hidrurilor calcogenilor punctele de fierbere cresc doar in cazul sulfului, seleniului si telurului:
Compusul P.f. (oC)
H2O 100
H2S -60,7
H2Se -41,5
H2Te -2,0
Acest lucru este rezultatul efectelor simultane ale fortelor London si Keesom, nota dominantǎ dand-o fortele London - prezente in cazul oricǎror molecule polare sau nepolare. Apa, care ar trebui sǎ aibǎ un punct de fierbere mult mai coborat, face exceptie datoritǎ unui alt tip de legǎturǎ dintre moleculele sale, ce urmeazǎ a fi prezentate in cele ce urmeazǎ (legǎtura de hidrogen).
Sǎ considerǎm acum si fortele repulsive care actioneazǎ intre molecule. Fortele repulsive cresc foarte repede cu distanta fiind de forma B/rn unde n = 9 - 12. Asadar luand in considerare atat fortele atractive cat si cele repulsive energia potentialǎ totalǎ in cazul interactiunilor van der Waals va fi datǎ in functie de molecule de o ecuatie de tipul:
Ep = -A/r6 + B/rn (n = 9 12)
unde A si B sunt constante ce depind de natura moleculelor, r fiind distanta dintre douǎ molecule. Ep are valori de ordinul 1 - 2 kcal/mol (sau 0,1 eV) fiind mult mai slabe decat legǎturile chimice covalente.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |