Starea gazoasa este una dintre starile de agregare a materiei, care se caracterizeaza prin faptul ca particulele constituiente, atomi sau molecule, se gasesc la distante mari unele de altele, distante la care interactiunile reciproce sunt neglijabile, spre deosebire de starea lichida sau solida, in care particulele se gasesc aproape in contact. Din acest motiv, starea gazoasa a materiei este cea mai putin densa.
Atomii sau moleculele gazului au o miscare haotica perpetua, cu viteze medii ce cresc cu marirea temperaturii. In miscarile lor rectilinii, particulele gazului se ciocnesc intre ele, schimbandu-si directia si viteza de deplasare. Intrucat ciocnirile sunt elastice, la aceeasi temperatura, energia cinetica a tuturor particulelor este constanta. Se poate spune ca temperatura este o masura a gradului de agitatie a particulelor. De altfel, miscarea continua a particulelor este cunoscuta sub numele de agitatie termica.
Un gaz are tendinta de a ocupa tot volumul pe care il are la dispozitie. Prin urmare, un gaz nu are volum si nici forma proprie. Moleculele sau atomii gazului se ciocnesc si de peretii vasului in care se gaseste. Intrucat, in conditii obisnuite, frecventa ciocnirilor este extrem de mare, forta cu care particulele gazului "apasa" peretii vasului este practic constanta. Aceasta forta, raportata la suprafata peretelui, reprezinta presiunea gazului.
Gazele se numesc ideale sau perfecte, daca particulele lor pot fi considerate punctiforme, iar interactiunile dintre ele sunt nule. In aceste conditii, legile care caracterizeaza starea gazoasa au forma cea mai simpla. In situatia in care dimensiunile particulelor si interactiunile dintre ele nu pot fi neglijate, gazele se numesc reale. De obicei, gazele reale, la temperatura suficient de ridicata si presiune suficient de scazuta, au comportare de gaz perfect.
Starea gazoasa depinde de temperatura, un lichid sau un solid poate fi adus in stare gazoasa daca i se furnizeaza energie. Noi ne vom referi insa la substantele care in conditii normale de temperatura si presiune (273 si 1 atm) sunt gaze. Din elementele sistemului periodic sunt gaze in conditii normale: He, Ne, Ar, Xe, Kr, Rn, H2, F2, Cl2, O2 si N2. Dupa cum se observa, gazele nobile se prezinta ca atomi in timp ce celelate elemente se prezinta sub forma de molecule. Indiferent de natura lor, gazele au cateva proprietati importante comune cum ar fi: expansibilitatea, compresibilitatea si difuzabilitatea. Aceste trei proprietati se supun unor legi care sunt cunoscute sub numele de legile gazelor.
Legea transformarilor izoterme: Studiind compresibilitatea aerului R.Boyle a obtinut o curba de urmatorul tip (Figura 39):
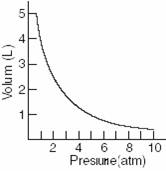
Figura 39. Variatia volumului cu presiunea pentru o masa data de aer
Verificand observatia, a obtinut curbe asemanatoare si pentru alte gaze si la alte temperaturi care arata ca pentru o anumita cantitate de gaz cresterea presiunii duce la micsorarea volumului si a concluzionat ca acest fapt este valabil pentru orice gaz (Figura 40).
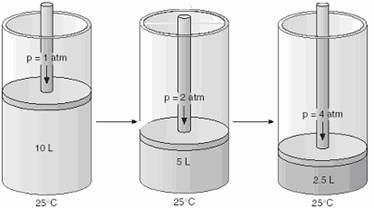
Figura 40. Experimentul lui R. Boyle
Esenta experimentelor efectuate de cercetatorul englez, confirmate apoi si de Marriote, a fost suntetizata in legea care le poarta numele (Boyle-Marriote): "Volumul ocupat de o substanta gazoasa este invers proportional cu presiunea la care el este masurat cu conditia ca temperatura si masa gazului sa fie mentinute constante".
V ~ 1/P
=> V = k/P rezulta PV=k sau P1V1=P2V2 sau V1/V2= P2/P1
Valoarea constantei depinde de masa, tipul gazului si de temperatura. Volumul este exprimat in litrii (l) iar presiunea este exprimata in atmosfere (atm).
Legea transformarilor izobare Studiind dilatarea gazelor, Charles a observat ca la cresterea temperaturii volumul gazelor se mareste si aceasta comportare se verifica indiferent de natura gazului (Figura 41).
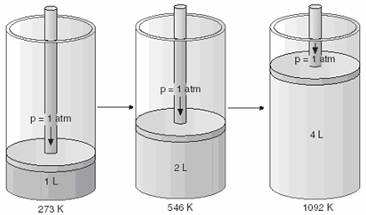
Figura 41. Experimentul lui Charles
Legea enuntata de Charles atunci cand masade gaz si presiunea sunt mentinute constante a fost: "Volumul unui gaz este direct proportional cu temperatura sa absoluta, cu conditia camasa si presiunea gazului sa ramana constanta"
V ~ T
=> V = k`T, unde T este temperatura absoluta, sau V1/V2 = T1/T2
unde k` este o constanta de proportionalitate dependenta de presiune
Volumul este exprimat in litrii (l) iar temperatura este exprimata in grade Kelvin (oK).
Verificand comportamentul gazelor la diferite presiuni a concluzionat ca acest fapt este valabil pentru orice gaz. Reprezentarea grafica a dependentei volumului de temperatura pentru presiuni diferite este prezentata in Figura 42.
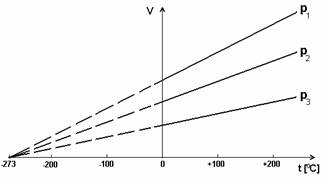
Figura 42. Legea transformarilor izobare (dreptele se numesc izobare)
Comportarea gazului ideal in conditii izobare se explica astfel: la incalzire, agitatia termica a moleculelor se intensifica, iar pentru a mentine presiunea constanta este necesara marirea distantei dintre particulele gazului, adica marirea volumului. Daca se extrapoleaza izobarele in domeniul negativ al scarii Celsius, se observa ca toate intersecteaza abscisa intr-un punct comun. Acest punct comun reprezinta temperatura la care agitatia termica inceteaza (si volumul gazului ideal ar trebui sa fie 0; vezi gaze reale). Aceasta temperatura minima care poate fi atinsa (-273,16 C) a fost aleasa ca referinta pe scara termodinamica de temperatura introdusa de Kelvin (0o K C; => Tin scara Kelvin = t in scara Celsius +273,16).
Relatia dintre masa si volumul gazului. Legea lui Avogadro. Legile lui Boyle si Charles au prezentat dependenta volumului unei cantitati de gaz in functie de variatia presiunii respectiv temperaturii. Se pune intrebarea inversa: in conditii de temperatura si presiune date, depinde cumva volumul unui gaz oarecare de numarul de molecule (n) al acestuia ? Raspunsul la aceasta intrebare a fost dat de Avogadro in legea care ii poarta numele: "Volume egale de gaze masurate in aceleasi conditii de temperatura si presiune, contin acelasi numar de molecule".
n/V = constant (indiferent de natura gazului, la p si T date)
=> V= k''n
unde k''este o constanta de proportionalitate dependenta de p si T (date).
Legea generala a gazelor. In legile enumerate pana acum s-a constatat ca volumul unui gaz depinde de trei marimi variabile: presiune, temperatura si numar de molecule. O axioma a algebrei arata ca daca o marime este proportionala cu fiecare din mai multe variabile independente atunci ea este proportionala si cu produsul dintre acestea si deci putem scrie:
V = (k/P)x(k`T)x(k''n) care dupa rearanjare se poate formula:
V = (kk'k'')nT/P si daca notam R = kk'k''unde R este o constanta de
proportionalitate globala si rearanjam obtinem:
P V = n R T
care este expresia matematica a legii generale a gazelor ideale, ecuatia de stare a gazelor, sau inca ecuatia lui Clausius - Klapeyron.
Conditii standard. Pentru a compara intre ele volumele de gaze, a fost ales prin consens un set standard de conditii de temperatura si presiune: presiunea de 1 atmosfera si temperatura de 0 oC (sau 273 oK). In aceste conditii putem calcula valoarea numerica a constantei R, numita si constanta generala a gazelor:
pentru n = 1,00 mol; P=1,00 atm si T=273 oK avem V=22,4 l de unde
PV /nT = R = (1atmx 22,4 l)/ (1mol x 273 K) = 0,082 l.atm/K.mol
Legea lui Dalton: Daca avem un amestec de gaze este important sa stim ce presiune exercita fiecare gaz component ce se afla intr-un volum dat. Raspunsul la aceasta problema a fost oferit de Dalton sub forma legii care-i poarta numele: "intr-un amestec de gaze presiunea totala este egala cu suma presiunilor pe care fiecare gaz component le-ar exercita daca s-ar afla singur in acelasi volum care este ocupat de amestec" (Figura 43).
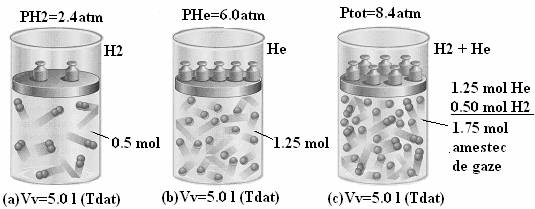
Figura 43. Experimentul lui Dalton. Vv -volumul recipientului; Tdat - o temperatura data,
fixata de experimentator care este acceeasi in cele 3 cazuri a, b, c.
Pentru un amestec de k gaze (care nu reactioneaza intre ele) expresia matematica a legii lui Dalton este:
p = p1 + p2 + . + pk
Daca fiecare gaz participa la amestec cu ni moli atunci daca scriem ecuatia de stare a gazelor ideale obtinem:
pV = (n1 + n2 + + nk)RT
din care dupa rearanjare obtinem
![]()
unde termenul ![]() reprezinta presiunea partiala a gazului
i.
reprezinta presiunea partiala a gazului
i.
Legile gazelor sunt valabile atata timp cat presiunea ramane mica si temperatura se afla la valori ridicate. In aceste conditii, gazele se comporta ca gaze ideale. La presiuni mari sau la temperaturi foarte joase apar insa abateri de la legile gazelor ideale. Acest fapt se constata experimental daca se ia un mol de gaz si se reprezinta raportul pV/RT (factorul de compresibilitate) in functie de p pentru diverse temperaturi. Daca comportarea gazelor ar fi ideala pentru orice temperatura si presiune, reprezentarea ar conduce la o dreapta (pentru un T dat). In realitate se obtin pe anumite domenii curbe ce se abat de la aceasta dreapta. J van der Waals a adus urmatoarele corectii ecuatiei de stare:
a) La presiunea unui gaz real se adauga termenul de corectie an2/V2. Constanta a (specifica fiecarui gaz in parte ) este o masura a tariei fortelor atractive dintre doua molecule. Termenul n2/V2 arata ca efectul fortelor de atractie depinde de numarul de molecule din unitatea de volum. Deci presiunea reala va fi : (p+ an2/V2)
b) Volumul real consta din spatiul gol dintre particule (molecule sau atomi) la care se adauga volumul b pe care il ocupa un mol de particule (numit volum efectiv sau exclus) multiplicat prin numarul de moli de gaz n (Figura 44).Deci volumul real este : (V-nb)
Ecuatia de stare a gazelor reale, denumita si ecuatia lui van der Waals devine
(p+ an2/V2) (V-nb) = nRT

Figura 4 Gazele reale sunt compresibile pana la limita volumului propriilor molecule (volumul efectiv).
Respiratia. Cavitatea toracica este regiunea corpului in care sunt plasati plamanii. Ridicarea custii toracice si relaxarea muschiului diafragmei duc la marirea volumului cavitatii. O data cu marirea volumului cavitatii, descreste presiunea aerului din ea. Atunci cand aceasta presiune devine mai mica decat cea atmosferica, aerul patrunde in plamani. Coborarea custii sau contractarea diafragmei descresc volumul cavitatii toracice. Cand volumul cavitatii se micsoreaza si presiunea din ea creste la o valoare mai mare decat a presiunii atmosferice, aerul este eliminat din plamani.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |