
Am vazut care este natura fortelor ce actioneaza atunci cand se realizeaza legaturile covalente, ionice si metalice. Toate aceste legaturi se refereau la modalitatile in care atomii se unesc pentru a forma molecule. Energia acestor legaturi este mare de ordinul 50-100 kcal/mol. Pe langa aceste legaturi tari exista si legaturi slabe care sunt aproximativ cu un ordin de marime (unele cu mai mult) mai slabe decat cele prezentate si care se manifesta intre molecule (sau atomi) si dau seama de starea de agregare a acestora.
Gazele rare precum si o serie de nemetale ce se afla in stare gazoasa in conditii normale pot fi aduse in stare lichida sau stare solida. Nimic din configuratia electronica exterioara a acestor atomi sau molecule nu justifica legarea uneia de alta. In conditii obisnuite se prezinta in stare solida: metalele, compusii ionici sau covalenti cu masa apreciabila sau substantele formate din molecule foarte mari (macromoleculele). Fortele responsabile de atractia interatomica sau intermoleculara in cazul moleculelor mici poarta numele descoperitorului lor, van der Waals.
Sub termenul generic de forte van der Waals se ascund 3 tipuri de interactiuni slabe: interactiuni de dispersie, interactiuni de orientare si interactiuni de inductie. Fortele van der Waals se manifesta doar daca moleculele (sau atomii) sunt suficient de apropiate. In general, fortele van der Waals se manifesta in starile condensate, dar sunt intalnite si la gaze in conditii apropiate de lichefiere, cand moleculele sunt apropiate intre ele. Ele sunt datorate atractiilor electrostatice dintre electronii unei molecule si nucleele altei molecule partial ecranate de electronii proprii. Energia fortelor van der Waals este redusa comparativ cu energia legaturilor ionice sau covalente.
Interactiunile de dispersie (numite si forte London) actioneaza intre toate tipurile de molecule, dar este singurul tip de legatura care se manifesta intre moleculele nepolare. Fortele de dispersie van der Waals iau nastere datorita faptului ca, intr-o molecula, nucleele vibreaza in interiorul norului electronic, dand nastere astfel unui dipol electric temporar. Dipolul electric este un sistem de doua sarcini electrice egale si de semne contrare si este caracterizat de momentul dipol (dipolmoment) dat de produsul dintre sarcina partiala d si distanta dintre centrele sarcinilor electrice pozitive si negative:
d = d.d
Interactiunile de dispersie iau nastere chiar si in moleculele simetrice datorita dipolului instantaneu care poate lua nastere (Figura 34).

Figura 34. Dipolii temporari sunt cauza aparitiei fortelor de dispersie
Actiunea acestora se manifesta chiar si temperatura de 0 0K, intrucat vibratiile nucleelor si electronilor nu inceteaza nici la aceasta temperatura. Aceste interactiuni de dispersie explica de ce heliul se poate lichefia (4oK) si chiar aduce in stare solida (1oK, 25atm).
Fortele van der Waals sunt mai mari in cazul moleculelor cu masa moleculara mai mare, acestea avand mai muti protoni vor avea implicit si mai multi electroni. Cu cat creste numarul de electroni din molecula cu atat norul electronic este mai polarizabil. Din acest motiv, in general, punctele de fierbere si de topire cresc odata cu cresterea masei moleculare, asa cum rezulta din Tabelul 7.
Tabelul 7 Variatia constantelor fizice in cazul halogenilor comparativ cu hidrogenul
|
Specia chimica |
H2 |
F2 |
Cl2 |
Br2 |
|
Masa moleculara | ||||
|
Numarul total de e- din molecula | ||||
|
Punctul de fierbere [ C] | ||||
|
Punctul de topire [ C] |
|
Interactiunile de orientare (denumite si legaturi dipol-dipol) sunt forte de natura electrostatica care apar intre moleculele polare (cu dipol permanent), avand ca rezultat orientarea dipolilor (Figura 35).
Cu cat momentul dipol este mai mare, cu atat interactiunile dintre molecule sunt mai puternice, dar si in acest caz pot fi prezente fortele de dispersie care pot accentua dipolmomentul moleculelor.
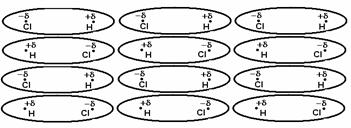
Figura 35. Orientarea moleculelor de acid clorhidric in stare solida.
Interactiunile de inductie actioneaza intre moleculele polare si cele nepolare. Dipolul permanent al moleculei polare induce un dipolmoment instantaneu in moleculele nepolare din imediata vecinatate, fortele de interactiune dintre cele doua tipuri de dipoli fiind de tip dipol permanent dipol indus.
Anumite molecule care contin atomi de hidrogen legati de atomi cu raza atomica mica si electronegativitate mare cum sunt fluorul, oxigenul si azotul prezinta anomalii ale constantelor fizice care se traduc prin puncte de fierbere foarte ridicate si puncte de topire neasteptat de ridicate. Comparand proprietatile fizice ale hidrurilor calcogenilor (elemente din grupa 16 a tabelului periodic) se constata ca doar hidrura oxigenului este lichida, la temperatura camerei, restul hidrurilor (S,Se,Te) sunt gazoase. Faptul ca, la aceasta temperatura, doar apa este lichida a condus la ideea ca in apa exista asociatii moleculare. Aceste asociatii au gasit urmatoarea explicatie: polarizarea legaturii O-H fiind mare, atomul de hidrogen se gaseste dezecranat de norul electronic si prin urmare va incerca sa-si completeze deficitul de sarcina prin atragerea norului elctronic al electronilor neparticipanti ai oxigenului dintr-o molecula vecina de apa (Figura 36).
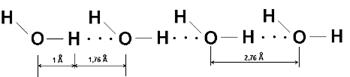
Figura 36. Legatura de hidrogen in apa. Distanta intre doua molecule de apa este de 2.76A.
Legatura de hidrogen se noteaza cu linii punctate intre atomii care interactioneaza. In asocierea prin legaturi de hidrogen participa ambii atomi de hidrogen ai moleculei de apa. Prin comparatie cu legaturile tari (ionica, covalenta, metalica) legatura de hidrogen este o legatura slaba (3.5-9.5 kcal/ mol) aproximativ cu un ordin de marime mai slaba. Legatura de hidrogen, in cazul apei se manifesta nu numai in starea lichida ci si in starea solida Figura 38. Legaturile de hidrogen sunt orientate in spatiu. In gheata, legaturile de hidrogen sunt relativ rigide si confera acesteia o structura afanata (cu mari spatii goale, spatii in care isi pot gasi locul uneori alte molecule decat cele ale apei; asemenea "compusi"de incluziune se numesc clatrati). Din cauza structurii afanate, densitatea ghetii este sensibil mai mica decat a apei lichide.
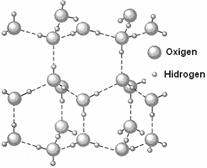
Figura 37. Legaturile de hidrogen din apa in starea solida
Legaturile de hidrogen au fost identificate si in cazul altor hidruri nemetalice: acidul fluorhidric (HF), amoniacul (NH3) si fosfina (PH3). Legaturile de hidrogen sunt prezente si in chimia compusilor organici in clasa alcoolilor (R-OH), a acizilor carboxilici (RCOOH), a aminelor (RNH2), a amidelor (RCONH2) unde sunt raspunzatoare de proprietatile fizice ale acestor compusi. Legaturile de hidrogen se pot manifesta nu numai intre molecule (intermolecular) dar si in interiorul acestora intre diverse grupari functionale ce se afla intr-un aranjament spatial ce permite realizarea acestor legaturi. De si mai mare importanta sunt legaturile de hidrogen in biomoleculele fundamentale ce constituie baza materiei vii: acizii nucleici si proteinele. Legaturile de hidrogen intramoleculare din proteine ce se realizeaza intre hidrogenul unei grupari iminice (NH) si oxigenul unei grupari carbonilice (O=C) (ambele constituiente ale legaturii peptidice (CONH)) determina doua aranjamente spatiale cunoscute sub numele de foaie pliata beta si alfa helix (Figura 39 a,b). Tot legaturile de hidrogen sunt responsabile de adoptarea de catre acidul dezoxiribonucleic a aranjamentului in dubla elice intre doua catene complementare. Cele doua catene alcatuiesc dubla elice datorita legaturilor de hidrogen ce se stabilesc intre bazele purinice (AG) si pirimidinice (TC) (Figura 38 c).
|
A |
C |
|
B |
Figura 38. Legaturi de hidrogen in biomacromolecule a) foaie pliata beta (proteine);
b) alfa helix (proteine); c) dubla elice din ADN (acizi nucleici).
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |