
Legea periodicitatii si sistemul periodic a lui Mendeleev

Dmitri Ivanovici Mendeleev
A studiat la universitatea din
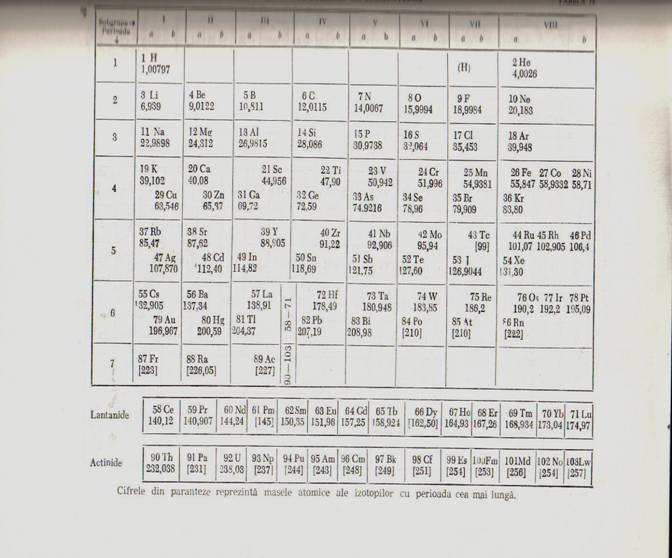
Sistemul periodic a lui Mendeleev.
Dmitri Ivanovici Mendeleev si-a dat seama ca intre masele atomice si proprietatile chimice trebuie sa existe o stransa legatura.
Profesorul N.A. Mensutchin a prezentat in ziua de 18 martie 1869, la Societatea rusa de fizica si chimie, in absenta lui Mendeleev care era suferind, o nota stiintifica a acestuia, insotita de un table intitulat: "Incercare de sistematizare a elementelor chimice, bazata pe greutatile lor atomice si asemanare chimica". In aceasta nota Mendeleev a informat pe oamenii de stiinta participanti la sedinta despre prima clasificare stiintifica a elementelor chimice si despre legea periodicitatii, descoperita de el.
Aceasta lege arata ca proprietatile chimice si majoritatea proprietatilor fizice ale elementelor se schimba periodic in functie de o anumita proprietate a atomilor, care variaza neperiodic de la un element la altul. Mendeleev considerand ca aceasta proprietate neperiodica este masa atomica, a enuntat legea periodicitatii astfel: proprietatile elementelor sunt functiuni periodice ale maselor lor atomice. Ulterior s-a constatat insa ca nu masa atomica, ci numarul atomic este proprietatea neperiodica a atomilor, in functie de care proprietatile elementelor se schimba periodic.
Mendeleev a tradus in fapt legea periodicitatii in prima ei forma, intocmind primul sistem periodic pe baze stiintifice. A insirat cele 63 de elemente, cunoscute in vremea sa, in ordinea crescatoare a masei lor atomice si a constatat ca proprietatile lor se repeat periodic din opt in opt. Asezand unele sub altele elementele care se aseamana prin proprietatile lor, Mendeleev a intocmit sistemul sau, format din siruri orizontale, numite perioade si siruri verticale, numite grupe.
Inca de la primele incercari, effectuate pentru intocmirea primului sau system periodic, Mendeleev a subliniat ca masele atomice a 17 elemente erau gresit calculate, deoarece proprietatile lor nu corespundeau casutelor indicate exclusive de masele atomice. Fata de aceasta situatie, Mendeleev a introdus elementele respective in casutele ce li se potriveau dupa proprietati, indicand in acelasi timp si masele lor atomice corecte. Astfel, de exemplu, a stabilit ca beriliul are valenta 2 si masa atomica circa 9, in loc de valenta 3 si masa atomica 13,5, precizand ca locul acestui element este intre litiu si bor. In mod analog a precizat ca masa atomica a uraniului este 238, in loc de 116, cat indica masa atomica anterioara.
Multi chimisti, in frunte cu renumitul professor de chimie german Meyer, au protestat in diferite articole stiintifice impotriva lui Mendeleev care "a indraznit" sa corecteze unele mase atomice acceptate de ei.
Cele mai multe dintre elementele sistemului periodic se succed in ordinea crescatoare a masei lor atomice, cu exceptia a opt perechi de elemente: argonul si potasiul, cobaltul si nichelul, telurul si iodul, toriul si protactiniul, uraniul si neptuniul, plutoniul si americiul, einsteinul si fermiul, mendeleeviul si nobeliul. Situarea acestor perechi de elemente in system s-a facut in ordinea inverse a maselor lor atomice, avandu-se in vedere proprietatile lor. Dupa descoperirea numarului atomic, s-a ajuns insa la concluzia ca aceste inversiuni prezinta doar o insemnatate redusa.
Legea periodicitatii i-a ingaduit
lui Mendeleev sa prevada existenta si
proprietatile a 6 elemente, necunoscute la data intocmirii primului sistem
periodic. Aceste elemente au fost descoperite ulterior in natura sau au fost
obtinute in laborator. Numele atribuite de Mendeleev acestor elemente au fost urmatoarele: eka-borul
(scandiul descoperit de L.F. Nilson in
1879); eka-aluminiul (galiul, Lecoq
de Boisbaudran, 1875); eka-siliciul (germaniul,
Cu privire la previziunea unor elemente si a proprietatilor lor, Engels scria: "Mendeleev aplicand fara sa stie legea hegeliana a trecerii cantitatii in calitate, a savarsit pe taramul stiintei o fapta mareata, care poate sa stea cu indrazneala alaturi de descoperirea lui Le Verrier, care a calculat orbita unei planete inca necunoscuta - Neptun"
Pentru a ne da seama mai usor, de modul in care au fost asezate elementele chimice, in ordinea crescatoare a masei lor atomice si in acelasi timp si in ordinea asemanarilor dintre ele, sa ne oprim la primele 3 siruri orizontale din sistemul periodic al lui Mendeleev (bineinteles completate cu elementele cunoscute pana la vremea noastra):
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
In perioada elementele vecine sunt galiul si arsenal. Deoarece galiul era necunoscut inca, Mendeleev a ales elementele vecine zincul si seleniul.
Sodiul are proprietatile asemanatoare cu litiul, magneziul cu beriliul, aluminiul cu borul s.am.d.
Pe bza legii periodicitatii Mendeleev a inclus in system toate elementele chimice cunoscute in vremea sa, ulterior sistemul find completat cu elementele descoperite mai tarziu.
In total in sistem sunt sapte perioade, dintre care primele trei sunt mici, iar ultimele patru sunt mari. Perioadele se noteaza prin cifrele arabe 1-7.
Numarul N al elementelor dintr-p perioada este dat de relatia lui J.R.Rydberg:

N din relatia de ma sus reprezinta si numarul maxim de electroni dintr-un strat electronic. In acest caz n=1, 2, 3, 4, 5... Se numeste numarul cuantic al stratului.
In afara de perioada 1 care incepe cu hidrogenul, celelalte perioade incep cu un metal alcalin; exceptand ultima perioada care este incomplete, celelalte perioade se termina cu un gaz monoatomic. Elementele aceleiasi perioade se deosebesc cu atat mai mult intre ele, prin proprietatile lor, cu cat sunt mai distantate unul de altul in perioada.
Numarul perioadei are nu numai o semnificatie aritmetica, ci si una fizica, reprezentand numarul straturilor electronice din atomii elementelor, Astfel, atomii elementelor din perioada 1 au un singur strat electronic (k), ai elementelor din perioada 2 au doua straturi electronice (K,L)...ai elementelor din perioada 7 au sapte straturi electronice (k, L, M, N, O, P, Q).
In sistemul periodic al elementelor exista 8 grupe, notate prin cifrele romane I-VIII.
Fiecare grupa este alcatuita din doua subgrupe: o subgrupa principala, numita si grupa principala (a) si o subgrupa secundara numita si subgrupa (b). Deoarece hidrogenul se aseamana in unele privinte cu metalele alcaline, etste situate in system inaintea acestora, in subgrupa principala Ia. Intrucat insa acest element are si un character nemetalic, unii autori il situeaza inaintea halogenilor, in subgrupa principala VIIa
In timp ce in aceasta forma a sistemului periodic, subgrupa principala si subgrupa secundara sunt mentinute in cadrul aceleiasi grupe, in forma lunga a acestui system ele sunt separate.
In aceasta ultima forma a sistemului periodic, exista 8 subgrupe principale, notate cu Ia - VIIIa si 8 subgrupe secundare, intercalate intre subgrupele principale IIa si IIIa.
Dupa felulsubgrupelor, principale sau secundare, elementele care apartin se numesc principale respective tranzitionale.
Subgrupa principala Ia cuprinde metalele alcaline, subgrupa principala IIa, metalele alcalino-pamantoase..subgrupa principala VIIa, halogenii si subgrupa principala VIIIa, gazelle monoatomice.
Cu exceptia subgrupei secundare IIIb care cuprinde 32 de elemente si a subgrupei secundare VIIIb care este formata din 9 elemente, celelalte subgrupe sunt alcatuite din cate 3 elemente.
In perioade, elementele sunt repartizate dupa acelasi criteriu, ca si in forma precedenta a sistemului periodic.
Cele 14 lantanide se gasesc in perioada 6 fiind intercalate intre lantan si hafnium, iar cele 14 actinide se afla in perioada 7, dupa actiniu.
Lantanidele au fost situate in sistemul periodic intre lantan si hafnium, deoarece se aseamana foarte mult cu lantanul, iar actinidele urmeaza dupa actiniu, deoarece proprietatile lor sunt analoge celor actiniului.
Desii lantanidele si actinidele fac parte din aceeasi subgrupa secundara (IIIb), sunt inscrise in system in randuri separate la partea inferioara a acestuia.
Casutele in care se afla elementele subgrupelor principale sunt hasurate, spre deosebire de casutele elementelor tranzitionale care sunt nehasurate.
Hidrogenul si heliul sunt elemente ale unor subgrupe principale, fiind situate la mijlocul perioadei 1.
Hidrogenul formeaza atat ioni pozitivi de hidroniu cat si ioni negative, iar heliul are un dublet electronic in stratul K. Tinand seama de aceste fapte, hidrogenul nu poate si situate in subgrupa metalelor alcaline sau in grupa halogenilor, iar heliul nu poate fi situate in subgrupa gazelor monoatomice.
Sistemul Periodic Al Elementelor
Bibliografie:
Chimie generala - (C.Rabega)
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |