Procesul de obtinere a ortofosfatilor de amoniu consta din neutralizarea cu amoniac a acidului fosforic, concentrarea masei de reactie (in cazul utilizarii acidului fosforic mai diluat), prelucrarea masei de reactie in produs cristalizat sau granulat, uscarea si racirea produsului obtinut.
1. Neutralizarea acidului fosforic cu amoniac
a. Chimismul procesului
Ortofosfatii de amoniu se obtin prin neutralizarea cu amoniac a acidului fosforic termic sau de extractie [26]. Reactiile de baza ale procesului sunt:
H3PO4 (l)+ NH3 (g) = NH4H2PO4 (s) DH = - 134KJ [27] (1)
H3PO4 (l)+ 2NH3 (g) = (NH4)2HPO4 (s) DH = - 210KJ [27] (2)
NH4H2PO4 (s) + NH3 (g) = (NH4)2HPO4 (s) DH = - 75,4 KJ [7] (3)
Conducerea procesului dupa reactia (1) duce la obtinerea fosfatului monoamoniacal, dupa reactia (2) la obtinerea fosfatului diamoniacal, iar dupa reactiile (1) si (3) la obtinerea amofosului (fosfat monoamoniacal cu 10-20% fosfat diamoniacal).
In cazul utilizarii acidului fosforic de extractie, datorita impuritatilor continute (Mg2+, Ca2+, Fe3+, Al3+, SO42-, H2SiF6 etc.), au loc si reactii secundare, care duc la impurificarea produsului obtinut [5, 7, 28]:
Mg2+
+H3PO4 +
2NH3 + 3H2O =
MgHPO4 3H2O + 2![]() (4)
(4)
Mg2+
+ 2H3PO4 + 4NH3 + 4H2O = Mg(NH4)2(HPO4)2 4H2O + 2![]()
Mg2+
+H3PO4 + 3NH3 + H2O = MgNH4PO4 H2O + 2![]()
Ca2+ +H3PO4 + 2NH3
+ 2H2O = CaHPO4 2H2O + 2![]() (5)
(5)
Ca2+
+ H2SO4 + 2NH3 + 2H2O = CaSO4 2H2O + 2![]()
Fe3+ +H3PO4 + 3NH3 + 2H2O = FePO4 2H2O + 3![]() (6)
(6)
2Fe3++
4H3PO4 + 8NH3 + H2O = 2FeNH4(HPO4)2 0,5H2O + 6![]() Al3+ +H3PO4 + 3NH3 + 2H2O = AlPO4 2H2O + 3
Al3+ +H3PO4 + 3NH3 + 2H2O = AlPO4 2H2O + 3![]() (7)
(7)
2Al3++ 4H3PO4 + 8NH3 + H2O = 2AlNH4(HPO4)2 0,5H2O
+ 6![]() H2SO4
+ 2NH3 = (NH4)2SO4
(8)
H2SO4
+ 2NH3 = (NH4)2SO4
(8)
H2SiF6 + 2NH3 = (NH4)2SiF6 (9)
Odata cu cresterea continutului de acid sulfuric liber si de acid hexafluorosilicic in acidul fosforic, rezulta un produs cu un continut mai ridicat in azot si mai scazut in P2O5 total.
In timpul procesului de neutralizare se mai formeaza si alte combinatii complexe, a caror compozitie depinde de pH-ul masei de reactie. In procesul de neutralizare, pana la pH=2,5, se formeaza o faza solida ce consta din NH4H2PO4, (NH4)2SO4, (NH4)2SiF6, (Fe, Al)3NH4H8(PO4)6 6H2O, (Fe, Al)Mg(NH4)2(HPO4)2F3 [29], CaSO4 2H2O, CaHPO4 2H2O si MgHPO4 3H2O [30]. La pH 2,4 practic tot fierul si cea mai mare parte a aluminiului trec in faza solida [31].
Neutralizarea pana la pH 4,5 duce la micsorarea continutului de(Fe, Al)3NH4H8(PO4)6 6H2O si la aparitia in sistem a (Fe, Al)NH4(HPO4)2 0,5H2O [30], respectiv (Fe, Al)NH4HPO4F2 [32], (NH4)3AlF6 [28].
Neutralizarea pana la pH 5,5 duce la formarea si a FePO4 2H2O, AlPO4 2H2O, MgNH4PO4 H2O [30, 33], ZnNH4PO4 si UO2NH4PO4 [34]. La pH 5-6,5 fosfatii de aluminiu cristalizeaza in cateva zile in forma de (Fe, Al)(NH4)2H(PO4)2 4H2O, (Fe, Al)(NH4)2H2F(PO4)2 [28], iar la pH 7 in forma de (Fe,Al)(NH4)PO4OH 2H2O [7].
In cazul utilizarii fosfatilor (amofosului) ca ingrasaminte, pentru a evita formarea combinatiilor complexe neasimilabile de catre plante, este necesar ca procesul de neutralizare sa aiba loc la pH>3, respectiv sa nu depaseasca valoarea pH=4,5 in cazul acidului obtinut din apatita si pH=5-5,5 in cazul acidului fosforic obtinut din fosforita [7, 35].
b. Temperatura de fierbere a masei de reactie
Datorita exotermicitatii reactiilor de neutralizare cu amoniac a acidului fosforic, masa de reactie poate atinge o anumita temperatura, care depinde de concentratia acidului fosforic (tabelul 9 [7] si figura 45 [28]).
Tabelul 9. Temperatura masei de reactie in functie de concentratia acidului fosforic
|
Concentratia H3PO4, %P2O5 |
20-23 |
28-29 |
45-48 |
|
Temperatura, C |
90-95 |
105-110 |
125-135 |
Daca masa de reactie atinge temperatura de fierbere (tabelul 10 [7]) a fazei lichide, pe seama caldurii de reactie se evapora o parte insemnata din apa introdusa in sistem cu acidul fosforic, rezultand o pulpa cu un continut bine definit in umiditate (functie de concentratia initiala a acidului fosforic).
Temperatura de fierbere a pulpei nu trebuie sa depaseasca 115 C, pentru a evita pierderile de amoniac.
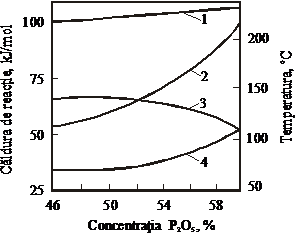
Figura 45. Dependenta caldurii de reactie si a temperaturii masei de reactie de concentratia initiala a
acidului fosforic (temperatura initiala 25 C, NH3:H3PO4=1,1-1,3)
1 - caldura de reactie, KJ/mol;
2 - temperatura masei de reactie, sC;
3 - caldura de reactie consumata pentru evaporarea apei, KJ/mol;
4 - caldura consumata pentru incalzirea sistemului, KJ/mol.
Tabelul 10. Temperatura de fierbere si densitatea masei de reactie in functie de continutul in umiditate
|
Umiditate, % |
Temperatura de fierbere, C |
Densitate la 80-90 C, Kg/m3 |
Umiditate, % |
Temperatura de fierbere, C |
Densitate la 80-90 C, Kg/m3 |
|
60 |
|
1250 |
27 |
109 |
1520 |
|
50 |
102 |
1328 |
25 |
110 |
1540 |
|
42 |
103 |
1392 |
24 |
111 |
1546 |
|
37 |
104 |
1438 |
23 |
112 |
1552 |
|
34 |
105 |
1464 |
22 |
113 |
1264 |
|
32 |
106 |
1484 |
20 |
114 |
1578 |
|
30 |
107 |
1500 |
18 |
115 |
1610 |
|
28 |
108 |
1518 |
|
|
|
Cantitatea de caldura degajata (figura 45) creste putin odata cu marirea concentratiei acidului fosforic si in medie este Q=103500 KJ/Kmol. Odata cu marirea concentratiei acidului fosforic, cantitatea de caldura consumata pentru evaporarea apei se micsoreaza in timp ce cantitatea de caldura consumata pentru incalzirea sistemului creste, ceea ce determina o ridicare a temperaturii finale a masei de reactie. Daca se preincalzeste acidul fosforic, se poate atinge o astfel de temperatura a masei de reactie, incat devine posibila obtinerea directa a produsului solid uscat, in forma de pulbere.
c. pH-ul masei de reactie
In procesul de neutralizare cu amoniac a solutiilor de acid fosforic are loc o variatie a pH-ului masei de reactie. Ca atare, pH-ul este parametrul important de control al gradului de neutralizare [36].
pH-ul solutiilor apoase de ortofosfati de amoniu depinde de concentratia acestora (in fosfati, NH3 si P2O5), respectiv de raportul molar NH3:H3PO4 (figura 46) [7, 37].
Pe nomograma din figura 46 sunt redate dependenta pH-ului solutiilor de concentratia fosfatilor de amoniu, la rapoarte molare (M) NH3:H3PO4=ct. (curbele continue), dependenta pH-ului de continutul de amoniac din solutie, la concentratia constanta a sarii si diferite rapoarte NH3:H3PO4 (curbele punctate) si dependenta pH-ului de continutul de P2O5, la concentratie constanta a fosfatilor si diferite rapoarte NH3:H3PO4 (curbele linie-punct).
Dependenta pH-ului de continutul de amoniac si P2O5, la concentratie constanta a sarurilor, deriva din aceleasi puncte de pe linia corespunzatoare raportului NH3:H3PO4 = 2,05:1. De la raportul molar din solutie NH3:H3PO4 se poate trece usor la continutul masic in fosfat mono si diamoniacal al produsului solid, folosind graficul din figura 47 [7].
Folosirea nomogramei. Prin punctele corespunzatoare valorii pH-ului solutiei si continutului de amoniac sau P2O5 in solutie se duc perpendiculare pe axe si se afla punctul de intersectie al acestora. Dupa curba continua, care trece prin acest punct, se determina raportul molar NH3:H3PO4. In continuare, se merge pe curba punctata (cand se cunoaste concentratia NH3) sau pe curba punct-linie (cand se cunoaste concentratia P2O5) si se afla punctul de intersectie cu linia continua, corespunzator raportului molar NH3:H3PO4=2,05:1. Verticala dusa din acest punct pana la axa concentratiei da concentratia fosfatilor din solutie. Cunoscand raportul molar NH3:H3PO4 din diagrama din figura 47 se determina raportul masic NH4H2PO4: (NH4)2HPO4 in produsul uscat si se calculeaza concentratia lor in solutia analizata
Intre pH-ul masei de reactie si raportul molar NH3:H3PO4 exista o dependenta bine definita. Alura curbei este determinata de concentratia si compozitia acidului fosforic utilizat.
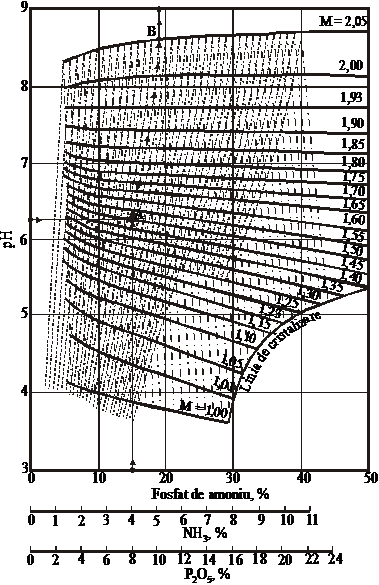
Figura 46. Nomograma pentru determinarea raportului molar (M) NH3:H3PO4 si a concentratiei solutiilor
apoase de ortofosfati de amoniu in functie de pH - ul solutiei si de concentratia unuia
din componenti (NH3 sau H3PO4)
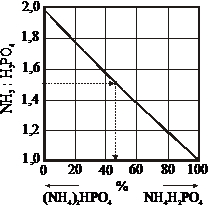
Figura 47. Graficul pentru trecerea de la raportul
molar NH3:H3PO4 la raportul de masa
NH4H2PO4:(NH4)2HPO4
In cazul utilizarii acidului fosforic pur, alura curbelor depinde in mica masura de concentratia acidului fosforic (figura 48 a, b si c) [1, 2].
Curbele prezinta trei inflexiuni, la pH 4,5; pH 6 si pH 9, corespunzator unor rapoarte molare NH3:H3PO4 = 0,8 , 1,0 si 1,6.
In
cazul folosirii acidului fosforic cu impuritati (SO![]() ; Fe
; Fe![]() , Al
, Al![]() ), alura curbei dependentei pH-ului masei de reactie de
raportul molar NH3:H3PO4 este diferita (figura 48 d
si e) de curbele corespunzatoare
acidului fosforic pur. Curbele prezinta doua inflexiuni, la pH 5 si pH 8,8, corespunzator unor
rapoarte molare NH3:H3PO4=1,0 si NH3:H3PO4=2,0. Continutul de impuritati nu
influenteaza alura curbelor, ci numai in mica masura raportul molar NH3:H3PO4
la care apar inflexiunile, in special in cazul SO
), alura curbei dependentei pH-ului masei de reactie de
raportul molar NH3:H3PO4 este diferita (figura 48 d
si e) de curbele corespunzatoare
acidului fosforic pur. Curbele prezinta doua inflexiuni, la pH 5 si pH 8,8, corespunzator unor
rapoarte molare NH3:H3PO4=1,0 si NH3:H3PO4=2,0. Continutul de impuritati nu
influenteaza alura curbelor, ci numai in mica masura raportul molar NH3:H3PO4
la care apar inflexiunile, in special in cazul SO![]()
d. Vascozitatea masei de reactie
Procesul de neutralizare trebuie condus astfel incat sa se obtina o masa de reactie de o consistenta bine definita, usor de transportat.
Vascozitatea sau consistenta masei de reactie depinde de concentratia acidului fosforic, de solubilitatea din sistemul NH3-P2O5 - H2O, de concentratia sarurilor, de raportul molar NH3:H3PO4, respectiv pH-ul masei de reactie, de continutul impuritatilor, de umiditate, de temperatura etc. [7]. La ceilalti parametrii constanti, vascozitatea masei de reactie scade odata cu cresterea continutului de umiditate si marirea temperaturii (figura 49) [28].
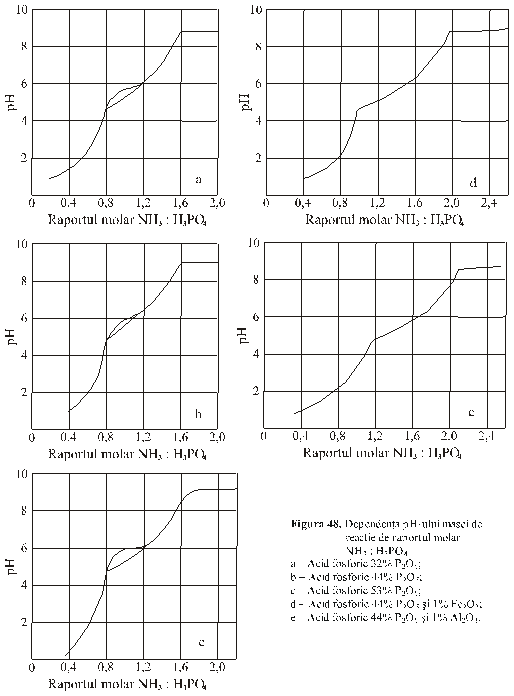
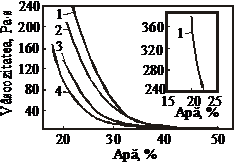
Figura 49. Dependenta vascozitatii masei de reactie de umiditate, la pH=5,5 si diferite temperaturi
1-105 C; 2-100 C; 3-95 C (acid fosforic din fosforite); 4-105 C (acid fosforic din apatita
Consistenta masei de reactie este, cu atat mai pronuntata, cu cat concentratia acidului fosforic supus neutralizarii este mai mare si cu cat solubilitatea in sistem este mai mica
Dependenta vascozitatii masei de reactie de pH, respectiv de raportul NH3:H3PO4, este functie de compozitia combinatiilor care se formeaza in procesul de neutralizare cu amoniac a acidului fosforic [28].
Continutul de impuritati (compusi cu fluor, fier, aluminiu, magneziu etc.) influenteaza vascozitatea masei de reactie. Cu cat continutul acestora este mai redus, cu atat scade consistenta masei de reactie, respectiv se realizeaza conditii mai bune ale procesului de neutralizare.
e. Presiunea de vapori a amoniacului
La neutralizarea acidului fosforic cu amoniac, odata cu cresterea raportului NH3:H3PO4, respectiv a pH-ului masei de reactie si a temperaturii, se mareste presiunea de vapori deasupra masei de reactie (figurile 50 si 51) [38], ceea ce determina pierderi de amoniac (figura 52).
Pentru a evita pierderile excesive de amoniac, mai ales in cazul fosfatului diamoniacal, este indicat sa se lucreze la o temperatura si un raport NH3:H3PO4 bine definite. In cazul obtinerii fosfatului diamoniacal putem avea pierderi minime de amoniac daca se lucreaza la un pH mai scazut decat pH-ul solutiei obtinute prin dizolvarea sarii pure. Pierderile de amoniac se maresc odata cu cresterea pH-ului solutiei (figura 52) deoarece acesta depinde de raportul NH3:H3PO4.
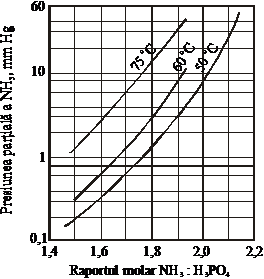
Figura 50. Presiunea de vapori a amoniacului
deasuprasolutiilor saturate de
ortofosfati de amoniu in functie
de raportul NH3:H3PO4
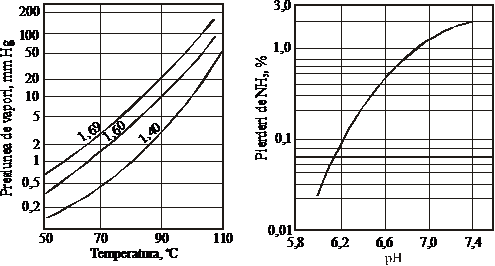
Figura 51. Presiuneade vapori a amoniaculuiFigura 52. Pierderile de amoniac in functie de pH
deasupra solutiilor saturate de
ortofosfati de amoniu in functie de
temperatura
f. Solubilitatea in sistemul NH3-H3PO4-H2O
La obtinerea ortofosfatilor de amoniu cristalizati, pentru stabilirea conditiilor optime ale procesului, trebuie sa se tina seama de solubilitatea in sistemul NH3-H3PO4-H2O (figura 53). Solubilitatea este functie de raportul molar NH3:H3PO4, respectiv de pH-ul mediului (figura 54) [7].
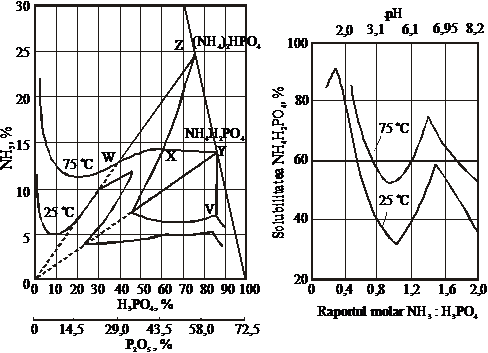
Figura 53. Diagrama de faza in sistemul Figura 54. Dependenta solubilitatii fosfatilor
NH3-H3PO4-H2O de amoniu de pH
Functie de raportul NH3:H3PO4, se pot alege conditiile de cristalizare a celor doi fosfati. Domeniul fosfatului monoamoniacal este delimitat de dreapta YX, iar a fosfatului diamoniacal de dreapta XZ. In cadrul triunghiului XYZ sunt prezenti fosfatul diamoniacal solid, fosfatul monoamoniacal solid si solutia muma. In punctul X, la 75 C, fosfatul mono si diamoniacal vor fi in proportii egale, iar raportul molar NH3:H3PO4=1,45. In acest punct solubilitatea celor doua saruri este maxima. Solubilitatea in punctul X scade odata cu micsorarea temperaturii (figura 53). La temperaturi scazute (-5 C pana la 10 C), solubilitatea maxima corespunde unui raport molar NH3:H3PO4=1,55 [39].
In triunghiul XZW avem numai cristale de fosfat diamoniacal si solutie muma. Prin urmare, pentru a obtine fosfat diamoniacal, este necesar sa se lucreze la un raport NH3:H3PO4>1,45, iar pentru a obtine fosfat monoamoniacal, la NH3:H3PO4<1,45 (figura 55). Pentru a obtine fosfatul monoamoniacal, se lucreaza la un raport NH3:H3PO4=1-1,1 si la pH=4-4,5 (figura 55).
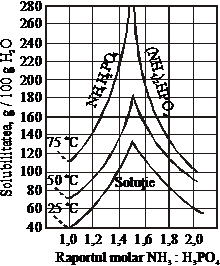
Figura 55. Solubilitatea maxima in sistemul
NH3-H3PO4-H2O, la diferite temperaturi
Acestor conditii le corespund pierderi neinsemnate de amoniac, o solubilitate minima, o buna separare si proprietati bune de pastrare a fosfatului monoamoniacal. La obtinerea fosfatului diamoniacal, in general, parametrii procesului sunt: raport molar NH3:H3PO4=1,7-1,8 si pH=7,5. In aceste conditii, vascozitatea solutiei are valoare mica si rezulta cristale de compozitie granulometrica buna [41].
2. Concentrarea masei de reactie
In procesul de neutralizare, in functie de concentratia acidului fosforic (22-54% P2O5), rezulta o masa de reactie cu un continut de 65-18% umiditate. Prelucrarea masei de reactie in produs finit granulat presupune un continut bine definit in umiditate (18-25%), iar obtinerea fosfatilor de amoniu cristalizati necesita o solutie cu un continut de 34-36% P2O5. Continutul de umiditate in masa de reactie se poate micsora prin concentrare in evaporatoare peliculare, in doua sau trei trepte [42], sau uscare partiala a masei de reactie prin pulverizare si amestecare cu restul de masa de reactie.
3. Prelucrarea masei de reactie in produs cristalizat sau granulat
Pentru obtinerea ortofosfatilor de amoniu cristalizati, se utilizeaza solutii cu 34-36% P2O5. Procesul de cristalizare are loc prin racirea acestor solutii, la 18-20 C, cand se realizeaza un grad de cristalizare de 95% [42] si rezulta un produs cu cca. 6% umiditate.
Ortofosfatii de amoniu granulati se obtin prin granularea unui amestec format din masa de reactie cu umiditate bine definita (18-25%) si retur, respectiv din produs pulbere si retur. Produsul supus granularii trebuie sa aiba o anumita umiditate si temperatura optima, determinate de compozitia acestuia si de sistemul de granulare [41]. Intre umiditatea produsului si temperatura de granulare exista o interdependenta bine definita (figura 56) [7, 42].
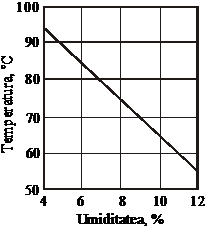
Figura 56. Dependenta umiditatii optime a amofosului de
temperatura de granulare in granulatorul
snec
Procesul de granulare poate sa aiba loc intr-un interval larg de temperatura (55-95 C), corespunzator unui continut variabil de umiditate (4-12%). La un continut de umiditate mai mare de 12%, se formeaza fractiunea mare a granulelor in proportie mai ridicata si creste capacitatea de lipire a granulelor. Aceasta atrage dupa sine obtinerea unei parti importante din fractia utila, ca rezultat al macinarii fractiunii mari si sortarii, si nu direct in faza de granulare.
Procesul de granulare se realizeaza in granulator tambur, granulator snec si granulatoare-uscatoare tambur [43, 44], amonizator-granulator [45], in turn si in strat fluidizat [7, 42].
4. Uscarea si racirea ortofosfatilor de amoniu
Ortofosfatii de amoniu cristalizati sau granulati au un continut de umiditate bine definit, in functie de modul de obtinere. Din aceasta cauza, ei se supun procesului de uscare, cand umiditatea este redusa sub 1%. Pentru a evita pierderile de amoniac in faza de uscare este necesar sa se mentina o anumita temperatura optima, care este functie de compozitia produsului supus uscarii. Temperatura optima in cazul fosfatului monoamoniacal este de 100-110 C, a amofosului de 80 C [3, 46], iar a fosfatului diamoniacal de 50-60 C [3,47]. In asemenea conditii, pierderile de amoniac sunt de 0,1-0,2% [5].
Uscarea se realizeaza cu gaze de ardere cu o temperatura bine definita la intrare si iesire din uscator. Temperatura gazelor este determinata de compozitia produsului si de modul de realizare a uscarii, in echicurent sau contracurent. Procesul de uscare se realizeaza prin pulverizare in turnuri sau in uscatoare tambur.
Ortofosfatii de amoniu uscati se supun procesului de racire pana la temperatura de 40-45 C. Racirea se realizeaza cu aer de 20 C, de obicei in strat fluidizat.
|
Politica de confidentialitate |
| |
Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |