Un element galvanic este un dispozitiv care genereaza curent electric printr-un proces chimic ( mai este cunoscut si sub numele de pila electrica Un exemplu de element galvanic este elementul Daniell, constituit dintr-o bara de cupru imersata intr-o solutie de sulfat de cupru care, prin intermediul unei punti de sare este in contact cu o solutie de sulfat de zinc in care se gaseste o bara de zinc (Figura 59).
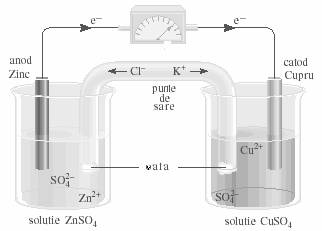
Figura 59. Elementul galvanic Daniell
Atunci cind circuitul se inchide in intreg sistemul alcatuit din celula electrochimica, conductorii exteriori si aparat de masura apar doua circuite ale purtatorilor de sarcina: unul interior si altul exterior. Aparatul de masura indica trecerea unui curent prin exterior, al carui sens va fi de la electrodul de zinc, la electrodul de cupru. Inseamna ca electrodul de cupru va fi polul pozitiv al elementului galvanic, iar electrodul de zinc - polul negativ.
La generarea energiei electrice in circuitul exterior, pe electrodul de cupru are loc reducerea ionilor de cupru la atomi de cupru:
Cu2+ + 2e- Cu
Iar pe cel de de zinc are loc oxidarea metalului:
Zn Zn2+ + 2e-
Rezulta ca, in elementul Daniell, electrodul de cupru este catod (polaritatea cuprului este pozitiva), iar electrodul de zinc este anod (polaritate negativa).
Prin insumarea reactiilor de la electrozi se obtine reactia globala a celulei:
Cu2+ + Zn Cu + Zn2+
Electrodul la care are loc oxidarea se numeste anod, iar cel in care are loc reducerea se numeste catod. Acest proces este posibil deoarece zincul are tendinta mai mare decat cuprul de a pierde 2 electroni si de a se transforma in ioni pozitivi, altfel zis potentialul de electrod al zincului este mai mare decat potentialul de electrod al cuprului. Forta electromotoare (f.e.m.) a pilei este egala cu suma algebrica a potentialelor celor doi electrozi inclusiv potentialul de contact dintre cei doi electrozi. Ea deteremina deplasarea electronilor de la electrodul cu potential mai ridicat spre electrodul cu potential mai scazut. Prin circuitul exterior purtatorii de sarcina sunt electronii care circula de la Zn la Cu , iar in circuitul interior asigurat de puntea de sare (o solutie de agar care contine o solutie salina de KCl) ionii de K+ si Cl- se deplaseaza in sensul compensarii deficitului de sarcina ce apare ca urmare a saracirii semicelulei catodului in ionii de Cu2+ si imbogatirii semicelulei anodului in ioni de Zn2+. Pentru a ilustra procesele care au loc in celulele electrochimice s-au adoptat prin conventie urmatoarele reguli de notare a celulelor:
1) Pentru a ilustra limita dintre faze (de ex. intre un electrod solid si solutie) se foloseste o linie verticala (I) .Exemplu: Pt I H+
2) Contactul electrolitic dintre doua semicelule (de exemplu prin folosirea unei punti de sare) se reprezinta printr-o linie verticala dubla II . Exemplu:Pt/H+ // Ag+/Ag
3) In mod arbitrar electrodul din partea dreapta a celulei este considerat catod (si incarcat pozitiv) iar cel din partea stanga anod (si incarcat negativ).
4) Potentialul celulei este dat de expresia:
Eo dreapta (red) + Eo stanga (ox) = Eo celula
Asadar elementul Daniell se va nota prin urmatorul lant electrochimic (in care // reprezinta puntea de sare ce uneste cele doua semicelule).
(-)Zn I Zn2+ I I Cu2+ I Cu (+)
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |