PROTIDE. REACTII CARACTERISTICE
1.Consideratii generale
Protidele sunt cele mai importante substante naturale din organismele vii. Ele intra in alcatuirea protoplasmei si a nucleului celular si au rol structural si functional fundamental.
In organismele animale protidele reprezinta aproximativ 65-70% din materia uscata a acestora; in plante se gasesc intr-un procent mai mic, fiind cuprins intre 3-35%.
Sub aspectul compozitiei chimice,protidele sunt substante cuaternare, formate din cel putin patru elemente: C,H,O,N. Numeroase protide contin sulf, fosfor si unele metale(Fe,Cu,Mg,Mn).
Dupa reactia de hidroliza, protidele se impart in doua grupe mari:monoprotide si poliprotide.
Monoprotidele se mai numesc si aminoacizi, sunt substante simple, monomoleculare care nu hidrolizeaza.
Poliprotidele sunt substante formate din mai multe resturi de aminoacizi, unite prin intermediul legaturilor peptidice. Ele hidrolizeaza sub actiunea acizilor, bazelor sau enzimelor.
Din grupa poliprotidelor superioare fac parte proteinele si proteidele. Proteinele sunt formate numai din aminoacizi, iar proteidele contin in molecula lor si substante neproteice.
Proteinele se deosebesc de celelalte componente ale celulelor prin proprietati unice. Sunt proteine unele substante cu activitate biologica ale celulelor: enzimele, pigmentii respiratori, hormonii, anticorpii.
Se disting pe baza de solubilitate doua clase de proteine: insolubile(fibroase), care au functiunea de a conferi tesuturilor rezistenta mecanica si proteine solubile(globulare), care apar in celule in stare dizolvata sau sub forma de geluri hidratate, fiind solubile in apa sau solutii de electroliti.
Din prima clasa fac parte keratina, colagenul,miosina, fibroina. Acestea se dizolva numai in acizi sau baze concentrate, la cald, dar aceasta dizolvare este insotita de o degradare a macromoleculelor; din solutia obtinuta nu se mai regenereaza proteina initiala.
Din a doua clasa fac parte proteinele cu proprietati fiziologice specifice: proteinele din serul sanguin, enzimele, anticorpii, hormonii proteici si toxinele.
2. Reactii caracteristice protidelor
Reactiile chimice prin care pot fi identificate protidele se impart in:
2.1. Reactii de culoare:
generale
specifice
2.2. Reactii de precipitare
Experientele se fac cu solutii proteice concentrate sau diluate.
2.1. Reactii de culoare pentru proteine
Reactiile de culoare pentru proteine se datoreaza fie intregii molecule proteice, fie anumitor aminoacizi componenti.
A. Reactii datorate intregii molecule proteice
2.1.1. Reactia ninhidrinei
Principiu:
Proteinele, peptidele si aminoacizii incalziti in prezenta ninhidrinei dau nastere la o coloratie albastra - violeta, care se datoreaza gruparilor -NH2 libere. Reactia necesita deci grupe -NH2 libere.
Ninhidrina este un tricetohidrinden hidrat.
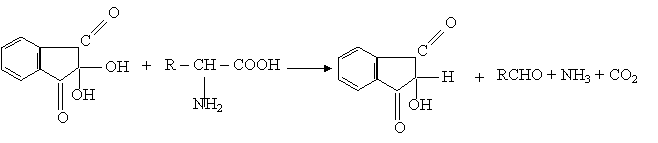 Reactii chimice:
Reactii chimice:
Experienta Substante necesare:
solutie proteica diluata (sau solutie de aminoacizi)
solutie de ninhidrina 0,1% in butanol (sau apa)
Mod de lucru:
Intr-o eprubeta se iau 2 - 3 ml solutie proteica diluata, la care se adauga 0,5 ml solutie 0,1% ninhidrina in butanol. Se incalzeste apoi eprubeta pana la fierbere si pe urma se raceste la un curent de apa. Se observa formarea unei coloratii albastre - violete. Reactia poate servi si pentru developarea cromatogramelor.
2.1.2. Reactia biuretului
Principiu:
Aceasta reactie se bazeaza pe formarea unor chelati colorati intre substantele proteice si unele metale (Cu, Co, Ni).
Numele reactiei provine de la biuret, substanta ce se formeaza din doua molecule de uree prin eliminare de NH3.
Reactii chimice:
--------->
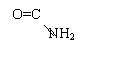
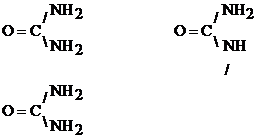 + NH3
+ NH3
Reactia biuretului se datoreaza legaturii peptidice -CO-NH- si este pozitiva incepand cu tripeptidele. Peptidele dau o culoare rosie - violeta, proteinele o culoare violeta - albastra.
Sarurile de amoniu deranjeaza reactia, insa acest lucru se poate evita prin adaugarea unui exces de NaOH. Mecanismul acestei reactii consta in faptul ca legatura peptidica formeaza cu ionii Cu2+ complecsi solubili colorati.
Reactia este pozitiva si cu substantele care contin in molecula gruparea -CSNH2. Ionul de cupru poate fi inlocuit cu Ni sau Co. Reactia are sensibilitate de 1 : 10.000 si in conditii bine determinate, poate servi la dozarea colorimetrica a proteinelor.
Experienta Substante necesare:
solutie CuSO4 1%
solutie proteica diluata
solutie NaOH 10%
Mod de lucru:
La un volum de 2 ml solutie de cercetat se adauga un volum egal de NaOH 10% si apoi 3 - 5 picaturi solutie CuSO4 1%. Lichidul se coloreaza in albastru violet. In cazul unui continut mic de proteine apare o culoare insuficient de clara. Se repeta experienta, adaugandu-se la suprafata solutiei de cercetat alcalinizata un strat nemiscibil de 0,5 - CuSO4. In acest caz la limita dintre straturi apare un inel violet.
B. Reactii de culoare datorate unor aminoacizi
2.1.3. Reactia xantoproteica
Principiu:
Proteinele care contin aminoacizi ciclici dau in prezenta acidului azotic si dupa o alcalinizare ulterioara, nitroderivati de culoare galben-portocalie.
Reactii chimice
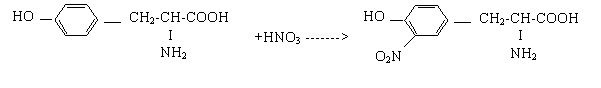
Tirozina Nitroderivat
O reactie similara se petrece cand cade pe piele o picatura de HNO3, se formeaza o pata galbena care nu se poate spala, deoarece sunt atacate chiar proteinele pieii.
Tirozina se coloreaza imediat, fenilalanina numai in prezenta acidului sulfuric concentrat, iar triptofanul da o culoare mai rosie.
Experienta Substante necesare:
solutie proteica diluata
acid azotic concentrat
hidroxid de amoniu concentrat
Mod de lucru:
La 2-3 ml solutie proteica se adauga aproximativ 1 ml HNO3, concentrat. Apare o tulbureala sau un precipitat alb care prin fierbere se transforma in galben. Se raceste solutia si se adauga cateva picaturi de NH4OH pana la aparitia culorii portocalii.
Majoritatea proteinelor contin in molecula lor aminoacizi ciclici si heterociclici, deci reactia este pozitiva la aproape toate proteinele.
2.1.4. Reactia Millon (reactia tirozinei)
Principiu:
Reactia Milon are loc la tratarea solutiei unei proteine cu o solutie de azotat mercuric in acid azotic. Reactia se datoreaza prezentei aminoacizilor, ce contin o grupare fenolica (de exemplu tirozina) din molecula substantei proteice. Reactia nu este specifica intrucat este o reactie a fenolilor.
Experienta Substante necesare:
solutie proteica diluata
reactiv Millon (15 ml mercur se dizolva in 300 ml HNO3 concentrat. Se lasa 24 ore sub nisa. Se dilueaza la un litru cu apa distilata.
Mod de lucru:
La 2 ml de solutie proteica se adauga 0,5 ml reactiv Millon. Se observa aparitia unui precipitat de culoare galbena, datorita actiunii acidului azotic asupra moleculei proteice.
Se incalzeste continutul eprubetei cu prudenta pana la 600C. Se observa strangerea precipitatului intr-un coagul de culoare roz, uneori solutia devine rosie.
2.1.5.. Reactia triptofanului (reactia Adamkiewicz)
Principiu:
Triptofanul reactioneaza in mediu acid cu diferite aldehide, dand compusi colorati. Gelatina si zeina fiind lipsite de triptofan, nu dau aceasta reactie.
Experienta Substante necesare:
aldehida formica diluata (10 ml formol 40% in 100 ml apa)
nitrit de sodiu 1%
acid clorhidric concentrat
Mod de lucru:
Intr-o eprubeta se iau 2 - 3 ml solutie proteica concentrata (din ou) si se adauga acid clorhidric concentrat pana la dizolvarea precipitatului, care incepe sa se formeze la adaugarea acidului . Se adauga trei picaturi aldehida formica diluata si se lasa cateva minute in repaus. Se adauga apoi cu atentie o singura picatura de nitrit de sodiu. Apare o culoare violeta. Experienta se poate repeta cu lapte in acelasi mod, insa dupa adaugarea aldehidei se va lasa in repaus 10 - 15 minute inainte de adaugarea nitritului.
2.1.6. Reactia argintinei (reactia Sakaguchi)
Principiu:
Proteinele care contin in molecula lor un radical guanidinic dau in mediu alcalin in prezenta b-naftolului si a hipocloritului de sodiu complecsi colorati in rosu.
Experienta Substante necesare:
solutie proteica diluata
solutie hipoclorit de sodiu ( se barboteaza un curent de clor printr-o solutie de NaOH 10%)
![]()
solutie a-naftol (se dizolva 0,1 g a-naftol in aproximativ 25 ml alcool etilic si se dilueaza cu apa la 100 ml)
Mod de lucru:
Se iau intr-o eprubeta 2 ml de solutie proteica si se alcalinizeaza cu 2 ml solutie de NaOH 10%. Se adauga 2 ml solutie de a-naftol si solutie de hipoclorit de sodiu, picatura cu picatura, pana la aparitia unei culori visinii. Culoarea dispare la cald.
2.1.7. Reactia datorata aminoacizilor cu sulf
Principiu:
Prin fierberea unei solutii proteice cu hidroxizi alcalini, sulful din aminoacizii cu sulf (cistina, cisteina, metionina), ce intra in componenta substantelor proteice, este pus in libertate sub forma de sulfura de sodiu.
Anionul S2- poate fi pus in evidenta cu ajutorul sarurilor de plumb.
Reactii chimice:
R - SH + 2NaOH = Na2S + R - OH + H2O
Na2S + Pb (Ch3COO)2 = PbS + 2CH3-COONa
Experienta Substante necesare:
albus de ou sau alta solutie proteica ce contine cisteina, cistina, metionina
solutie NaOH 40%
Pb (Ch3COO)2 solutie saturata
Mod de lucru:
Intr-o eprubeta se introduce putin albus de ou nediluat (circa 2 - 3 ml) si se adauga 3 ml solutie de hidroxid de sodiu 40%. Se fierbe timp de doua minute. Se adauga 1 ml solutie de acetat de plumb. Solutia se inchide la culoare si se observa aparitia unui precipitat negru de sulfura de plumb.
2.2. Reactii de precipitare a proteinelor
Reactiile de precipitare ale proteinelor servesc ca metoda de separare si de identificare a acestora. Cu toate ca sunt foarte variate ele se pot grupa astfel:
2.2.1. Reactii de precipitare reversibile, in care proteinele isi pastreaza structura moleculara nativa. Cu toate ca sunt foarte variate, ele se pot redizolva prin diferite metode.
Dintre precipitarile reversibile fac parte cele cu alcool diluat, acetona diluata, reactiile de salifiere si altele.
2.2.2. Reactii de precipitare ireversibile, in care are loc denaturarea proteinelor si alterarea structurii lor, asa incat nu mai pot reveni la structura initiala.
Dintre precipitarile ireversibile fac parte reactiile cu sarurile metalelor grele, cu reactivii alcaloizilor, coagularea prin fierbere si altele.
2.2.1.1. Precipitarea cu alcool
Principiu:
Alcoolul si unii solventi organici fixeaza (extrag) apa care hidrateaza molecula proteinei; miceliile lipsite de apa flocuneaza.
Daca precipitatul obtinut este separat repede de alcool, proteina poate fi redizolvata in apa: precipitarea este deci reversibila. Denaturarea nu a avut timp sa se produca. Dupa un contact prelungit cu alcoolul, proteina se denatureaza si devine insolubila in apa. Variind concentratia alcoolului, pH-ul si temperatura de precipitare, diferitele proteine pot fi precipitate fractionat.
Experienta Substante necesare:
solutie proteica
alcool 95%
Mod de lucru:
La o cantitate de 2 ml solutie de proteina se adauga un volum egal de alcool si se agita puternic. Dupa catva timp se observa un precipitat fin din proteina. Se adauga apoi in eprubeta 10 ml apa. Se observa redizolvarea precipitatului prin diluarea alcoolului.
2.2.1.2. Salifierea proteinelor
Principiu:
Sub influenta unor saruri de amoniu sau ale metalelor usoare are loc deshidratarea reversibila a miceliilor proteice. Prin diluarea cu apa a solutiilor, proteinele se solubilizeaza din nou. Metoda serveste pentru separarea fractionata a proteinelor.
Experienta Substante necesare:
solutie proteica
sulfat de amoniu solutie saturata
Mod de lucru:
La 1 - 2 ml solutie de proteina se adauga un volum egal din solutia de sulfat de amoniu si se agita usor amestecul.
Apare o tulbureala sau fulgi, care se depun sub forma de precipitat.
Globulinele din ser, sau alte lichide biologice, precipita cu (NH4)2SO4 50%, iar albuminele numai cu solutie saturata de (NH4)2SO4.
Proteinele astfel precipitate se pot separa si se redizolva prin diluare, trecand in solutie, fara sa se produca denaturarea lor. Aceasta metoda se foloseste pentru separarea albuminelor de globuline.
2.2.1.3.Precipitarea proteinelor cu acizi minerali
Principiu:
Majoritatea acizilor minerali (sulfuric, clorhidric, metafosforic, azotic), precipita proteinele, iar acest precipitat se dizolva in exces de acid (exceptie face acidul azotic).
Experienta Substante necesare:
acid clorhidric concentrat
acid azotic concentrat
solutie de proteina (solutie de albus de ou: la un volum de albus se adauga 18 - 20 volume de apa, se filtreaza prin cateva straturi de tifon)
Mod de lucru:
Intr-o eprubeta se ia 1 ml solutie proteica si se adauga cu atentie la 1 ml HCl concentrat. La nivelul de separare a celor doua lichide se formeaza un inel alb. Prin agitare se clarifica (dizolvarea in exces de reactiv).
In alta eprubeta se ia 1 ml acid azotic concentrat si se adauga cu atentie solutia proteica. La nivelul de separare se formeaza un inel de proteina precipitata, care nu se dizolva la agitare.
Aceasta reactie ,utilizand acid azotic de diferite dilutii serveste la dozarea albuminelor din urina.
2.2.1.4. Precipitarea proteinelor cu acizi organici
Principiu:
Proteinele precipita cu acidul naftalinsulfonic, acidul tricloracetic si sulfosalicilic. Precipitarea cu acid tricloracetic se utilizeaza pentru indepartarea proteinelor din lichidele biologice, deoarece cu acest acid precipita numai proteinele.
Experienta Substante necesare:
solutie proteica
solutie de acid tricloracetic 3%
solutie de acid sulfosalicilic 15 - 20%
Mod de lucru:
Peste 2-3 ml solutie proteica se adauga 0,5 - 1 ml acid tricloracetic 3%. Se observa formarea unui precipitat abundent.
In alta eprubeta se iau 1 - 2 ml solutie de acid sulfosalicilic. Se formeaza un precipitat cu aspectul unui nor alb.
2.2.1.5. Precipitarea proteinelor cu reactivul Esbach
Principiu:
Acest reactiv este in mod curent folosit in clinica pentru depistarea si dozarea albuminelor din urina.
Experienta Substante necesare:
solutie proteica
reactiv Esbach: 10 g acid picric, 26 g acid citric si apa distilata pana la 1000 ml
Mod de lucru:
Intr-o eprubeta se introduc 1 - 2 ml solutie proteica si se adauga un volum egal de reactiv Esbach. Se obtine un precipitat galben, care nu se dizolva la incalzire. Daca reactia se produce in tuburi gradate, se poate determina cantitatea de proteina din urina.
2.2.2.1. Coagularea proteinelor
Principiu:
Moleculele substantelor proteice au un caracter amfoter. In functie de concentratia ionilor de H+ din solutie, molecula se incarca cu sarcini pozitive sau negative. Concentratia ionilor de hidrogen la care molecula de proteina are un numar egal de sarcini pozitive si negative se numeste punct izoelectric. In majoritatea cazurilor constanta de disociere a proteinei ca acid, depaseste constanta de disociere a aceleiasi proteine ca baza. O particula pusa deci in solutie apoasa este incarcata de obicei negativ.
Prin acidularea treptata a unei astfel de solutii, gradul de disociere al proteinei ca baza se mareste (neutralizarea ionilor OH-). In acest mod se poate realiza o concentratie egala a ionilor pozitivi si negativi. La punctul izolelectric particulele coloidale devin electric neutre; solutia de proteina fiind putin stabila, precipita foarte usor.
Concentratia ionilor de hidrogen la care se realizeaza punctul izoelectric este o marime ce caracterizeaza proteina si care variaza intre limitele de pH 4,1 - 6,7.
Experienta : Substante necesare:
acetat de sodiu 0,1 n
solutie de acid acetic 0,1 n
solutie de gelatina 1%
alcool etilic 90%
Mod de lucru:
Se iau reactivii intr-o serie de 6 eprubete conform tabelului urmator:
|
Se adauga |
Numarul eprubetei |
|||||
|
pH corespunzator | ||||||
|
Amestec tampon (ml) | ||||||
|
Solutie de gelatina 1% (ml) | ||||||
In eprubeta a IV-a se adauga cu grija, agitand, alcool cu pipeta pana apare o slaba tulbureala. De obicei sunt necesari aproximativ 8 ml. Aceeasi cantitate de alcool se adauga si in celelalte eprubete. Dupa adaugarea alcoolului se agita continutul eprubetelor. Se lasa eprubetele in repaus 30 de minute si se noteaza eprubeta in care s-a format cea mai mare cantitate de precipitat. Valoarea pH-ului corespunzator reprezinta pH-ul izoelectric al gelatinei care trebuie sa fie de 4,7.
Amestecuri tampon acetat de sodiu - acid acetic
|
pH |
CH3COONa 0,1 n (ml) |
CH3COOH 0,1 n (ml) |
Apa (ml) |
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |