
Termodinamica disocierii oxizilor de fier
Fierul are trei oxizi: Fe2O3, Fe3O4 si FeO(wüstita). Wüstita este stabila termodinamic numai peste 572 sC (845 K) si chiar daca poate fi detectata si la temperaturi mai joase tendinta ei este de a se transforma in Fe3O4 dupa reactia:
4FeO = Fe3O4 + Fe.
Rezulta ca reactiile de disociere trebuie grupate in raport cu
T = 572 sC (845 K).
La T > 572 sC (845 K)
1)
6Fe2O3 = 4Fe3O4 + O2 ΔG![]() = 485 587 - 281,5
= 485 587 - 281,5![]()
2)
2 Fe3O4 = 6FeO + O2 ΔG![]() = 635 964 - 254,07
= 635 964 - 254,07![]()
3)
2FeO = 2Fe + O2 ΔG![]() = 538 760 - 139,21
= 538 760 - 139,21![]()
La T < 572 sC (845 K)
1)
6Fe2O3 = 4Fe3O4 + O2 ΔG![]() = 485 587 - 281,5
= 485 587 - 281,5![]()
4)
![]() Fe3O4 =
Fe3O4 = ![]() Fe + O2 ΔG
Fe + O2 ΔG![]() = 563 042 - 167,93
= 563 042 - 167,93![]()
Daca
consideram ipoteza ca sistemul este monovariant (oxizii fierului
si fierul sunt substante pure, deci aMe = aMeO = 1), pentru toate
reactiile de disociere Kp
= P![]() .
.
Pentru calculul tensiunii de disociere se folosesc relatiile:
1)
lg P![]() =
= ![]() + 14,7
+ 14,7
2)
lg P![]() =
= ![]() + 13,37
+ 13,37
3)
lg P![]() =
= ![]() + 7,27
+ 7,27
4)
lg P![]() =
= ![]() + 8,77
+ 8,77
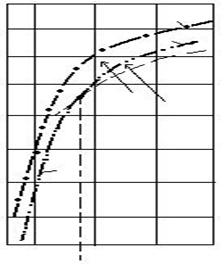
Pantele
curbelor sunt in concordanta cu valorile lui ΔH0, adica ![]() >
>![]() >
>![]() >
>![]() . Curbele din figura 2.21 delimiteaza domeniile de
stabilitate a oxizilor de fier.
. Curbele din figura 2.21 delimiteaza domeniile de
stabilitate a oxizilor de fier.
 +10
+10
1
![]() I 2
I 2
-10 3
Fig. 2.21. Variatia tensiunii de disociere cu temperatura
-20 a
II III
-30
-40
4 IV
-50
-60
500 1500 2000 T, K
845
Aplicand
ecuatia izotermei reactiei ![]() la fiecare din
reactiile de disociere a oxizilor de fier rezulta urmatoarele
domenii:
la fiecare din
reactiile de disociere a oxizilor de fier rezulta urmatoarele
domenii:
I. domeniul stabilitatii Fe2O3 (Fe3O4 → Fe2O3)
![]()
Fe2O3 → Fe3O4
II. domeniul stabilitatii Fe3O4 FeO → Fe3O4
Fe → Fe3O4
![]()
III. domeniul stabilitatii wüstitei Fe3O4 → FeO
Fe → FeO
![]() IV. domeniul
stabilitatii fierului FeO → Fe
IV. domeniul
stabilitatii fierului FeO → Fe
Fe3O4→ Fe.
Pentru
ca un oxid sa fie stabil la o temperatura data este necesar ca
presiunea partiala a oxigenului in atmosfera ambianta sa
fie mai mare decat presiunea partiala de echilibru (tensiunea de
disociere) a oxidului la temperatura respectiva p![]() > P
> P![]() .
.
Disocierea FeO cu separarea fierului
La T < 572 sC (845 K) FeO disociaza dupa reactia:
4FeO = Fe3O4
+ Fe ΔG![]() = -57051 + 65,64
= -57051 + 65,64![]() (J)
(J)
Echilibrul reactiei este posibil numai la T = 572 sC, respectiv la T = 845 K.
La T > 572 sC (845 K) are loc reactia inversa:
Fe + Fe3O4 = 4FeO ΔG![]() = + 57 051 - 65,64
= + 57 051 - 65,64![]() (J)
(J)
si reactia
2FeO → 2Fe + O2 ΔG![]() = +538 760 - 139,21
= +538 760 - 139,21![]() (J)
(J)
Transformarile de faza in sistemul FeO
Transformarile de faza in sistemul FeO au in unele cazuri o influenta importanta asupra tensiunii de disociere, de aceea trebuie luate in considerare in calculul acesteia, in special topirea FeO si topirea Fe care sunt insotite de un efect termic important.
|
Transformarile de faza |
Temperatura, sC |
Caldura de transformare ΔH, J/mol |
|
Fe - a Fe - b | ||
|
Fe - b Fe -g | ||
|
FeO(s) FeO(l) | ||
|
Fe -g Fe - d | ||
|
Fe - d Fe lichid |
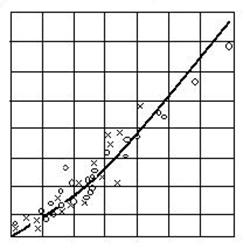
O imagine completa a fazelor din sistemul Fe - O ofera diagrama de echilibru Fe - O cu punctele ei caracteristice.
La analiza diagramei Fe - O trebuie sa se tina seama ca fazele condensate (solide sau lichide) sunt in echilibru cu oxigenul din atmosfera gazoasa (figura 2.22).
0,44
![]() 0,40
0,40
0,36
0,32
0,28
0,24
0,20
1520 1600 1680 1760 T, sC
Fig. 2.22. Variatia cu temperatura a solubilitatii oxigenului
in fier
In domeniile in care exista o singura faza condensata (de exemplu domeniul wüstitei sau a solutiilor solide de oxigen in fier): l = 2 + 2 - 2 = 2 si rezulta ca sistemul este bivariant.
In domeniile in care exista doua faze condensate: l = 2 + 2 - 3 = 1 si rezulta ca sistemul este monovariant.
De-a lungul liniilor orizontale numarul fazelor este 4 si sistemul este nonvariant l = 0.
In contact cu oxigenul, fierul solid dizolva o mica cantitate de oxigen (< 0,001 %). Fierul lichid dizolva mult mai mult oxigen si aceasta solubilitate creste odata cu cresterea temperaturii dupa o lege exponentiala:
lg
[ % O]max = ![]() + 2,734.
+ 2,734.
De retinut este ca 1600 sC este temperatura de elaborare a otelului, iar solubilitatea oxigenului in fier este de 0,23%.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |