
Porozitatea
Multe materiale solide
si pulberi, atat naturale (piatra,soluri,
minerale,etc) cat si fabricate (catalizatori,ciment, produse farmaceutice,
oxizi de metale,ceramica, zeolites, etc)contin un anumit volum de spatii
libere. Acestea sunt distribuite in masa solidului sub forma de
Exista doua tipologii importante ale porilor: inchisi si deschisi. Porii inchisi sunt complet izolati de suprafata externa, nepermitand accesul fluidelor externe, nici a lichidelor sau a gazelor.Porii inchisi influenteaza mai multi parametri, cum ar fi densitatea, proprietatile mecanice si termice. Porii deschisi sunt conectati la suprafata externa, prin urmare, sunt accesibili fluidelor, depinzand de natura/dimensiunea porului si de natura fluidului. Porii deschisi pot fi impartiti in "dead-end"si interconectati. Clasificarea urmatoare este legata de forma porilor, si permite oricand determinarea lor.
Parametri texturali
Dimensiunea porilor acopera un interval foarte larg. Porii sunt clasificati in trei grupe in functie de suprafata de acces:
Micropori: mai putin
de 2 nm diametru
Mezopori: intre 2 si 50 nm diametru
Macropori: mai mult de 50 nm diametru
Volumul specific al porilor si porozitatea
Suprafata libera interna in materialul poros poate fi masurata. Aceasta este in general exprimata ca un volum liber (in cc sau ml) impartit de catre o unitate de masa (g).
Distributia dimensiunii porilor
Este reprezentata in general ca o
abundenta relativa volumului de
Densitate
in masa ("bulk")
Densitate in masa se calculeaza prin raportul dintre masa
uscata a probei si volumul extern al probei.
Porozitatea procentuala
Este reprezentata de raportul dintre volumul total de
Aria suprafetei specifice
Aria suprafetei materialului solid este
suprafata totala a probei care este in contact cu mediul exterior. Ea
este exprimata in metri patrati pe gram
de esantion uscat. Acest parametru este strans
legat de dimensiunea si de volumul porilor, adica cu cat volumul
porilor este mai mare, cu atat aria suprafetei este mai mare, si cu cat
dimensiunea porilor este mai redusa, cu atat aria suprafetei este mai mare. Aria
suprafetei rezulta din contributia ariei suprafetei interne a porilor
plus aria suprafetei externe a solidului sau a particulelor(in
cazul pulberilor). Ori de cate ori este semnificativa porozitatea,raportul suprafetei externe la suprafata totala este mic.
Adsorbtia
Ori de cate ori un gaz
este in contact cu un solid va exista un echilibru stabilit intre moleculele in
faza gazoasa si speciile corespunzatoare adsorbite(atomi
sau molecule), care sunt indreptati spre suprafata solidului.
Pozitia de echilibru va depinde de o serie de factori:
1) stabilitatile
relative ale speciilor gazoase adsorbite implicate si concentratia
lor
2) temperatura
sistemului(atat a gazului, cat si a suprafetei)
3) presiunea
gazului pe suprafata
In general, factorii (2) si
(3) exercita efecte opuse asupra concentratiei speciilor adsorbite; suprafata
de acoperire poate fi majorata prin cresterea presiunii gazului, dar
vor fi redusa in cazul in care temperatura suprafetei este marita.
Adsorbtia este definite drept concentratia moleculelor de gaz din preajma suprafetei unui material solid. Gazul adsorbit se numeste "adsorbat", iar solidul la suprafata caruia are loc adsorbtia se numeste "adsorbant". Adsorbtia este un fenomen fizic (adesea numit fizisorbtie), care se desfasoara in orice conditii (de presiune si de temperatura), dar devine masurabila doar la temperature foarte scazuta. De multe ori acest process are loc la temperature de fierbere a azotului lichid la presiune atmosferica.
Adsorbtia are loc datorita prezentei unei energii de suprafata intrinseci. Cand
un material este expus unui gaz, apar niste forte intre suprafata expusa a
solidului si moleculele de gaz. Rezultatul acestor forte= adsorbtia fizica.
Aria suprafetei solidului include atat suprafata externa, cat si suprafata
interna a porilor.
Tipuri de izoterme
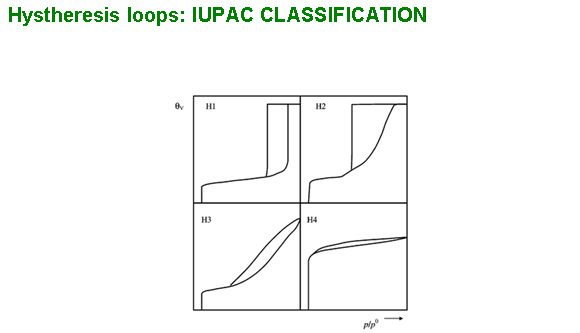
Datorita unei interactiuni slabe intre moleculele de gaz si suprafata, adsorbtia este un fenomen reversibil. Fizisorbtia gazoasa este considerata neselectiva, astfel ca completarea suprafetei pas cu pas (sau strat cu strat) este dependenta de suprafata disponibila a solidului si de presiunea relativa. Completarea primul strat permite masurarea ariei suprafetei materialului, deoarece cantitatea de gaz adsorbita atunci cand monostratul este saturat este proportionala cu intreaga suprafata a probei. Analiza privind adsorbtia/desorbtia complets este numita izoterma de adsorbtie. Cele sase izoterme de adsorbtie standard IUPAC sunt prezentate mai jos si difera intre ele deoarece sistemul implica interactii diferite gaz/solid.
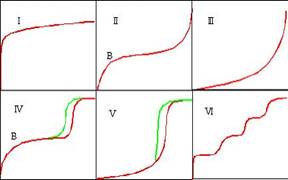
(I) solide microporoase-izot. de chemisorbtie
(II) si (III)solide neporoase
(IV si V) hysteresis generat de condensarea capilara a adsorbatului in mezoporii solidului
(VI) asemanatoare cu izoterma din cazul azotului adsorbit pe carbon special
Izoterma Langmuir
![]()
Ipoteze:
Adsorbtia
nu poate continua dincolo de punctul in care adsorbatul e in multistrat
Toti centrii de adsorbtie sunt echivalenti.
Adsorbtia si desorbtia sunt independente de rata de
populatia din situsurile vecine. Fiecare specie ocupa doar un singur situs.
Se ia
in considerare echilibrul:
![]()
unde A este adsorbatul liber, S este suprafata libera si AS substratul
delimitat la la suprafata. Rata de adsorbtie va fi
proportionala cu presiunea gazului si cu numarul de
situsuri vacante pentru adsorbtie. In cazul in care numarul total de
situsuri de pe suprafata este N, atunci rata de
schimbare a suprafetei de acoperire, datorita adsorbtiei este:
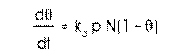
Rata de schimb a acoperirii datorita eliminarii (parasirii) suprafetei (desorbtiei)este proportionala cu numarul de specii adsorbite:
![]()
In aceste ecuatii, ka si kd sunt constante ale ratei de adsorbtie- desorbtie si p este presiunea de gaz adsorbat. La echilibru, acoperirea este independenta de timp si astfel cantitatea ads si desorbita sunt egale.
θ=Kp/1+Kp
in cazul in care K = kA / kd. K=ct. de echilibru. Valoarea lui K la diferite temperaturi din izoterma Langmuir e folositoare la evaluarea entalpiei de ads. Prin intermediul ecuatiei Van't Hoff.
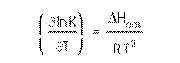
Langmuir isotherm: Determination of the Surface area
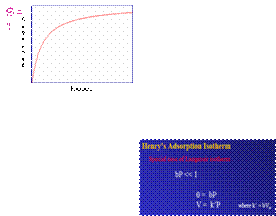
![]()
unde b = b(T)
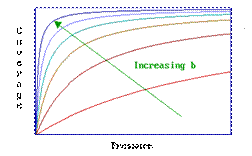
La o presiune data,
adsorbtia posibila este determinata de valoarea
b: aceasta la randul ei, este dependenta de temperatura (T) si entalpia de
adsorbtie.
Valoarea B se majoreaza cu:
-o reducere a te,peraturii sistemului;
-o crestere a intensitatii de adsorbtie
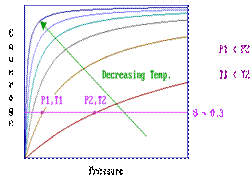
Langmuir isotherm: Determination of Enthalpies of Adsorption
Diverse metode, pe baza acestei idei au fost dezvoltate pentru determinarea
entalpiei de adsorbtie-o metoda este subliniata
de mai jos.
Pasul 1: presupune stabilirea unui numar de izoterme de adsorbtie (in cazul in care o singura izoterma este o curba acoperire/presiune la o temperatura fixa).
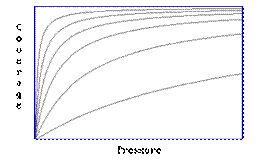
Pasul 2: Identificarea perechilor de valori care corespund aceleiasi acoperiri.
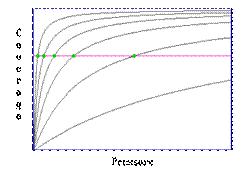
Pasul 3: The Clausius-Clapeyron equation
Valoarea obtinuta pentru entalpia de ads. E corespunzatoare suprafetei acoperite pentru care datele "P-T" au fost obtinute; dar pasii 2 si 3 pot fi repetati pentru diferite acoperiri ale suprafetei.
Aceasta metoda este aplicabila numai in cazul in care procesul de adsorbtie este reversibil termodinamic.
Aplicatiile isotermei Languir: : Kinetica Reactiilor catalitice
Este posibil de a anticipa modul in care cinetica anumitor reactii catalitice eterogene-ar putea sa varieze in functie de presiunile partiale ale gazelor reactantante de deasupra suprafatei catalitice prin utilizarea expresiei isothermei Langmuir pentru invelisul Suprafatei de echilibrul.
Descompunerea unimoleculara
Luati in considerare
suprafata de descompunere a unei molecule A, si anume, procesul
O (g) O ↔ (ADS) → Produse
Sa presupunem ca :
i) reactia de descompunere se produce in mod uniform in intreaga
suprafata a locurilor in care poate fi o molecula adsorbita si
nu este limitata la un numar limitat de locuri speciale.
ii) produsele sunt foarte slab legate de
suprafata si, o data formate, sunt rapid desorbite.
iii) pasul de stabilire a ratei este momentul
descompunerii suprafetei
In aceste conditii,moleculele de A absorbite la suprafata sunt in echilibru cu acele molecule din faza gazoasa si pot determina concentratia de A de la suprafata din isoterma Languir:
θ = b.P / + b.P )
Rata de descompunere a suprafatei,prin
urmare, a reactiei este data de o
expresie de forma
Rata de k = θ
Nota - presupunem ca
descompunerea are loc printr-o reactie elementara intr-o singura etapa si
ca momentului cinetic este de ordinul intai.
Substituind acoperirea, θ, obtinem expresia necesare pentru rata de schimb
din punct de vedere al presiunii gazului:
Rata de P b = k / (1 + b P)
Este util sa se ia in considerare doua
limite extreme:
Limita # 1: BP
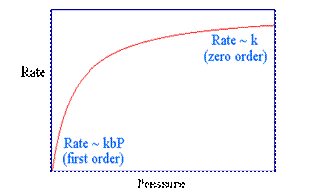
<<1; apoi (1 + BP) si a ratei ~ 1 ~ KBP
de exemplu, pentru o prima reactie (cu privire
la presiunea partiala a O), cu o aparenta, pentru prima rata
Si a ratei ~ k.b.P
Limita # 2: BP>> 1; apoi (1 + BP) si Rata de BP ~ ~ k de exemplu, un zero, pentru reactie (cu privire la presiunea partiala a O). Aceasta este cea de inalta presiune (adica mari b) limita: in aceste conditii, starea de echilibru Suprafata acoperire, θ, din molecule de reactant este aproape de unitate.
Exemplul 2: Reactie
bimoleeculara (intre moleculele de adsorbat)
Consideram o reactie Langmuir-Hinshelwood de tipul:
O(g)=A(ads), B(g)=B(ads)
rapid lent
O(ADS)+B(ADS) → AB(ADS) → AB(g)
Daca cele doua molecule de adsorbat sunt mobile pe suprafata
libera si se pot amesteca, rata de reactie va fi data de
urmatoarea expresie
Rata de k = θAθB
Pentru o singura molecula de adsorbat, suprafata de acoperire (data de Langmuir) este: θ = BP / (1 + BP)
In cazul in care doua molecule (A & B) sunt concurente, pe aceeasi centri de adsorbtie, expresiile relevante sunt:
![]()
Se substituie in acesta expresie rata de adsorbtie:
![]()
In acest caz, limitele extreme sunt:
Limita # 1: bAPA <<1 & bBPB <<1 In aceasta limita θA si θB sunt foarte mici, si rata bAPA bBPB → k = k 'PA PB adica de ordinul intai in ambele reactii
Limita # 2: bAPA <<1 <<bBPB In aceasta limita θA → 0, θB → 1, si rata bAPA → k / (bBPB) = k 'PA / PB adica de ordinul 1 in A si de ordinul -1 in B
Din acest exemplu, este usor de observat ca, in functie de presiunea partiala, un anumit model de sistem de reactie poate da nastere la o varietate de cinetice: acest lucru evidentiaza pericolele inerente in procesul invers - si anume incercarea de de a folosi datele pentru a obtine informatii cu privire la mecanismul de reactie.
Exemplu: Reactia de
oxidare a CO
Pe suprafata unor metale pretioase (de exemplu, PT) reactia de oxidare CO
este, in general, o reactie Langmuir-Hinshelwood cu un mechansim de tipul:
CO (g) = CO (ads) O2(g) = 2O(ads)
CO(ads)+O(ads)→CO2(ads)→CO2(g)
Cum CO2 este slab legat la suprafata, desorbtia acestei molecule produse este
relativ rapida si in multe situatii, este reactia dintre cele
doua specii adsorbite.
Daca cele doua
molecules adsorbite se presupun a fi mobile pe suprafata libera a
si interactioneaza intre elerata de reactie va
fi data de urmatoarea expresie:
Rata de k = θCOθO
In cazul in care doua astfel de specii (dintre care una este adsorbita molecular, si cealalta adsorbita disociativ) sunt concurente, pentru aceisi centri de adsorbtie, expresiile relevante sunt:
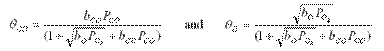
Daca se substituie aceste expresii in rata se obtine:
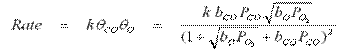
Limitele sunt din nou interesante. In cazul in care CO este mult mai puternic legat la suprafata, deci bCOPCO>> (1 + √ (bOPO2)) si, prin urmare, ca (1 + √ (bOPO2) + bCOPCO) » bCOPCO apoi rata ecuatiei simplifica va fi:
![]()
Concluzie:
In aceste limite cineticile sunt de ordin 1/2,respectand presiunea gazului oxigenului molecular, negative cu privire la presiunea partiala a CO, adica CO actioneaza ca o otrava (desi este un reactant) si o crestere a CO reduce viteza de reactie. Aceasta este din cauza ca CO este atat de puternic legat de suprafata incat blocheaza adsorbtia de oxigen, si fara suficienti de atomi de oxigen pe suprafata rata de reactie, este redusa.
Izoterma de adsorbtie Freundlich
Descrie adsorbtia fizica din lichide si poate fi de asemenea utilizata pentru adsorbtia din gaze de hidrocarburi pe carbon activat.
Isotherm de Freundlich este oizot. De adsorbtie, care este
o curba privind concentratia unui solut pe suprafata de adsorbant, fata de
concentratia unui solut in lichidul cu care se afla in contact.
Expresia matematica este:
x/m = K c1/n
unde x = masa de adsorbat
m = masa de adsorbant
p = presiunea
de ads. La echilibru
Equilibrium
c = concentratia de adsorbat in solutie la echilibru.
K si 1 / n sunt constante pentru un anumit adsorbate
si adsorbent special, la o temperatura
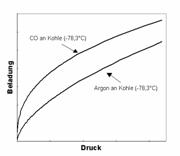
![]()
Freundlich Isotherm
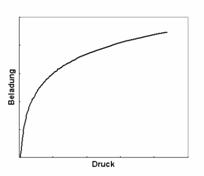
![]()
Izoterma Temkin
Izoterma Polanyi
Teoria Potentialului de Adsorbtie afirma ca , cantitatea de adsorptie θ a unui adsorbat dat care este adsorbit de un anumit adsorbat in conditii de echilibru este o functie a potentialului de adsorptie:
Polanyi si-a bazat izotermele de adsorptie pentru dimethyl phthalate pe logaritmul volumului adsorbit fata de densitatea potentialului de adsorptie.
θ = f [RT ln(psat/p)]
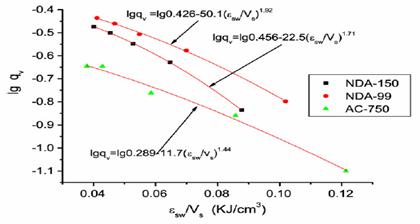
NDA and AC commercial hyper-cross-linked resins
Izoterma BET
Izoterma Langmuir este
folositoare numai la suprafete mici (submonostrat) dar se aplica in general in
toate situatiile care implica chemisorptie. Aceasta ar corespunde situatiei
limita a lui c aproape de infinit in formalismul BET si nu ofera posibilitatea
de a vedea dincolo de un monostrat in aceasta
limita.
Izoterma BET descrie adecvat
physisorptia la suprafata intermediara (θ = 0,8 - 2,0), dar nu
reuseste sa reprezinte observatii la suprafata joasa sau
inalta joasa sau inalta . Isotherma BET este valida rezonabil pentru θ = 1,0, totusi, si
acest lucru este util in caracterizarea suprafetei absorbantului .Daca se poate
determina experimental numarul de moli ai adsorbatului necesar pentru θ = 1,0 (de exemplu, un monolayer),atunci
se poate determina suprafata(aria) specifica a absorbantului:
![]()
Conceptul teoriei este o extensie a teoriei Langmuir, care este o teorie pentru adsorptie moleculara monostrat pana la adsorptie multistrat cu urmatoarele
Ipoteze:
a)moleculele
de gaz adsorb fizic pe un solid in
straturi infinit;
b)nu exista nici o interactiune intre fiecare strat de adsorptie;
c)si (c) teoria Langmuir poate fi aplicata la fiecare strat. Ecuatia BET
rezultata este exprimata de:
![]()
Psi Po sunt echilibrul si
presiunea saturatiei adsorbatilor la temperatura de adsorptie, v este
cantitatea de gaz adsorbit(de ex. in unitati de volum)
siVm este cantitatea de gaz adsorbit monostrat, c este
![]()
E1 este caldura de adsorbtie pentru primul strat, si El este pentru al doilea si straturile superioare si este egala cu caldura de lichefiere si mai mare si si este egala cu caldura de lichefiere
Izoterma BET Aplicatii: determinarea ariei(zonei) de suprafata
Ecuatia BET este o izoterma de adsorptie si poate fi reprezentata ca o linie dreapta cu 1 / v [(P0 / P) - 1] pe axa y si φ = P/P0 pe axa x-in functie de rezultatele experimentale. Aceasta este o reprezentare BET. Relatia lineara a acestei ecuatii se mentine numai in sirul de 0,05 <P/P0 <0,35. Valoarea lui A si interceptareaY a liniei se folosesc pentru a calcula cantitatea de gaz adsorbit monostratVm si costanta BET c. Se poate folosi urmatoarea ecuatie:
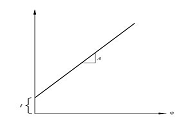
![]()
![]()
![]()
![]()
N: numarul lui Avogadro,
s: adsorption sectiune transversala,
V: volum molar de gaz adsorbant
o: greutatea molara a speciei de adsorbant
Metoda reprezentarii t
Aceasta metoda de analiza a
datelor izotermice a fost introdusa de Boer. Se presupune, ca, intr-o
anumita regiune isothermica, micropresele sunt déjà pline in timp ce adsorptia in
A (x) = amicro, max + K Sext tlayer (x) in cazul in care: x = p / ps
a= adsorptie in micropori saturati
,
Sext - aria suprafetei externe; aici aria suprafetei porilor este mai mare
decat a microporilor;
t layer (x)=grosimea statistic estimata a stratului de adsorptie( in mezo si
micropori)-de obicei in ecuatiile - Harkins-Jura
(HJ) si Halsey / Frenkel-Halsey-Hill (FHH) - des folosite sunt variantele experimentale Halsey HJ;
In reprezentarea t valorile grosimii calculate sunt intre 0,354 nm (de ex tmono) si 0,5 nm (aceasta corespunde brut gamei de presiuni relative 0,1 - 0,2); pentru solide cu cantitate mica de micropori, Halsey isotherm poate da valoare negativa volumului/ariei microporilor, de aceea ar trebui sa fie utilizat cu precautie.
![]()
k - coeficient care depinde de unitatile utilizate pentru valorile adsorbtiei A (x), grosimea stratului t (x) si suprafata Sext. De exemplu, pentru t [nm], S [m 2 / g] si a [cm3 / g STP] vom obtine: k = 1 / (4.3532 tmono), in cazul in care tmono = 0,354 nm este grosimea din monostrat pentru stratul de adsorptie N2 si 4.3532 este un coeficient pentru calcularea suprafetei ocupate [m 2 / g] de cantitatea de adsorbat [cm3 / g STP] (N2 adsorptie la 78k).
Izoterma Dubinin-Radushkevich: umplerea tridimensionala a microporilor
Metoda propusa de Dubinin, presupune o izoterma de referinta pentru benzen la 293 K, data de relatia pur empirica (γ = gradul de umplere a volumului microporilor):
![]()
Pentru adsorbtia vaporilor, potentialul de adsorptie A este dat de:
![]()
Analog, pentru lichide , potentialul de adsorbtie este dat de:
![]()
Pentru adsorbtia de , CCl4 in negru de carbon? la 293 K:
![]()
este coeficientul de afinitate de tetraclorura de carbon, pentru volumul de umplere a micropores.
Cu toate acestea, densitatea suprafetei de 8 x10-3 mmol m-2 corespunde unei arii/zone de suprafata moleculara de 20 de x10-20 m2, care este mult mai mica decat valoarea de 37x10-20 m2 pentru adsorbtia la carbon, negru in gama BET.
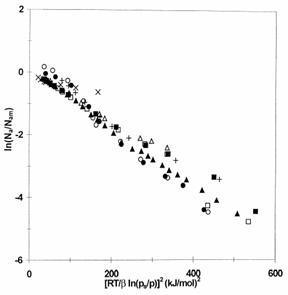
In formularea moderna a teoriei lui Dubinin, ecuatia Dubinin-Radushkevich se prezinta sub forma
![]()
Unde Nam (DRK) reprezinta cantitatea limitata adsorbita in monostrat;
Evident, aceasta ecuatie nu include adsorptie in multistrat, spre deosebire de modelul BET.
Nam (DRK) este, prin urmare, o valoare extrapolata.
In asa numita teorie a potentialului de adsorptie a lui Eucken si Polanyi , se presupune ca in spatiul din jurul fiecarui solid se pot gasi suprafete izopotentiale (pentru suprafetele omogene plate ele sunt plane?) delimitand adsorbatul care este adsorbit la presiuni sau concentratii mai joase decat cele care corespund valorii potentiale si astfel de suprafete izopotentiale sunt specifice pentru o anumita suprafata solida. Daca se face o reprezentare a volumului adsorbit(cantitatea de adsorbat condensat) fata de potentialul de adsorptie, atunci aceasta "curba potentiala"este caracteristica pentru un anumit system. In acelasi timp,s-a demonstrate experimentalca, pentru o anumita suprafata solida si o serie de adsorbati si temperature de adsorptie reprezentarea lor poate fi schematizata astfel incat toate punctele experimentale incap intr-o singura curba(ceea ce s-a dovedit adevarat pentru multe alte solide). In aceasta situatie, asa numitul volum de adsorptie limitata Vs(adica volumul maxim adsorbit la A=O-poate fi diferit pentru fiecare system de adsorbat/solid) este folosit pentru a reprezenta volumul adsorbit.
Desi Dubinin si Radushkevich au propus expresia lor numai pentru suprafete multistrat s-a demonstrat valabilitatea si in gama submonostratelor.
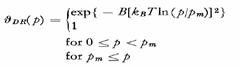
unde: p= presiune;
θ= suprafata acoperita; kB=
T= temperatura absoluta; pm= o presiune, caracteristica pentru
perechi de adsorbati de suprafata;
B= un parametru corespunzator
Distributiile energiei de adsorptie s-au calculat cu aproximare de condensare
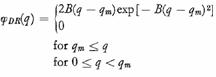
Unde: Qm( energia de adsorptie minima) este dat de:
Qm = - kBT ln (PM / PL)
PL fiind presiunea caracteristica a izotermei Langmuir
Cursul izotermei Dubinin-Radushkevich (DR) corespunde formei tipice curbei de potential caracteristica pentru solide microporoase. . In urmatoarele imagini, curbele de potential caracteristicc obtinute pentru T = 293k valorile 3 diferit de B2 (B2 = 3e-9; 1e-8; 3e-8 - acesta corespunde pentru B2 (RT) 2 = 0.0178, 0.0593; 0,178 sau - daca se prefera scala log10 - B2 [ln (10) RT] 2 = 0.0944; 0,315; 0,944).
Model de curbe de potential scalate si rotate, volumul adsorbatului
(V / Vs), fata de A, potentialul de adsorbtie [J], calculata pentru izoterma Dubinin-Radushkevich , T = 293k si 3 valori ale parametrilor B2 .
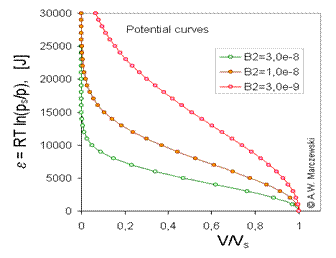
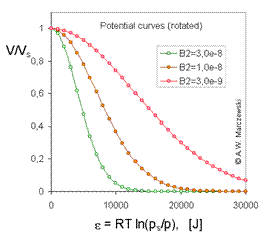
Model scalat de curbe de potential, A, potential de adsorptie curbelor, potentialul de adsorbtie [J] vs volumul adsorbatului pentru izotermaDR, T = 293k si 3 valori ale parametrilor lui B2 .
Model de curbe de potential scalat, A, potential de adsorptie (J) fata de volumul adsorbatului(V/Vs), calculat pentru izoterma DR, T=293K si 3 valori ale parametrilorB2(in imagine se vad valorile lui B2(RT)2
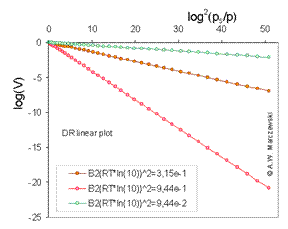
Reprezentarea lineara Dubinin- Radushkevich log10 (V) vs [log10 (PS / p)] 2, calculata pentru izoterma Dubinin-Radushkevich T = 293k si 3 valori ale parametrilor lui B2 (in imaginea valorile lui B2 (ln10RT) 2 sunt afisate) Trebuie avut grija care forma a ecuatiei se foloseste. In evaluarea datelor experimentale se folosesc acesti logaritmi zecimali, totusi, astfel de valori obtinute(inclinatia este=B2(In10RT)2 ale parametrilor sunt scalate in comparative cu reprezentari de logaritmi naturali(inclinatia este=B2(RT)2.Uneori ecuatia DR este definite astfel incat se folosesc parametrii pentru B=B2(RT)2 Totusi acest lucru ascunde faptul ca parametrul structural B2 este independent de temperatura.
Metoda reprezentarii t/F a lui Dubinin
Introdusa de Dubinin si Kadlec, pentru a creste precizia analizei reprezentarii t. In aceasta metoda izotema Dubinin-Radushkevich este plasata in gama de micropori(presiuni joase/ gama de adsorptie). Aceasta metoda poate ajuta pentru a compensa non-linearitatea reprezentarilor t in cazul solidelor care contin anumiti supermicropori. Totusi aceasta necesita o gama mai larga de date si metoda reprezentarii t isi pierde din marea ei simplitate.
For benzene at 293 K
![]()
unde: SE =aria suprafetei externe
SE se obtine din sectiunea lineara a reprezentarii N / F vs γ / F, unde F = exp [- (A / E) 2].
Energia caracteristica E se obtine din regiunea de presiune joasa a reprezentarii logaritmice Eq . (Na), unde γ este neglijabil.

![]()
![]()
![]()
Surface area of the Carbon samples
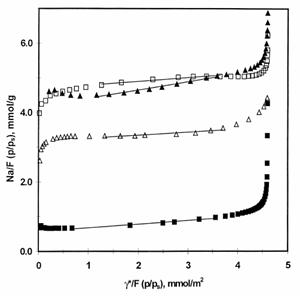

![]()
Se pare ca energiile caracteristice E = 10,8 si 11,2 kJ / mol obtinute pentru benzen in carbons Hoechst si N-235 sunt foarte aproape de valoarea limita de 11,4 kJ mol gasit in corelarea empirica intre latimea medie L a microporilor in forma crestata/fanta?- si energia caracteristica a ecuatiei care corespunde celei Dubinin-Astakhov
![]()
αS-method
O metoda preferata este α-S . Aceasta metoda necesita niste date izotermice standard, pentru comparatii, cu toate acestea ofera informatii in mare parte despre adsorbtie ,influenteaza si asigura descrierea sistemului mezopori, si - intr-o anumita masura - macropori..
Aceasta metoda compara datele experimentale ale solidelor poroase cu adsorbtia la standard de selectie arbitrara (ar trebui sa aiba aceeasi compozitie si structura chimica, aceleasi proprietati de suprafata - grupuri etc - si fara micro-sau mesopori). Permite sa se determine nu numai continutul de micropori si mezopori dar si suprafata externa a mezoporilor. De cele mai multe ori se foloseste pentru informatii N2 dar si pentru alti adsorbati(esantioane si standard), dar fiecare tip de adsorbati necesita determinarea unui"punct characteristic" (x = 0,40 pentru N2 si x = 0,175 pentru benzen).
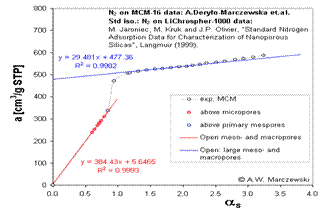
Principala ecuatie a reprezentarii α s poate fi
scris ca:
A (x) = amicro, max + kstd Sext α s (x)
sau
A (x) = amicro, max + inclinare α * s (x)
unde: x = p / ps amicro, max - adsorption
in micropori saturati,, S ext - aria suprafetei externe; aici aria
suprafatei porilor este mai mare decat a microporilor, α s (x) =
α std (x) / α std (x = 0,4) (valori fara dimensiuni) kstd α =
std (x = 0.4) / Sstd - unde S este aria suprafetei specifice a standardului
folosit ; valoarea sa numerica
depinde de unitati utilizate pentru valorile adsorbtiei A (x)
si suprafata S.
Este posibil sa calculam aria suprafetei adsorbantuluit ca:
Sext = inclinatia [Sstd / astd (x = 0.4)]
O alta parte pozitiva a metodei aS este
universalitatea sa. Acesta poate fi
utilizata in
determinarea volumului mezoporilor, aria suprafetei mezoporilor,
Volumul si aria macroporilor, etc. depinde doar de datele disponibile
(De fapt reprezentarea t se pote folosi la fel)
Totusi ajuta de asemenea daca distributia marimii porului are varfuri bine definite,
Adica pot sa fie mai multe tipuri de
Se pot desena o serie de linii care sa aproximeze sectiunile izotermice.
: A (x) = AO, i + slopei α s, i = 1, 2
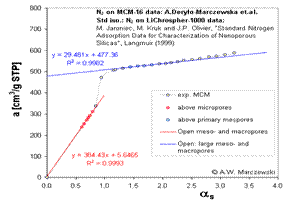
Metoda αS pentru C6H6 si alti adsorbanti
Opusa metodei originale
aS si folosita pentru adsorptia de N2(unii autori inca folosesc X=0.4 pentru
benzene, de ex.) aS ar trebui sa fie definite diferit:
S α (x) = astd (x) / astd (x = xhist) (dimensionless valoare)
Punctul de deschidere / inchidere al inelului hysteresis se
modifica puternic cu adsorbat (de exemplu, pentru 0,4 azot, 0,175 pentru
benzen).Totusi aceasta valoare schimbata inca corespunde punctului unde stratul adsorbit este cel putin monoatomic si
microporii sunt umpluti. Inca se mai discuta daca xhist(?)
este cea mai buna alegere pentru punctual characteristic in metoda aS. Cu toate
acestea este cea mai simpla si cea mai logica.
Masurarea marimii porilor din izoterma de adsorptie
Microporii
Metoda Dubinin-Astakhov
Potentialul de adsorptie corespunde modificarii energiei libere molare legata de modificarea presiunii vaporilor.
![]()
Dubinin si Radushkevich au dezvoltat teoria umplerii volumului microporilor (MVFT), bazata pe conceptul Polanyi a unei curbe caracteristice .
![]()
Combinand
![]() n=2!!!
n=2!!!
unde B se numeste
O expresie mai generala a fost dezvoltata de Dubinin si Astakhov. Pentru a obtine aceasta expresie, se presupune o functie de distributie Weibull .
![]()
Exponentul n este legat de gradul de heterogenitate
al sistemului de micropori.
. Pe de alta parte, ecuatia Dubinin-Radushkevich este un caz
particular pentru n = 2 (a se vedea slidul anterior !!!!)
Cand un solid microporos poseda micropori de aceeasi forma dar de marimi diferite s-a propus o modificare a acestei ecuatii. In acelasi fel, D-A se poate aplica la descrierea adsorptiei solidelor cu structura heterogena. Expresia izotermei se poate reprezenta ca:
![]()
unde I (FI = Voi / Vo) arata fractia de puncte de asorptie localizate in micropori cu o energie caracteristica de adsorptieE1.
Distributia potentialului de adsorptie caracterizeaza heterogenitatea energetica asociata cu microporii. Distributia potentialului de adsorptie X(A), legata de ecuatia izotrmei lui D-A poate fi evaluate cu ajutorul metodei de condensare de aproximare.
![]()
Aceasta metoda se pote folosi ca o prima aproximare pentru a investiga formal relatia dintre parametrii ecuatiei D-A si distributia latimii microporilor. Potrivit acestei expresii, distributia de energie devine mai aspra(?) pe masura ce n creste, ceea ce implica faptul ca distributia microporilor din substrat devine mai omogena pentru sisteme de micropori cu valori similare ale lui Eo.
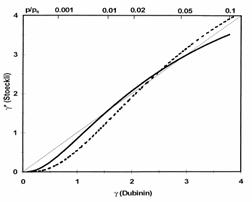
Compararea reprezentarilor D-R si D-A (slide 61 )
Rezultate comparate D-R si D-A( slides 65, 66, 67)
Metoda Horvath-Kawazoe
The Horvath-Kawazoe metoda este folosita pentru a estima repartizarea marimii microporilor din izotermele de adsorptie cu volumetrie in semi-echilibru si presiune joasa. Aceasta metoda s-a dezvoltat pentru carbonate si presupune ca exista micropori intre crapaturile/fantele de grafit si ca presiunea lor de umplere depinde numai de energia de interactiune dintre adsorbat-adsorbant. .
![]()
Unde Uo descrie interactiunea adsorbat-adsorbant;Pa descrie interactiunile adsorbat-adsorbat-adsorbant.
Considerand un potential normal in ceea ce priveste distanta (d) disponibila din interiorul crapaturilor si substituind rezultatul in ecuatia de deasupra, rezulta:
![]()
A este o
![]()
NA este numarul Avogadro, R si T sunt constante de gaz si respectiv temperatura, Na si NA sunt numarul de atomi de carbon de adsorbant, precum si numarul de molecule de adsorbat, respectiv, pe unitatea de suprafata de adsorbant. Aa si AA sunt constante date de:
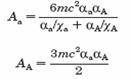
m este masa unui electron, c este viteza luminii, iar α si χ sunt polarizabilitatea si susceptibilitatea magnetica a unui atom de adsorbant (subscript a) si / sau a unei molecule de adsorbat (subscript A).
Cele trei constante ramase (B, C si D) sunt date de:

Unde
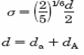
si d este egal cu suma diametrelor unui atom de adsorbant si o molecula de adsorbat.
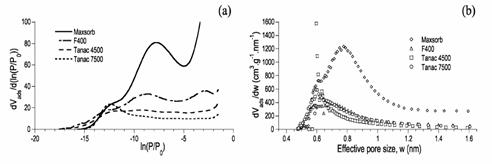
a) Comparatie intre izotermele derivate ale adsorptiei de argon obtinuta in patru carboni activati.
b) Distributia marimii microporilor derivati calculate prin metoda HK la diferiti carboni
Mesoporii
(de obicei
Masurarea marimii porului
Adsorbatii tipici sunt N2 (vapori de nitrogen la temperatura
de baie de nitrogent lichid la o presiune atmosferica, cca. 77-78k - N2 lichid
in functie de puritatea si presiuna N2 lichid) si vaporii de benzen, C6H6, la temperatura
camerei (de exemplu 25 ° C, . Kryptonul este adesea
folosit pentru isothermele de presiune joasa. . Alte gaze, cum ar fi CH4, CO2
sunt de asemenea folosite.
Adsorbtia intr-o asa numita 'gama/sir de mezopori
' este o combinatie de adsorbtie fizica pe peretii mezoporilor
(descrisa de una din ecuatiile izotermei experimentale sau teoretice, de ex. Harkins-Jura sau Halsey / Frenkel-Halsey-Hill sau
alta- - uneori cu corectii ale curburii peretelui) si condensarea fizica a
adsorbatului in
![]() Harkins-Jura
equation
Harkins-Jura
equation
![]() Halsey /
Frenkel-Halsey-Hill equation
Halsey /
Frenkel-Halsey-Hill equation
In general, isothermele experimentale masurate pe solide mezoporoase afiseaza inele/bucle hysteresis (adsorptia si disorptia merg pe cai diferite) in regiunea mezoporilor.. Cu toate acestea, hysteresis este observat numai in cazul in care menisci(?) din caile de adsorptie si disorptie sunt diferite in forma/ diametru. . Aceasta situatie este tipica pentru mezopori cilindrici deschisi la capat(sub forma de sticla de cerneala), sau spatiile dintre fantele paralele. Daca porul cilindric e inchis la unul din capete si nu contine ingustimi ,izoterma de adsorptie nu afiseaza bucla/ inelul hysteresis. Acelasi lucru e valabil pentru porii conici.
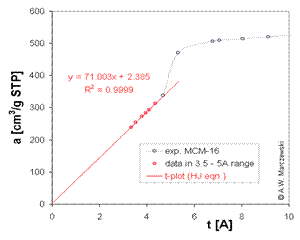
Ecuatia lui Harkins si Jura
Harkins si Jura a propus o abordare complet diferita a adsorptiei multimoleculare decat cea a BET, incepand de la o ecuatie empirica bi-dimensionala a starii in faza de adsorptie la suprafata unui solid si combinand aceasta cu ecuatia Gibbs a derivat ecuatia izotermei:
Ps este presiunea vaporilor saturati ai adsorbatului ,
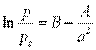
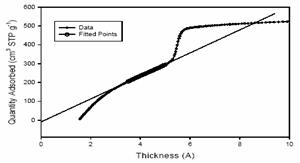
Date isothermice tipice pentru un non-microporous
MCM-41, folosind Harkins-Jura curba de grosime
Hystheresis loop
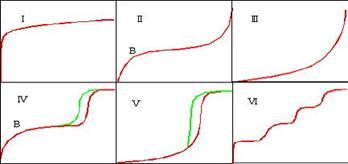
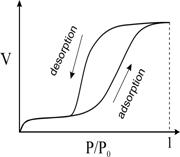
Cele sase izoterme IUPAC de adsorptie-disorptie

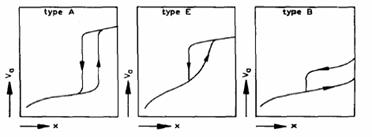
Tip A
cu doua ramuri foarte abrupte poate fi intalnit la
Tipul B este o bucla hysteresis cu o
ramura de adsorptie verticala la o presiune relative foarte apropiata de unu si
o ramura de disorptie la o presiune medie. O astfel de bucla hysteresis se
poate forma la
Tipul E, cu o ramura de disorptie abrupta si o
ramura de adsorptie inclinata se aseamana mult cu tipul A. Acest tip se intalneste
la
Hystheresis loops: IUPAC CLASSIFICATION
Metoda Barrett-Joiner-Halenda (BJH) pentru determinarea marimii porilor
1.Formarea
unui strat de adsorptie pe peretele porului,
2.Condensarea adsorbatului in interiorul porului,
3. Procesul de desorptie se presupune ca are loc prin
evaporarea capilara din interiorul porului urmata de o scadere gradata in
grosimea filmului adsorbit
4. Toti porii sunt
in ultima instanta umpluti cu lichid,
3. Presiune relativa initiala (P/P0) este
aproape de unitate
Aceste date pot fi rezumate in formula
![]()
In aceasta formula, vads (xk) este volumul (lichid) adsorbatului [cm3 / g] la presiunea relativa xk (calculata din valoarea de adsorptie exprimata in [cm3 / g STP] de catre vads (x) = 0.0015468 A (x )), volumul porului V este dat in [cm3 / g], S este aria suprafetei [m 2 / g] si t este grosimea stratului adsorbit (in unitati corespunzatoare). Aceasta formula spune, ca , cantitatea adsorbita la punctul k- al izotermei de adsorptie poate fi impartita in doua parti distincte:
-prima este un volum in condensate(?)
in toti porii mai mici decat o marime
caracteristica in functie de
presiunea relativa curenta, rc (xk),
-a doua este un volum al filmului de adsorptie in toti porii mai mari, calculat
ca o suma de termeni :
Σ (suprafata porului) (grosimea filmului in
NOTA! Atentie la identitatea radiusului folosit: in ecuatia Kelvin XC XC = (r) si ecuatia grosimii t =
t (x, r), radiusul este intotdeauna determinat de menicus. Cu
toate acestea, in calculul Δ Δ V si S radiusul
este un por geometric radius
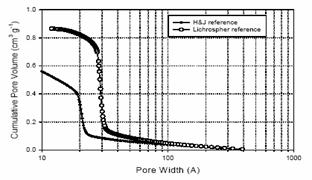
BJH Metoda de analiza aplicata la datele izotermei de mezopori folosind diferite curbe de referinta
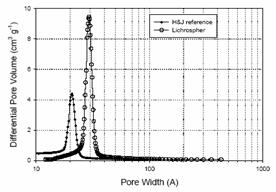
Volumul porilor si latimile derivate din datele figurii de deasupra .
Distributia marimii porilor
Distributia marimii porilor se calculeaza din izoterme(cantitatea de gaz adsorbit intr-un film poros ca o
functie a presiunii relative). Gazul este condensat in
![]()
unde R este
![]()
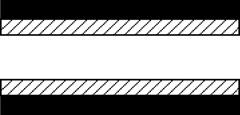
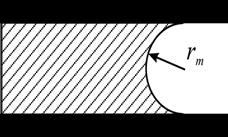
Diagrama schematica a meniscusului in timpul a) adsorptiei b) desorptiei
Aici, r1 si r2 sunt
doua radiusuri principale ale meniscusului .
Aceste radiusuri de curbura sunt definite prin doua plane avand unghiuri drepte
unul fata de celalalt si fiecare
dintre ele trece printr-un vector normal dintr-un punct al meniscusului. Sa
consideram cum radiusul Rm si radiusul porului R sunt legate unul de altul cand
are loc condensarea capilara in
In timpul desorptiei cand toti porii sunt plini cu lichid, meniscusul are o forma
emisferica. In acest caz doua planuri perpendiculare care contin un vector
normal intersecteaza/ sectioneaza un por de-a lungul axei sale iar r1 si r2
sunt radiusurile porului in doua directii perpendiculare. Daca porul are o
forma cilindrica atunci r1=r2=r si din ecuatie este
evident ca:
Rm = r
In timpul adsorptiei cand porii sunt initial goi, meniscusul ia forma cilindrica. Un plan care contine vectorul normal taie porul, si, prin urmare, R1 = r. Un alt plan perpendicular pe primul si care contine vectorul normal taie porul de-a lungul axei sale si de aici rezulta radiusul sau principal R2 =infinit
Folosind ecuatia obtinem:
rm = 2r
Volumul porilor
Pentru un por dat cu radius r (sau
diametrul d - mai bine pentru
for spherical pores: ΔV = d ΔS / 6
for cylinders: ΔV = d ΔS / 4
for slits (placi) ΔV = d ΔS / 2.
Distributia marimii porilor
Din aceste considerente vedem ca in timpul
adsorptiei este nevoie de presiune mai mare pentru
condensare fata de disorptie. Ca rezultat al acestei diferente
o izoterma tipica adsorptie/disorptie de obicei afiseaza o bucla hysteresis.
Volumul relativ al adsorbatului in
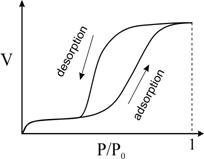
Izoterma de adsorbtie / desorptie in solide mezoporoase
Trebuie retinut faptul ca radiusul meniscusului nu este exact egal cu radiusul porului deoarece unele molecule pot fi adsorbite la peretii porului inainte de condensarea capilara( ramura la presiune joasa P/P0 in Fig. 2). In acest caz, radiusul meniscului va fi mai mic decat radiusul porului cu grosimea t a stratului déjà adsorbit la peretii porului.
rm = r - t
Grosimea t pot fi obtinuta din masuratori de adsorbtie pe suprafete non-poroase plate avand aceeasi compozitie chimica ca materialul poros in discutie. Ecuatia BET (numita dupa dezvoltatorii teoriei adsorbtiei Brunauer, Emmett si Teller) este folosita pentru a estima valoarea lui t:
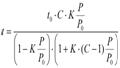
Unde
T0 este grosimea monostratului adsorbatului, C este
Masurarea marimii particolelor
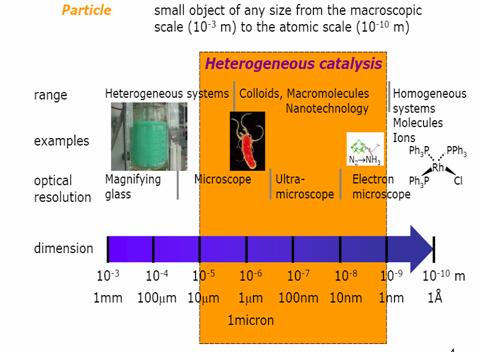
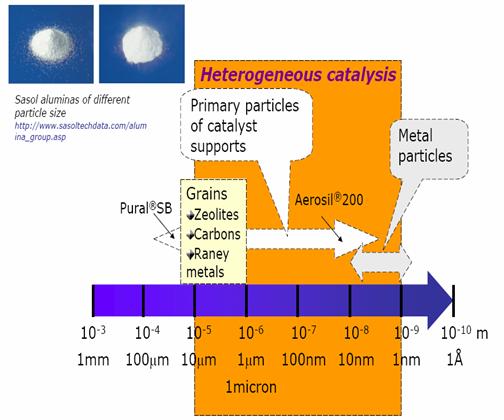
Dimensions in heterogeneous catalysis
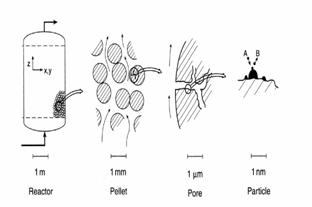
Masurarea marimii particolelor este domeniul tehnologiei pulberilor. Materiale in forma prticulata se folosesc in fiecare zi in industrie si in gospodarie. Marimea pulberii atat in procesarea ceramicilor high tech folosite in electronica unui telefon mobil cat si in detectarea biomedicala a tumorilor sau sarea de bucatarie, influenteaza profund proprietatile sale fizice- fluiditatea, rata dizolvarii pentru sare, proprietatile magnetice ale oxizilor de Fe printr altele.Capacitatea noastra de a masura marimea particolei si distributia marimii este cruciala pentru dezvoltarea unor materiale noi si folosirea lor.
Tehnici
Specifice de
suprafata (ASS, azot adsorption)
Pulbere X-ray diffraction (XRD, faza crystallite marimea si de la
linia de a extinde)
Electron microscopy
Potentiali Zeta masura (electrophoresis si acoustophoresis)
Chemisorption
Forma particulei
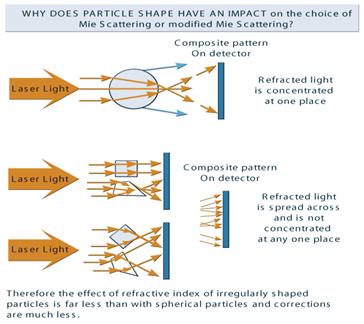
Chiar daca presupunem de obicei ca particulele sunt sferice in cele mai multe calcule, acest lucru nu e neaparat adevarat si se pot da erori in experimentele si analizele noastre.Forma precisa a particulelor folosite(carbine, catalizator, rezina, pigment de vopsea, pulbere de medicament, etc.) si dispersia lor, face ca analiza marimii celor mai multe particole sa fie un lucru greu de realizat. Deoarece singura masuratoare pe care o folosim cu usurinta pentru a descrie o particula de orice forma care s-a marit sau s-a micsorat in timpul procesarii este conceptual de "sfera echivalenta", cadem in capcana de a presupune ca toate particolele sun sferice in natura.
Sfera este singura forma care pote fi descrisa de un numar(D- diametrul sau).Daca avem orice particola de marime diferita, putem transforma cu usurinta volumul sau greutatea particolei in volumul si greutatea unei" sfere echivalente":
Volum = 4 / 3 π (D / 2) 2
Greutate = 4 / 3 π (D / 2) 2 ρ
D este diametrul sferei echivalente. Aceasta se
numeste TEORIA SFEREI ECHIVALENTE
Acest lucru asigura ca nu avem nevoie sa descriem forma reala, ceea
ce poate fi chiar un dezastru.Dar toate particolele cu o sfera echivalenta pot
avea forme foarte diferite cand privim la microscop. Astfel, noi trebuie sa definim ce dimensiune a particolei folosim in calcularea
sferei echivalente
Distributia marimii particolei(PSD ) si analiza sa: Sieving
Slide 97-diferite sfere echivalente dintr-o singura particola
Dimensiunea particulelor intr-un esantion poate fi masurata prin estimare vizuala sau prin utilizarea unui set de sieves. Marimea particulelor lor pot fi masurate in mod individual de catre optice sau electroni microscop analiza. Principiul de baza al sieving tehnica este dupa cum urmeaza. Un esantion reprezentativ de greutate cunoscuta de particule este trecut printr-un set de sieves cunoscute de ochiuri de dimensiuni. De sieves sunt aranjate in scadere cu diametre descrescatoare a ochiului. De sieves sunt mecanic vibrated pentru o perioada determinata de timp. Greutatea de particule retinute, pe fiecare sita se masoara si se transforma intr-un procent din totalul esantionului. Aceasta metoda este rapida si suficient de precise pentru cele mai multe scopuri. In esenta ea masoara diametru maxim de fiecare particula.
Mathematical Interpretation
De
Rosin-Rammler descris de functia de distributie Djamarani si
![]()
R este retinuta de greutate frac (%), D este de marimea particulelor (mm), DM este inseamna marimea particulelor (mm), si n este o masura de raspandire a particulelor de dimensiuni. De aplicabilitate a Rosin-Rammler functia de distributie poate fi determinata de curba de amenajare reale sita dimensiunea particulelor de date a unui esantion. O analiza putin patrat de regresie pot fi efectuate pentru a se potrivi cu puncte de date, precum si coeficientul de corelare pot fi folosite pentru a estima bine de cuviinta.
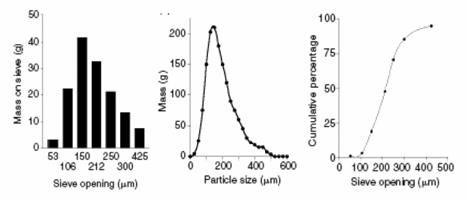
Particle Size Distribution (PSD) and its Analysis
Ambele
grafice statistice si metode de prezentare a datelor au fost dezvoltate de
interpretare a datelor sita.
Procentul de probe in fiecare categorie pot fi afisate in bara de grafic diagrame sau histograma. O alta metoda de afisare grafica este
cumulativ curba sau cumulativ aritmetica curba. Cumulativa a curbelor
sunt extrem de util, deoarece de multe curbe esantion poate fi plotted pe
acelasi grafic si diferentele de sortare sunt la o data evidenta.
De cristale de dimensiune medie este cea care
separa de 50% din esantion de la celelalte; mediana este cea de-a 50
percentila.
Precautions
Desi multe dintre metodele de masurare de mai sus sunt standard, pentru a fi gandit ca anumite precautii trebuie luate atunci cand se ocupa cu un grad ridicat de suprafata locuibila nanosized pulberi. La reuniunea de oameni din diferite laboratoare din lume pe care le-am observat ca multi se pare simplu de masuratori poate duce la rezultate diferite drastic. Mai des decat nu, aceasta este din cauza prepararea probelor, datele de baza si de alegere a modelului pentru care reprezinta rezultatele finale. Acest lucru poate fi direct legate de lipsa de detaliata si standardizata si protocoale care trebuie sa fie strict respectate pentru a permite exacte si semnificative a compara si caracterizarea. Pentru aceste tehnici complimetary astfel de protocoale de asemenea, va fi dezvoltat cu un accent deosebit pe prepararea probelor inainte de analiza, de alegere a modelului, iar numarul de repetari pentru semnificativ statistic rezultatele - atat in ceea ce priveste prelevarea de probe si de analiza.
Electron Microscopy Techniques
Primul
prototip de electroni microscop a fost construit in 1931 de catre germani
ingineri si Max Ernst Ruska crea articolul. A fost bazate pe idei si
descoperiri de fizicianul francez Louis de Broglie. Desi
era primitiva si nu sunt adecvate pentru utilizarea practica,
actul a fost inca capabile de a magnifying obiecte de patru sute de ori.
Reinhold Rudenberg, director de cercetare al Siemens, au brevetat de electroni
microscop in 1931, desi a fost Siemens nu face pe electron microscoape de
cercetare la momentul respectiv. In 1937 a inceput Siemens Ruska de
finantare si sa-si dezvolte un
electron microscope. Siemens Ruska angajat de asemenea,
fratele lui Helmut la locul de munca cu privire la cererile, in special cu
specimene biologice.
In acelasi deceniu de anii 1930, Manfred von Ardenne pioneered de scanare
de electroni microscop si universale electron microscope.
Siemens primul produs comercial TEM in 1939, dar primul microscop practice de
electroni a fost construit la Universitatea din Toronto, in 1938, de catre
Eli Franklin Burton si studenti Cecil Hall, James Hillier si
Albert Prebus.
Desi moderne de electroni microscoape poate magnify obiecte de pana
la doua milioane de ori, ele se afla inca pe baza Ruska's
prototip.
Transmission Electron Microscopy (TEM and HRTEM)
|
Top of Form Forma originala de
electron microscopy, Transmitere electron microscopy (TEM) implica o
inalta tensiune fasciculului de electroni emis de catre un catod,
de obicei o tungsten filament si concentrat de lentile electrostatice
si electromagnetice. Fasciculului de electroni, care a fost transmis
printr-un exemplar care este partial transparenta pentru a
electroni transporta informatii despre structura interioara a
modelului din electron beam, care ajunge la sistemul de imagini de la
microscop. Spatiale in aceasta varianta de informatii (de
'imagine') este apoi magnified de o serie de lentile
electromagnetice pana cand nu se inregistreaza la apasarea un
ecran fluorescent, fotografice farfurie, sau lumina sensibile, cum ar fi un
senzor CCD (charge-dispozitiv cuplat) usile inchise. Imaginea de
detectat de catre CCD pot fi afisate in timp real pe un monitor sau
calculator. |
||
|
|
Bottom of Form |
|
Transmission Electron Microscopy (TEM)

TEM image of MgO (111)

TEM image of Pt-Ta2O5-SiO2
High Resolution Transmission Electron Microscopy (HRTEM)

HRTEM and FFT of an isolated MgO (111) nano-sheet.
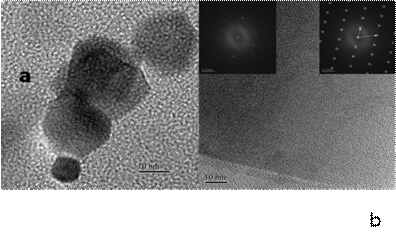
HRTEM and FFT of an gallium phosphate crystallite structure
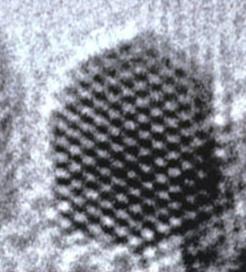
J.O. Bovin, The first atom resolution HRTEM micrograph of a 2.5 nm small gold cluster.

J.O. Bovin, HRTEM image of an Ag particle supported on ZnO
Scanning Electron Microscope (SEM)
Spre deosebire de TEM, in
cazul in care electroni de inalta tensiune grinda forma de imagine din
modelul, Electron Microscop de scanare (SEM) produce imagini de depistare a
redus de energie secundara care sunt electroni emisi de suprafata din
modelul de excitatie, datorita de catre primary electron beam .
In SEM, fasciculului de electroni este rastered din
esantion, cu detectoare de construirea unei imagini de cartografiere a
semnalelor detectate cu grinda de pozitie.
In general, TEM rezolutie este de aproximativ un ordin de magnitudine mai
mare decat cel mai SEM rezolutie, cu toate acestea, pentru ca se
bazeaza pe imagine SEM Suprafata procese, mai degraba decat
de transmisie este capabil sa imagine masiva a probelor si are o
adancime mult mai mare de vedere, si acest lucru poate produce imagini care
sunt o buna reprezentare a structurii 3D a esantionului.

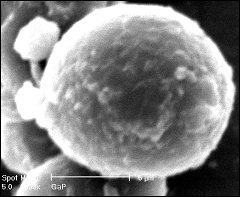
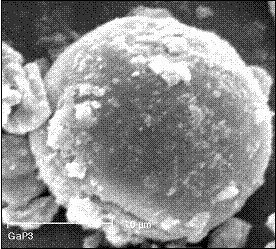
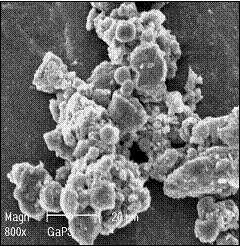
SEM of gallium phosphates

Scanning electron micrograph of a carbon nanotube mat.

Scanning electron micrograph of an washcoat catalyst
Reflection Electron Microscope (REM) and Scanning Transmission Electron Microscope (STEM)
In plus exista o reflectie Electron Microscope (REM). Ca TEM, aceasta tehnica presupune grinzi de electroni incident pe o suprafata, dar in loc de a folosi de transmisie (TEM) sau secundare de electroni (SEM), reflectate grinda este detectat. Aceasta tehnica este de obicei asociata cu reflexiilor mare de energie Electron diffraction (RHEED) si reflectie de mare pierderea de energie a spectrului (RHELS). O alta varianta este spin-polarizat Min-Energie Electron microscopy (SPLEEM), care este folosit pentru uitam la microstructure of magnetic domenii. [
STEM combina de inalta rezolutie, a TEM cu grinda rastering functii ale SEM, care sa permita o serie de tehnici de analiza pentru a fi utilizate, care nu sunt posibile cu conventionale TEM.
Reflection Electron Microscope (REM)

In Fig. (A) de la RHEED model (111) suprafata de Pt singur cristal este prezentata impreuna cu REM imagine inregistrata cu tarie Bragg bucuram de reflectie. De mic unghi intre grinda de imagini si modelul Suprafata cauzeaza o severa foreshortening si, prin urmare, o reducere de rezolutie in directia de observare, dupa cum este indicat de catre cele doua bare de magnificare. Contour line de vazut in rem imagine sunt monoatomic pasi. Aceasta imagine arata ca REM pregatit Pt (111) Suprafata atomically este plat
Fig. (b) arata REM imagine corespunzatoare si RHEED de model obtinuta de la 5,1 monolayer Co electrodeposited sub un relativ redus de-a lungul potential, potentialul de electrod-0.7V (vs Ag / AgCl). La aceasta conditie, ratele de crestere ale Co este de aproximativ 0.08nm / s. In aceasta imagine, un contrast de frana de particule, deoarece au fost observate de tri-dimensionala de crestere Co. RHEED model arata ca streaks deveni spotty si acest lucru sugereaza faptul ca a devenit de suprafata cu stare bruta Co electrodeposition
Fig. (C) REM imagine corespunzatoare si RHEED de model obtinuta de la 4,8 monolayer Co electrodeposited cu un inalt overpotential, potentialul de electrod-1.5V (vs Ag / AgCl). La aceasta conditie, ratele de crestere ale Co este de aproximativ 10nm / s si este foarte rapid. Aceasta imagine este diferit de la Fig. (B), contrast de frana de particule nu au fost respectate, dar contour line de pasi nu a fost clar. Si densitatea este mai mare de pasi, apoi cea a Pt (111) Suprafata. High overpotential corespunde supersatulation ridicat in faza de gaz-deposition. La supersatulation de mare, este cunoscut faptul ca nucleation ratelor este mare si structura de film deveni fin si omogen. De la REM si imagine de inalta overpotential, a considerat ca structura de electrodeposited Co Filmul este alcatuit din fine si omogene tri-dimensionala de insula, si aceasta din cauza unclearness contour line de pasi si de inalta densitate pas de suprafata.
Reflection high-energy loss spectrum (RHELS)
RHEED-Radarscans: Standard-Reconstruction of GaAs (311)A, c(4x4)
Scanning Transmission Electron Microscope (STEM)
 Misfit Dislocation
Loop at Au/Ni(111) Interface
Misfit Dislocation
Loop at Au/Ni(111) Interface
 31-2nm Wide Molybdenum Nanoparticles on Gold(111) Surface
31-2nm Wide Molybdenum Nanoparticles on Gold(111) Surface
 Hex-Heconstruction of Pt(100)
Surface
Hex-Heconstruction of Pt(100)
Surface
Light measurement techniques
Lumina tehnici de masurare
Using Light for Particle Size Measurement
Lumina are proprietati care pot fi utilizate pentru determinarea particulelor de dimensiune si de marimea particulelor distributii. In cazul unor instrumente de diffraction, unghiul de la care lumina este diffracted depinde de lungime de unda de lumina si de marimea particulelor. Unghiul de diffraction este masurata pentru a determina marimea. Pentru un anumit marimea particulelor, ar trebui sa lungime de unda de schimbare, unghiul se va schimba. Aceasta este o alta caracteristica de lumina care pot fi folosite pentru determinarea particulelor de dimensiune - este frecventa. Frecventa este o masura de cat de multe valuri trece printr-un anumit punct in timpul o secunda. De mai multe valuri care traverseaza mai aproape de punctul sau de la distanta intre valuri, cu cat este mai mare de frecventa. Frecventa de schimbare sau de schimbare de informare este utilizat in dinamica a Light scattering.
Metoda este
descrie fenomenul de dezvoltare a unui model de lumina care este legata de
o dimensiune a fost demonstrat de catre tinerii in 'dubla slit
experiment' in care lungime de unda de lumina ar putea fi
determinate. In acest experiment, monochromatic light a fost
directionat catre o cartela, care contine doua foarte
mici, taiate slits foarte aproape de ele. Valurile pot
interactiona destructively (1800 din faza de varf sau de un wavelet suprapus pe o vale de un alt val) sau
potinteractiona in mod constructiv, atunci cand faza (varf de un val de pe
valea suprapus de un alt val). Ca wavelets propage in
directie inainte de interferenta continua.
O carte de plasat in partea din fata a suprapus promovarea valuri va produce un model de linii (a se vedea figura) pentru a
cauza interferente. Model incepe de la centru, unde foarte intens lumina este situata. Un intuneric
linie rezultate de la imixtiuni distructive urmeaza. A doua linie este stralucitor
si este un rezultat al interferentei constructiva a wavelets. Modelul de linii se refera la lungime de unda de lumina de iluminat si de distanta dintre slits. Aceasta poate fi exprimata prin formula: d = λ / sin θ
Dynamic Light Scattering
Dynamic light scattering (DLS) este o teorie bine stabilite pentru tehnica de masurare marimea particulelor de peste marimea variaza de la cateva nanometers la cativa microni. Conceptul foloseste ideea ca mici particule in suspensie o mutare intr-un model aleator. Un microbiolog de numele de prima Brown a descoperit acest efect in timp ce respectarea obiecte de gandire pentru a fi organisme vii, microscopie de lumina. Mai tarziu ea a fost determinata de faptul ca 'organisme' au fost de fapt particule, dar termenul a suferit. Astfel, miscarea de mici particule de repaus intr-un lichid este denumit 'Brownian Motion' si poate fi usor de observat pentru aproximativ de particule (0 si 1,0) sustine un microscop, la o magnificare de 200 - 400X. Observare de particule mai mari, comparativ cu mici particule va arata ca mai mare de particule muta mai lent decat in cele mai mici in cazul in care temperatura este aceeasi. Potrivit lui Einstein, in evolutia sa Molecular Kinetic Theory (aplicate la caldura), molecule care sunt mult mai mici decat particulele de a putea sa o schimbare de directie a particulelor si a vitezei. Astfel moleculele de apa (0 microni) poate trece de polistiren ca particule mari ca o pereche de microni. Combinatia dintre aceste efecte este observat ca un ansamblu de vibratii si de circulatie a particulelor. Cand o sursa de lumina coerenta (cum ar fi un laser) cu o frecventa cunoscuta este directionat la particule in miscare, lumina este izolate, dar la o alta frecventa. Schimbarea de frecventa este destul de similar cu cel de schimbare in frecventa sau pitch-o atunci cand aude o ambulanta cu sirena ei wailing abordari si, in final, trece. Schimbarea este numit un Doppler shift sau a extinde, iar conceptul este aceeasi pentru lumina, atunci cand interactioneaza cu particule mici in miscare.
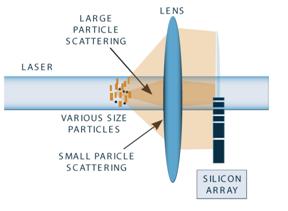
In scopul de particule de masurare, in functie de frecventa de schimbare este legata de marimea particulelor care cauzeaza trecerea. Datorita lor, mai mare viteza medie, mai mici particule determina o mai mare schimbare in functie de frecventa mult mai mare de particule. Este aceasta diferenta in frecventa izolate de lumina printre particule de dimensiuni diferite care este utilizat pentru a determina dimensiunile de particule prezent.
Comercial DLS utilizarea
instrumentelor, fie homodyne sau heterodyne configuratii. Cele doua
configuratii de masurare pot fi utilizate pentru a
obtine informatii de la Brownian motion frecventa mutat de
lumina.
Asa cum sa aratat pe dreapta (heterodyne de
masurare) frecventa-mutat de lumina este mixta (heterodyne
astfel de termen) cu stabil, unshifted lumina. Unshifted de lumina provine
de la laser, o parte din care se reflecta in instrumentul pentru a
detectorul. Aceasta lumina actioneaza ca un punct
stabil de referinta sau de baza pentru izolate, mutat de lumina
de la fiecare particula. Interactiunea (interferente) a mutat de
lumina reflectate si permite, de eliminare a
optice de inalta frecventa in prezent de particule
izolate-lumina. Aceasta a plecat doar cu atat este
mai mica mutat de frecvente, care sunt valorile de care sunt legate
de dimensiunea particulelor. O abordare similara este
utilizata in homodyne de masurare, dar de referinta este,
de fapt, mutat de lumina si de alte aleator in miscare, instabil
particule. In ambele cazuri, semnalul de frecvente sunt
orientative de frecventa Doppler schimburi, cauzata de particule
'Brownian motion si sunt baza de particule de masurare calibrarea
DLS.
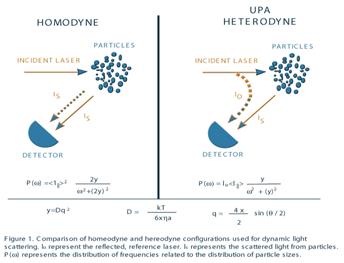
) prezentat in Figura 1
reprezinta spectre de putere carewExpressions pentru P ( sunt
distributiile de putere in functie de frecvente. Ele
arata, prin urmare, distributii de frecvente. Aceste
functii sunt Lorentzian unghiular de frecvente
pentru ambele homodyne si heterodyne de detectare. De marimea
particulelorw particulageste determinata de analiza acestor spectre de
putere.
Notati faptul ca exista diferente intre
cele doua spectre de putere pentru cele doua cazuri. In primul
rand, homodyne de detectare a , ingspectrului de putere depinde de doua ori pe
caracteristica de frecventa, 2 . In algtimp ce heterodyne de detectare a spectrului de putere depinde doar doilea rand,
homodyne putere este proportionala cu intensitatea luminii izolate
squared, (IS) 2, in timp ce heterodyne putere este proportionala cu
produsul dintre intensitatea izolate si de referinta (cu laser)
intensitate, (IS) (Io). Aceasta din urma inseamna ca heterodyne
nivel de semnal se pot face multe comenzi de magnitudine mai mare decat
homodyne semnal prin furnizarea de o mare de referinta, Io, folosind
reflectate cu laser. Acest concept permite, de masurare
a dilua foarte suspendarile si particule foarte mici, cu respectarea,
atunci cand lumina izolate la 180o (back-izolate).
Measurement of the particle size in liquid suspensions
Sedimentation
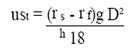 Rata
de dependente de densitate
Rata
de dependente de densitate
Underestimates dimensiunea
Limited interval dinamic
Incet
Zeta Potential
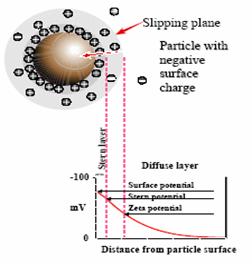
Strat de lichid in jurul
particulelor dupa cum exista doua parti; interior o
regiune (Stern layer), in cazul in care obligat ionii sunt puternic si un exterior (difuze) regiune in cazul in care acestea
sunt mai putin ferm asociate.
In acest strat difuze este o no limita de particule cu
care actioneaza ca o entitate unica.
Zeta Potential measurement of particle size: electrophoresis and acoustophoresis
Electrophoresis
Electrophoresis este o tehnica de separations care se bazeaza pe mobilitatea ionilor intr-un camp electric. Ioni pozitivi taxat migreze spre un electrod negativ negativ si-taxat ioni migreze spre un electrod pozitiv. Pentru motive de siguranta un electrod este, de obicei, la nivelul solului, iar celalalt este partinitoare pozitiv sau negativ. Ioni au diferite rate de migratie in functie de taxa totale lor, dimensiune si forma, si, prin urmare, pot fi separate.
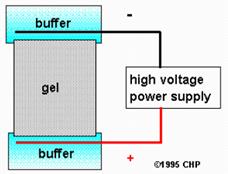
Electrodului consta dintr-un aparat de inalta tensiune de aprovizionare, electrozi, tampon, si un sprijin pentru buffer-ul, cum ar fi un filtru de hartie, benzi de acetat de celuloza, polyacrylamide gel, sau a unui tub capilar. Deschide tuburi capilare sunt utilizate pentru multe tipuri de probe.
In electrophoresis tehnici alternative un camp electric este aplicat pentru a dilua o suspendare si de mobilitate a particulelor este inregistrat. Aceasta este definita ca fiind viteza de particule / camp electric a fortei. Aceasta mobilitate este apoi legata de potential zeta de catre von Smoluchovski ecuatie sau Huckel ecuatie in functie de conditiile predominante (marimea particulelor si taria ionica).
![]()
von Smoluchovski equation
In cazul in care: Tc este timp de decantare, ή c este de viscozitate a
continua faza, k este
Electrophoretic Light Scattering/ Laser Doppler electrophoresis
Masuri mici schimbari de frecventa care decurg din particule in miscare intr-un camp electric aplicat.
Pentru acuratete, trebuie sa aiba o frecventa masurabile schimburi → → mare viteza inalta tensiune aplicate.
Probleme: electrolizei → evolutia de gaze, termice (Joule) efecte
Inlocuirea clasice prima dimensiune transportator ampholyte pH-ului gradients cu bine definite imobilizate gradients pH-ului a dus la rezolutie mai mare, imbunatatit, inter-laborator de reproductibilitate, capacitate de incarcare mai mare de proteine, si de o baza extinsa pH-ului limita pentru 2-D electrophoresis.
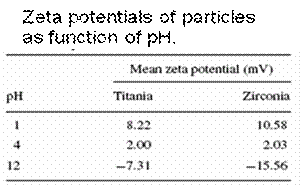
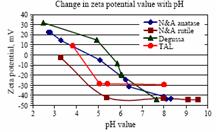
Din tabel, observa ca un potential zeta a fost gasit pentru a schimba semnul la pH = 4, cu potential zeta pozitive la pH <4 zeta si negative potentiale la pH> 4. Taxa de densitate de particule, σ, echilibrat intr-o solutie apoasa a pH-ului specificat este estimat la masurate potential zeta, ψ, cu diametrul
particulelor, d, dielectric constant de mediu ε, si X
(unde 1 / X este eficienta grosimea dubla
strat de particule inconjoara, utilizand:
![]()
X este
calculata utilizand ecuatia
![]()
unde ε este constanta dielectric de mediu (78,5 pentru apa), Ci este concentrarea in alunite / L ith de specii, KB Boltzmann este constanta (1,38 × 10-16 erg / grad), N este numarul Avagadro ( 6,023 × 1023), e electronice taxa este de (4,8 × 10-10 esunit).
In scopul de a estima marimea particulelor de particule, acestea sunt suspendate in solutie apoasa de trei conditii diferite pH-ului, viz. pentru TiO2 si ZrO2, 1, 4 si 12 si echilibrat pentru 24 de ore. Aceste conditii reprezinta acide pH-ului, punctul de taxa zero si, respectiv, conditia alcaline. Din punct de taxa zero (punctul de inflexion in teren de potential zeta fata de pH-ului) pentru ambele Titania si zirconie sols este in jur de pH = 4, sols au fost gasite pentru a fi instabila in jurul acestui pH-ului. Aceasta inseamna ca pH-ul sol trebuie sa fie departe de punctul de zero taxe pentru a preveni flocculation.
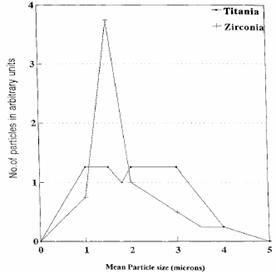
De marimea
particulelor de distributie a Titania
si particulele de zirconie:
Zeta potential nu este direct masurabila, dar ea poate fi calculata prin utilizarea unor metode adecvate de la teorie electrophoretic mobilitate si dinamic electrophoretic mobilitate. Acest lucru ar necesita presupunerea ca Zeta potential egal la Stern sau potentiale electrice Suprafata potential in dublu strat.

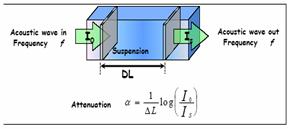
Acoustophoresis
Electrophoresis tehnici, cu toate acestea, pot fi aplicate numai pentru a dilua extrem de sisteme si nu exista un pericol inerent in extrapolare a rezultatelor de la sistem pentru a se dilua un concentrat in special in cazul in care sistemele de dizolvarea de material este o realitate [R. Greenwood, L. Bergstrom, J. Eur. Ceramica social. 17 (1997) 537]. Adsorbtie isotherms poate fi tedious sedimentarea si teste de multe ori poate dura mai multe saptamani pentru a furniza un raspuns. Utilizarea tehnicii de acoustophoresis apoi este posibil pentru a masura zeta potential de suspensii concentrate, care sunt mai reprezentative pentru suspensii concentrate reale utilizate in termen de industrie. Adaugat de avantaj este faptul ca experimentul este relativ rapid si drept inainte, singurul dezavantaj fiind posibil volumului mare de esantion necesare pentru masurare.
Acoustophoresis este relativ nou, dar similare din nou, in care un camp electric alternativ este aplicat pe un concentrat de suspensie. In loc de a masura mobilitatea particulelor de amplitudine a generat unda acustica este masurata de-a cerut electrosonic amplitudine. Aceasta este masurata apoi in functie de frecventa (300 kHz ± 11 MHz) pentru a genera o mobilitate a spectrului, care pot fi apoi legate de marimea particulelor si a potentialului zeta. Tehnica permite, de asemenea, automat titrarea de acid si de baza pentru a identifica iso electrice punct (iep) iep este pH-ului
De iep este valoarea pH-ului in cazul in care potentialul de zeta este zero. La iep nu exista repulsiv fortele in sistem, astfel incat fortele van der Waals sunt complet dominanta si particule sunt flocculated. Daca ar fi fost posibil, pentru a masura viscozitatea simultan, atunci, la un anumit shear rata de viscozitate ar fi un maxim la iep Zeta potential astfel obtinute cu succes a fost obtinut independent, corelat cu adsorption isotherms si rheological masuratori.
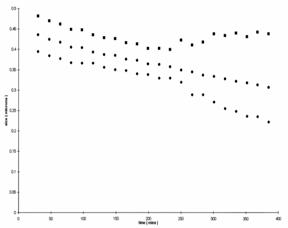
La dublu strat este perturbata de un val de ultrasunete. De deplasare a ionic nor cu privire la Suprafata creeaza un dipol moment. Suma de peste aceste momente de dipol multe particule creeaza un camp electric care este sensed de o antena de la primirea scufundate in esantion.
Suspendari de fractiunea de volum si de 0,07 fundal electrolitice a fortei de 10mm KCl au fost pregatite pentru ca de obicei. Automata a software-ului de titrare stabilit ca astfel de potential zeta 0 pH-ului in fiecare unitate a fost inregistrat peste un pH-ul potrivit pentru fiecare gama de pulbere. Initial a pH-ului de suspendare se reduce de la naturale, pH-ul de suspensie de la un set punct. PH-ul de suspendare este apoi a crescut la un alt set punct, astfel ca doua estimari pentru ISO electrice punct ar putea fi obtinute si de orice hystersis remarcat. Toate experimentele necesita amestecand energic, si 25C.
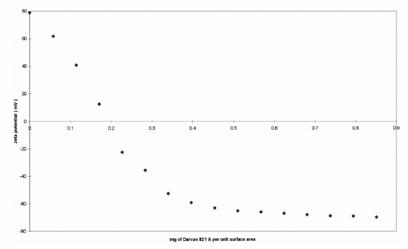
Intr-o noua abordare
pentru a descrie ionic Vibratii Potentiali (IVP) dependenta de
frecventa este luata in considerare de
efect de gradient de presiune si eficiente in masa de ioni. In plus,
la plecare ideal de comportament (fara interactiune) este luata
in considerare cu descrierea fortelor de relaxare (δ kirel) si
hidrodinamice interactiuni de ioni cu diferite viteze (δ kihyd). In aceasta abordare, Onsager de ecuatii de continuitate
sunt combinate cu MSA echilibru functii de corespondenta,
utilizand o functiilor Green's formalism. Cu aceasta
tehnica, este posibil sa se dea o descriere buna valabile
pana la 1 mol / l pentru un 1-1 sare, de multe fenomene de transport, cum
ar fi de sine reciproca si difuzarea, conductivitate si
acoustophoresis. Pentru fiecare specie taxat I, fundamentale, dinamic, atunci
relatia este scris ca:
![]()
Simtiti-va in cazul in care, este electrice vigoare, Fifr este forta de frecare, Fidif este difuzarea vigoare si FIP este vigoare gradient de presiune, mass-mi este de la speciile si vi sa viteza.
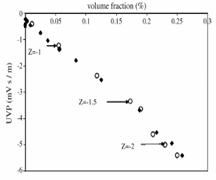
UVP results for the magnetic nanocolloids at very low volume fraction. Diamonds are experiments and circles theoretical signal for different colloidal effective charges.
Chemisorption
Metal Dispersion, D
Dispersion:
D=nS/nt
ns = numarul de atomi de suprafata
NT = numarul total de atomi
Chemisorption: titrarea Suprafata site-uri
nads
 numarul de
alunite in monolayer
numarul de
alunite in monolayer
P
Various Modes of Chemisorption
![]()
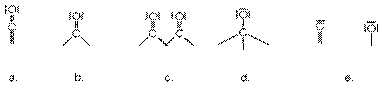
a. liniare sau terminale (X = 1)
b. bridged (X = 0.5)
c. bridged (X = 0,67)
d. valea sau triple (X = 0,33)
e. dissociative chemisorption (X = 0.5)
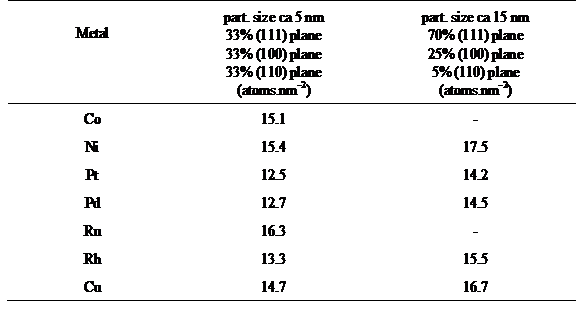 Number of Surface Atoms per Unit Area
Number of Surface Atoms per Unit Area
Chemisorption Stoichiometry
Obiectul de activitate al unui mod de metal, catalizatori depind de dispersie (numarul de atomi de metal locuibila / numarul total de atomi de metal x 100) sau pe suprafata de metal specifice. Numarul de suprafata de atomi de metal in mod normal, este estimata de catre chemisorption tehnici. Numarul de puternic chemisorbed adsorbate atomi sau molecule determina numarul de atomi de metal de suprafata, tinand cont de chemisorption stoichiometry a adsorbate.
Relations
Static method
SSP (m2g metal-1) = (Vm/22414)
Nan (1 / m) la (100/wt)
D (%) = (Vmn/22414 m) / (wt/100 M)
in cazul in care:
VM chemisorbed volumul de gaze necesar pentru a forma o monolayer (cm3)
La suprafata ocupata de catre un atom de metal (M2)
N chemisorption stoichiometry
M masa de catalizator (g)
Wt metalice de incarcare (%)
Complicatii
Equilibrium acoperire creste odata cu adsorbtie presiune
Non-selective chemisorption (chemisorption pe suport, spillover)
Reversibile chemisorption
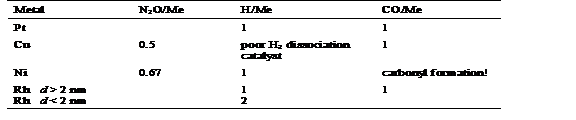
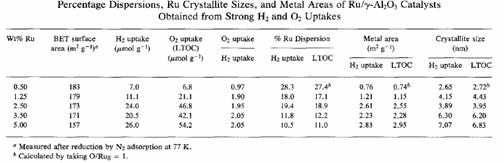
H2 Chemisorption on Ru/Al2O3 (323 K)
Crystallite dimensiuni (l) au fost calculate de la oxigen si hidrogen chemisorption de date folosind relatia I = 5/Sd, in cazul in care S este suprafata de metal si d este densitatea ruthenium.
H2 Chemisorption on Ni/Al2O3 (323 K)
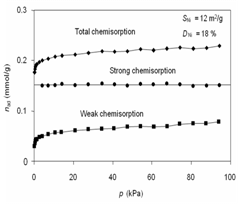
H2 Chemisorption (323 K)
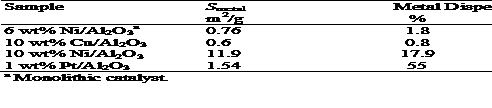
Dynamic methods
Flux continuu tehnica
(frontala sorption metoda)
N2O (g) + 2Cu0s → (Cu - O - Cu) s + N2 (g)
Curgerea de 10 NML / min
1% N2O/He la 300,
P = 0,1 MPa,
Mcat = 0,2 g
Pat inaltime = 20 mm
Timp de contact = 1,4 s
Δ T cca. 1 K
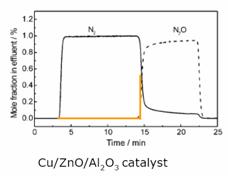
Pulse tehnica (pulse
sorption metoda)
N2O (g) + 2Cu0s → (Cu - O - Cu) s + N2 (g)
Cu/ZnO/Al2O3 catalizator
Injectarea succesive de mici
Impulsurile de volum cunoscut in
Fluxului de un gaz inert
Curgerea de 20 de NML / min, A
V = 1,0 ml N2O
T = 300 K
P = 0,1 MPa
# 66 = 125 μ mol / g N2
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |