Termodinamica electrochimica
Termodinamica electrochimica opereaza cu notiunea de sistem electrochimic, definit ca ansamblul format din mai multe faze conductoare in contact. Cel mai important sistem electrochimic este electrodul, constituit, in mod obligatoriu, dintr-un conductor electronic in contact cu un conductor ionic. Interfata metal/solutie de electrolit sau uneori mai simplu metal/electrolit, este cel mai reprezentativ si cel mai comun electrod.
Asocierea a doi electrozi reprezinta un sistem electrochimic cu un grad de complexitate superior electrodului. Se obtine astfel o celula electrochimica. În functie de destinatie celulele electrochimice se clasifica in doua categorii:
- celule de electroliza, unde trecerea curentului electric rezulta de pe urma aplicarii unei tensiuni exterioare intre cei doi electrozi; ele reprezinta sisteme electrochimice care transforma energia electrica in energie chimica si
- elemente galvanice, in care trecerea curentului electric rezulta in urma desfasurarii spontane a proceselor electromotric active de la cei doi electrozi; ele constituie reversul celulelor de electroliza, transformand energia chimica in energie electrica.
Potentialul unui electrod poate fi determinat numai in valoare relativa, fata de un alt electrod, numit electrod de referinta; asocierea celor doi electrozi constituie un element galvanic. Ca electrod de referinta la care se raporteaza potentialele tuturor electrozilor, s-a ales electrodul de hidrogen normal (EHN) definit astfel:
Pt(H2)/H2(p = 1 atm), H+(aH+ = 1) (1)
De aceea FEM a pilei galvanice formate prin asocierea electrodului dat cu electrodul de hidrogen normal este numeric egal cu potentialul relativ al electrodului, care se noteaza cu e. Potentialele relative sunt numite simplu potentiale de electrod, subintelegandu-se ca se refera la valori relative.
Întru-cat, prin asociere cu electrodul standard de hidrogen, un electrod poate fi anod sau catod, a aparut necesitatea atribuirii unui semn potentialului de electrod.
Semnul potentialului de electrod (in recomandarea IUPAC - International Union of Pure and Applied Chemistry) este dat de polaritatea observata la instrumentul de masura, daca electrodul al carui potential se masoara este legat la borna pozitiva a voltmetrului, iar electrodul de hidrogen normal - la masa.
Întru-cat utilizarea electrodului de hidrogen normal la masurarea potentialelor de electrod este dificila, in determinarile curente se folosesc alti electrozi de referinta. La exprimarea potentialelor de electrod trebuie specificat intotdeauna electrodul de referinta. Valorile potentialelor unor electrozi de referinta utilizati curent fata de EHN sunt redate in tabelul 1.
Tabelul 1. Electrozi de referinta (25o)
|
Electrod de referinta |
e[V]/EHN |
|
Hg/Hg2Cl2(s),KCl(sat) | |
|
Ag/AgCl(s),KCl(sat) | |
|
Hg/Hg2SO4(s),H2SO4(1 M) |
De la valoarea potentialului de electrod determinat fata de un electrod de referinta oarecare se poate trece la valoarea fata de EHN, folosind acest tabel. Astfel, daca potentialul determinat fata de electrodul de calomel saturat (ECS) este:
e = - 0,200 V/ESC
potentialul fata de EHN va fi:
e e eESC - 0,200 + 0,243 = 0,043 V
Functie de natura fazelor aflate in contact, electrozii se clasifica in urmatoarele categorii: electrozi de ordinul I, II, III, electrozi de amalgam, electrozi de gaz si electrozi redox. În continuare sunt redate tipurile de electrozi, lantul electrochimic corespunzator si expresia relatiei lui Nernst.
Electrozi de ordinul I, constituiti dintr-un metal in contact cu solutia ionilor sai: M/Mz+(aq), avand reactia potential activa (RPA):
Mz+ + ze- = M (2)
Potentialul relativ exprimat fata de EHN
este dat de relatia:![]()
![]() (3)
(3)
R - constant universala a gazelor, 8,31 J/mol*grad
T - temperatura in grade Kelvin
F - Nr. lui Faraday, 96500 As/mol
Electrozi de ordinul II, constituiti dintr-un metal, care in contact cu o combinatie greu solubila, este introdus intr-o solutie care contine un electrolit usor solubil, avand anion comun cu combinatia greu solubila. De exemplu, electrodul de argint-clorura de argint: Ag/AgCl(s),Cl-(aq), avand RPA:
Ag + Cl- = AgCl + e- (4)
si potentialul exprimat de relatia:
![]() (5)
(5)
Electrozi de ordinul III, constituiti dintr-un metal care, prin intermediul a doua combinatii greu solubile, este reversibil cu cationii unui alt metal. De exemplu, pentru electrodul avand lantul electrochimic:
Zn/ZnC2O4(s),CaC2O4(s),Ca2+(aq), RPA se obtine prin insumarea echilibrelor care se instaleaza la interfata metal-solutie de electrolit:
Zn ↔ Zn2+ + 2e- (6)
CaC2O4 ↔ Ca2+ + C2O42- (7)
Zn2+ + C2O42- ↔ ZnC2O4 (8)
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Zn + CaC2O4 = ZnC2O4 + Ca2+ + C2O42-
Potentialul electrodului este exprimat de relatia:
![]() (10)
(10)
Electrozi de amalgam, constituiti din amalgamul unui metal in contact cu o solutie care contine cationii metalului. De exemplu electrodul: K(Hg)/K+(aq), avand RPA:
K+ + e- = K
si potentialul exprimat de relatia:
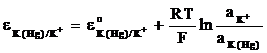 (12)
(12)
Electrozi de gaz, constituiti dintr-un metal inert peste care se barboteaza un gaz si care este introdus intr-o solutie care contine ionii gazului. De exemplu, electrodul de clor, avand lantul electrochimic: Pt(Cl2)/Cl2(g),Cl-(aq), cu RPA:
Cl2 + 2e- = 2Cl- (13)
si potentialul de electrod:
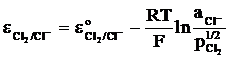 (14)
(14)
Electrozi redox, constituiti dintr-un metal inert introdus intr-o solutie care contine un cuplu redox. De exemplu: Pt/Cr2O72-,Cr3+,H+(aq), avand RPA:
Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O (15)
si potentialul de electrod:
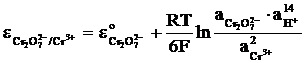 (16)
(16)
În relatia lui Nernst eo reprezinta potentialul normal de electrod. Potentialele normale la temperatura de 25°C se numesc potentiale standard. Însiruirea potentialelor standard in ordine crescatoare formeaza seria potentialelor de electrod standard - accesibile in tabele uneori alaturi de valorile coeficientului de temperatura, cu ajutorul carora se poate calcula potentialului normal la diferite temperaturi.
Raportul RT/F care intervine in relatia lui Nernst este egal cu 0,02568 V la temperatura de 25°C. Daca logaritmul natural se transforma in logaritm zecimal, factorul din fata logaritmului, la aceeasi temperatura, are valoarea 0,05914 V (uzual 0,059 V).
Întrucat activitatile individuale ale ionilor nu se cunosc, in relatia lui Nernst se folosesc activitatile medii ale electrolitilor, accesibile experimental, fie activitatile calculate pe baza teoriei Debye-Huckel a interactiunii ion-ion, in cazul solutiilor foarte diluate.
Cunoasterea potentialelor de electrod poate servi la aprecierea posibilitatilor de desfasurare a reactiilor redox. Cuplul redox cu potentialul mai pozitiv va fi oxidant pentru cuplul redox cu potentialul mai negativ, in timp ce cuplul redox cu potentialul mai negativ este reducator pentru cel cu potentialul mai pozitiv. De exemplu, din valorile potentialelor standard pentru cuplurile redox date in tabelul 2. rezulta ca permanganatul, in mediu puternic acid, poate oxida hexacianoferatul (II) la hexacianoferat(III), dar nu poate oxida Ce3+ la Ce4+.
Tabelul 2. Potentiale standard redox
|
Cuplu redox |
Mn2+/MnO4- |
Ce3+/Ce4+ |
[Fe(CN)6]4-/[Fe(CN)6]3- |
|
eo[V] |
Aceste consideratii sunt valabile in conditii standard (25°C, activitatile componentilor egale cu 1). In conditii diferite de cele standard se compara potentialele reale, calculate pe baza relatiei lui Nernst. Totodata informatiile pe care le furnizeaza valorile potentialelor de electrod se refera doar la posibilitatea desfasurarii reactiilor din punct de vedere termodinamic, fara a putea da indicatii cinetice.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |