
Termodinamica reducerii oxizilor de fier
Reducerea oxizilor de fier cu oxid de carbon
Tinand seama ca FeO (w stita) nu este stabila sub 275 sC (845 K) succesiunea etapelor reducerii cu CO a oxizilor de fier este:
La T > 572 sC Fe2O3 → Fe3O4 → FeO → Fe
La T < 572 sC Fe2O3 → Fe3O4 → Fe.
Reactiile de reducere sunt:
La T > 572 sC
1)
3Fe2O3 + CO = 2 Fe3O4 + CO2 ΔG![]() = -39 762 -53,61
= -39 762 -53,61![]() ; (J)
; (J)
Fe3O4 + CO = 3FeO + CO2 ΔG![]() = +35 427 - 40,20
= +35 427 - 40,20![]() ; (J)
; (J)
FeO + CO = Fe + CO2 ΔG![]() = -13 175 + 17,23
= -13 175 + 17,23![]() ; (J)
; (J)
La T < 572 sC
1) 3Fe2O3 + CO = 2Fe3O4 +CO2
2)
![]() Fe3O4 + CO =
Fe3O4 + CO = ![]() Fe + CO2 ΔG
Fe + CO2 ΔG![]() = -1034 + 4,87
= -1034 + 4,87![]() . (J)
. (J)
Considerand sistemul monovariant (aMeO = aMe = 1) constanta de echilibru pentru toate reactiile are forma:
Kp = ![]() .
.
Reactiile exoterme sunt (1), (3), (4), deci trei din patru, iar reactia (2) este endoterma. Acesta este un mare avantaj al reducerii cu CO a oxizilor de fier din punct de vedere termic, reactiile in ansamblul lor fiind exoterme. De aceea este justificata tendinta furnalistilor de a mari ponderea reducerii CO in furnal, in raport cu ponderea reducerilor cu carbon, care sunt puternic endoterme si maresc consumul de cocs.
Influenta temperaturii asupra echilibrului reactiilor depinde de semnul lui ΔH al reactiei. Rezulta ca reactiile (1), (3) si (4) sunt defavorizate de cresterea temperaturii, in timp ce reactia (2) este favorizata.
Deoarece
lg ![]() are valori mari pana la temperaturi ridicate (4,10 la
are valori mari pana la temperaturi ridicate (4,10 la
t = 1600 sC) reactia (1) este practic ireversibila. Aceasta reactie decurge foarte usor, si are faza gazoasa de echilibru formata aproape numai de CO2 si foarte putin CO.
Pentru reactiile (2), (3) si (4) lg Kp are valori relativ mici (0,94 - 0,48 pentru 1600 sC) nu sunt diferite de 1, are caracter reversibil. La echilibru reactiile (2), (3) si (4) au in faza gazoasa cantitati comparabile de CO si CO2.
Diagrama reducerii oxizilor de fier cu CO cunoscuta si sub numele de diagrama Chaudron este data in figura 3.12.
 100
100
% CO
80 3
60
4
40
20 2
1
400 572 800 1000 1200 1400 T, sC
Fig. 3.12. Reducerea oxizilor de fier cu oxid de carbon
Reactiile (1), (3), si (4) au panta pozitiva (constanta de echilibru scade odata cu cresterea temperaturii, iar %CO creste odata cu cresterea temperaturii), in timp ce reactia (2) are panta negativa (constanta de echilibru creste odata cu cresterea temperaturii, iar %CO scade odata cu cresterea temperaturii).
Intersectia
curbelor corespunzatoare reactiilor (2), (3) si (4) are loc la
temperatura de 572 sC (845 K) temperatura care se determina din
ΔG![]() = ΔG
= ΔG![]() = ΔG
= ΔG![]()
Compozitia
fazei gazoase corespunzatoare acestui punct de triplu echilibru la 572 oC
poate fi determinata cu oricare din expresiile ΔG![]() ale reactiilor 2, 3 sau 4.
ale reactiilor 2, 3 sau 4.
Rezulta :
![]() % CO2 ≈ 45 % pentru T = 572 sC adica cantitati comparabile.
% CO2 ≈ 45 % pentru T = 572 sC adica cantitati comparabile.
% CO ≈ 55 %
Domeniile de stabilitate ale oxizilor fierului functie de compozitia amestecului gazos CO - CO2 si de temperatura pe diagrama sunt:
- sub curba (1) este stabil Fe2O3;
- intre curba (1) si curbele (2) si (4) este stabil Fe2O3;
- intre curbele (2) si (3) este stabil FeO;
- deasupra curbelor (4) si (3) este stabil Fe.
Regula generala este ca un oxid este stabil in contact cu amestecul CO-CO2 numai daca la o temperatura data continutul de CO in acest amestec este mai scazut decat de cat cel de echilibru la temperatura respectiva, indicat de punctul de pe curba de echilibru a reactiei de reducere a oxidului respectiv.
Influenta presiunii
Reactiile nu au loc cu variatie de volum deci nu sunt influentate de presiune.
Reducerea oxizilor de fier cu H2
Din punct de vedere termodinamic exista o analogie intre reactiile de reducere cu CO si cele de reducere cu H2.
T > 572 sC
1.a)
3Fe2O3 + H2
= 2Fe3O4 + H2O ΔG![]() = -9268 - 82,03
= -9268 - 82,03![]() (J)
(J)
2.a)
Fe2O3 + H2 = 3FeO + H2O ΔG![]() = + 65 920 - 68,31
= + 65 920 - 68,31![]() (J)
(J)
3.a)
FeO + H2 = Fe + H2O ΔG![]() = + 17.318 - 10,88
= + 17.318 - 10,88![]() (J)
(J)
T < 572 sC
1.a) 3Fe2O3 + H2 = 2Fe3O4
+ H2O ΔG![]() = - 9.268 - 82,03
= - 9.268 - 82,03![]() (J)
(J)
4.a) ![]() Fe2O3
+ H2 =
Fe2O3
+ H2 = ![]() Fe + H2O ΔG
Fe + H2O ΔG![]() = + 29.459 - 25,25
= + 29.459 - 25,25![]() (J)
(J)
Considerand de asemenea sistemul monovariant (aMeO = aMe = 1) expresia constantei de echilibru este:
Kp =  .
.
Se observa ca din cele patru reactii de reducere cu H2 a oxizilor de fier numai (1.a) este exoterma, (2.a), (3.a) si (4.a) sunt endoterme. Din punct de vedere termodinamic reducerea cu hidrogen a oxizilor de fier este mai putin avantajoasa comparativ cu reducerea acestora cu CO. Reducerea cu hidrogen are insa avantajul de a fi mai rapida.
Influenta temperaturii. Numai reactia (1.a) este defavorizata de cresterea temperaturii, pentru celelalte constanta de echilibru creste odata cu cresterea temperaturii. Reactia (1.a) este ireversibila (Kp = 4,5 la 1600 sC) , celelalte sunt practic reactii reversibile.
Echilibrul reactiilor de reducere cu hidrogen este redat in figura 3.13. Curba (1.a) este usor crescatoare (constanta de echilibru descreste lent odata cu cresterea temperaturii), in timp ce toate celelalte sunt descendente (constanta de echilibru creste odata cu cresterea temperaturii).
 100
100
(4.a)
 80
80
60 (3.a)
40
20 (2 a)
(1.a)
400 572 800 1000 1200 1400 T, sC
Fig. 3.13. Reducerea oxizilor de fier cu hidrogenul.
Domeniile de stabilitate ale oxizilor de fier in atmosfera de H2 - H2O sunt identice cu cele de CO -CO2.
Prin suprapunerea curbelor de echilibru de la reducerea cu CO cu cele de la reducerea cu hidrogen rezulta figura 3.14.
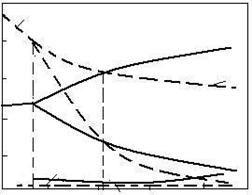 100
100
4a
 80 3
80 3
60 3a
4
40
20 1a 2a 2
0
810 1 1000 1200 1400 T, sC
Fig. 3.14. Diagrama combinata de reducere a oxizilor de fier cu oxid de
carbon si hidrogen
Aceasta figura permite analiza termodinamica comparativa a reactiilor de reducere a oxizilor de fier cu CO si H2:
a) curbele (2a), (3a) si (4a) se intersecteaza tot la temperatura de 572 sC. Pentru acest punct faza gazoasa contine 75 %H2 si 25 %H2O.
b)
temperatura de intersectie a curbelor (2) si (3) cu (2a) si (3a)
este de 810 sC (1083 K). Ea poate fi determinata prin calcul ΔG![]() = ΔG
= ΔG![]() sau ΔG
sau ΔG![]() = ΔG
= ΔG![]() . Acest lucru confirma cele stabilite la analiza
comparativa a reactiilor :
. Acest lucru confirma cele stabilite la analiza
comparativa a reactiilor :
2CO + O2 = 2CO si 2H2 + O2 = 2H2O
si anume ca la 810 sC oxidul de carbon si hidrogenul au aceeasi putere de reducere.
La T < 810 sC oxidul de carbon are putere mai mare de reducere, iar la T > 810 sC hidrogenul are putere mai mare de reducere. Acest lucru se poate constata si din diagrama de mai sus.
La 810 sC faza gazoasa de echilibru are aceeasi compozitie pentru reactiile (2) si (2a) ca si pentru reactiile (3) si (3a). La T > 810 sC faza gazoasa de echilibru este mai bogata in oxid de carbon si mai putin bogata in hidrogen pentru reactiile corespunzatoare.
Observatie Se confirma faptul ca cu cat faza gazoasa de echilibru a unui oxid este mai bogata in reducator, cu atat reducatorul respectiv este mai slab (are capacitate de reducere mai mica).
Reducerea oxizilor de fier cu carbon
La T > 572 sC
1)
3Fe2O3 + C = 2Fe3O4 + CO ΔH![]() = + 109 000 (J)
= + 109 000 (J)
Fe3O4 +C = 3FeO + CO ΔH![]() = + 206 275 (J)
= + 206 275 (J)
3)
FeO + C = Fe + CO ΔH![]() = 159 190 (J)
= 159 190 (J)
La T < 572 sC
1)
3Fe2O3 + C = 2Fe3O4 + CO ΔH![]() = + 109 000 (J)
= + 109 000 (J)
4)
![]() Fe3O4 + C =
Fe3O4 + C = ![]() Fe + CO ΔH
Fe + CO ΔH![]() = +168 000 (J)
= +168 000 (J)
Importanta pentru siderurgie au numai reactiile (2) si (3)
ΔG![]() = 206.215 - 214,7
= 206.215 - 214,7![]() ,
,
ΔG![]() = 159.190 -160,38
= 159.190 -160,38![]() .
.
Observatii
1) Toate reactiile de reducere cu carbon sunt endoterme;
2) In furnal numai o parte din FeO se reduce cu carbon cea mai mare parte din FeO se reduce cu CO si H2. Daca tot FeO s-ar reduce cu carbon, consumul de cocs ar fi mult mai mare decat cel realizat in prezent, de circa 480 kg cocs pentru 1 t fonta.
Studiul reactiilor de reducere cu carbon a Fe3O4 si FeO se poate face in bune conditii recurgand la schemele:
1) Fe3O4 + CO = 3FeO + CO2
+
![]() CO2 + C = 2CO
CO2 + C = 2CO
Fe3O4 + C = 3FeO + CO
si
2) FeO + CO = FeO + CO2
![]() CO2 + C = 2CO
CO2 + C = 2CO
FeO + C = Fe + CO
adica studiind echilibrul comun al reactiilor de reducere cu CO si al reactiei Bell-Boudouard.
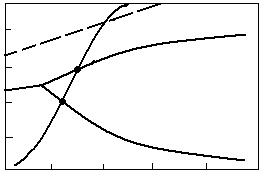 100
100
80 5 3
60 b a - 650 sC
4 b - 700 sC
40 a
20 1 2
0
400 600 800 1000 1200 1400 T, sC
Fig. 3.15. Diagrama reducerii cu carbon a Fe3O4 si
FeO; 1 -
2CO = CO2 + C; 2 - Fe3O4 + CO = 3FeO + CO2; 3 -
FeO + CO = Fe + CO2; 4- Fe3O4 + 4CO=3Fe+
4CO2 5 -
Compozitia gazului de furnal.
 %CO 800 1000 1200 1400 CO2 %
%CO 800 1000 1200 1400 CO2 %
80
Fe3O4+C Fe+C
60
FeO+C
40
20
0 t1 t2
400 600 800 1000 1200 T, sC
Fig. 3.16. Domeniile de stabilitate a oxizilor de fier si fierului in
prezenta carbonului si a oxizilor sai la P = 1 atm.
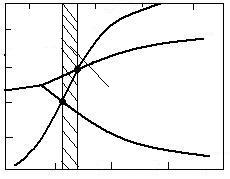
Grafic problema se rezolva ca in figura 3.15, suprapunand peste curbele de echilibru ale reactiilor Fe3O4 + CO = 3FeO + CO2 si FeO + CO = Fe + CO2 curba reactiei CO2 + C = 2CO (Bell-Boudouard).
La intersectia lor se obtin punctele 1 si 2, care indica, conform celor demonstrate anterior, temperaturile de incepere a reactiilor respective de reducere cu carbon a Fe3O4 si FeO. Aceste temperaturi sunt circa 650 sC pentru Fe3O4 si circa 700 sC pentru FeO.
Asa cum rezulta din figura 3.16 la temperatura t1 la care incepe reducerea cu carbon a Fe3O4 faza gazoasa de echilibru contine circa 41 %CO si 59 %CO2, iar la temperatura t2, la care incepe reducerea cu carbon a FeO, faza gazoasa de echilibru contine circa 58 %CO si 42 %CO2.
Influenta presiunii
Influenta presiunii asupra reducerii oxizilor de fier cu carbon se manifesta in virtutea faptului ca acest proces decurge cu crestere de volum si, conform principiului lui Lechatelier, este favorizat de scaderea presiunii in sistem. Acest lucru este ilustrat in figurile 3.15 si 3.17. In figura 3.15 este redata influenta presiunii prin intermediul reactiei Bell-Boudouard, a carei curba de echilibru se deplaseaza spre stanga odata cu scaderea presiunii in sistem. Aceasta atrage dupa sine deplasarea spre stanga a punctelor de intersectie a si b, respectiv micsorarea valorilor temperaturilor inceperii reducerii Fe3O4 si FeO cu carbon (t1 si t2). Curbele reactiilor de reducere a Fe3O4 si FeO cu oxid de carbon nu ase deplaseaza, deoarece aceste reactii nu sunt influentate de presiune.
Curba Bell-Boudouard care trece prin punctul multiplu aflat la 572 sC corespunde presiunii de 0,0623 atm.
In figurile 3.15, 3.16 si 3.17 nu s-a trasat curba de echilibru a reactiei: 3Fe2O3 + CO = 2Fe3O4 + CO2 deoarece aceasta reactie devine si mai ireversibila in prezenta carbonului si Fe2O3 este instabil din punct de vedere termodinamic in tot intervalul de temperatura. Domeniile de stabilitate a celorlalti oxizi ai fierului si a fierului metalic in prezenta carbonului si a oxizilor sai sunt prezentate in figurile 3.16 si 3.17.
In figura 3.16 domeniile de stabilitate sunt urmatoarele: sub 650 sC este stabil Fe3O4, intre 650 si 700 sC este stabil FeO, iar peste 700 sC este stabil fierul metalic.
Din figura 3.17 se observa ca, cresterea presiunii determina largirea domeniilor de stabilitate a Fe3O4 si FeO in functie de temperatura pe seama domeniului de stabilitate a fierului metalic.
 800 1000 1200 N/m2
800 1000 1200 N/m2
100
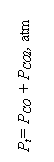 Fe3O4
+ C FeO + C
Fe3O4
+ C FeO + C
P = 10 at
10 98,06650.10-4
P = 1,0 at
1,0 9,806650.10-4
P = 0,1 at
0,10 α 0,980665.10-4
Fe + C
572 sC
t1 t2
500 600 700 800 900 T, sC
Fig. 3.17. Domeniile de stabilitate a oxizilor de fier si a fierului in
prezenta carbonului si a oxizilor sai la diferite valori ale
Pt= PCO + PCO2.
Carburarea fierului
Fierul redus cu carbon se poate carbura atat prin dizolvarea
carbonului, cat si prin formarea carburilor de fier. Fierul ![]() dizolva maximum 0,02 %C la temperatura de 738 sC, fierul
dizolva maximum 0,02 %C la temperatura de 738 sC, fierul
![]() dizolva maximum
2,11 % C la temperatura de 1153 sC, iar fierul
dizolva maximum
2,11 % C la temperatura de 1153 sC, iar fierul ![]() dizolva maximum
0,10 %C la temperatura de 1493 sC.
dizolva maximum
0,10 %C la temperatura de 1493 sC.
Solubilitatea carbonului in fierul lichid creste cu temperatura:
[%C] = 1,3 + 2,75![]() (sC)
(sC)
desi au fost identificate mai multe carburi de fier cea mai studiata este Fe3C care desi este metastabila, are o viteza mica de descompunere.
Formarea carburii Fe3C este un proces endoterm (ΔH > 0).
Dizolvarea carbonului in fier si mai ales prezenta Fe3C influenteaza procesele de reducere.
3Fe + C = Fe3C ΔG0
= 26 590 - 21,8![]() ;
;
ΔH > 0; → creste Te
FeO + ![]() C =
C =![]() Fe3C + CO ΔGs
= 156 645 -160,38
Fe3C + CO ΔGs
= 156 645 -160,38![]() ;
;
ΔH > 0; → Te = 727 sC
FeO
+ C = Fe + CO ΔGs
= 159 190 - 160,38![]() ;
;
ΔH > 0; → Te = 712 sC
Influenta dizolvarii carbonului in fier se poate pune in evidenta prin studierea relatiei Bell-Boudouard:
2CO
= CO2 + [C] K`p = ![]()
2CO
= CO2 + Cgrafit Kp = ![]()
Egalandu-se cele doua relatii rezulta:
![]() , dar ac < 1,
, dar ac < 1,
deci ![]() sau
sau ![]() .
.
Aceasta inseamna ca faza gazoasa corespunzatoare reducerii FeO contine mai putin CO decat atunci cand carbonul este liber si cu atat mai putin CO cu cat solutia de carbon in fier este mai diluata (ac << 1).
Influenta cementitei (Fe3C)
Aceasta fiind metastabila se descompune dupa urmatoarea reactie: Fe3C = 3Fe + C,
ceea ce face ca activitatea carbonului din cementita sa fie mai mare decat a grafitului:
aC(Ffe![]() C) > aC(grafit).
C) > aC(grafit).
In acest caz, situatia din punct de vedere termodinamic a reactiei Bell-Boudouard si deci a reducerii FeO este mai favorabila. Explicatia este urmatoarea:
- pentru reactiile
CO2
+ C (Fe3C) = 2CO 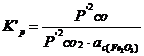
CO2
+ C grafit = 2CO ![]() .
.
Din egalarea celor doua reactii rezulta:
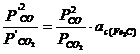
dar ![]() > 1, deci
> 1, deci ![]() sau
sau ![]() .
.
Deci sub influenta cementitei faza gazoasa de echilibru devine mai bogata in CO.
Particularitatile reducerii oxizilor in furnal
Datorita faptului ca incarcatura furnalului este dispusa in structuri alternative de minereu, cocs si fondanti, care se deplaseaza de sus in jos intalneste in calea ei o faza gazoasa din ce in ce mai bogata in CO.
Reducerea oxizilor Fe2O3 la Fe3O4 incepe la 1000 si 1200 sC are loc reducerea de la FeO la Fe . Experimentarile practice au aratat ca reducerea cu CO si cu H2 se termina la 950 - 1000 sC, dupa care are loc reducerea cu carbon.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |