GAZE REALE
Studiind comportarea gazelor reale Andrews (1869) a urmarit comprimarea izoterma a acestora, constatand ca la temperaturi ridicate izotermele gazelor reale se apropie foarte mult de cele ale gazelor perfecte (hiperbole echilatere); pe masura ce temperatura scade, apar diferente intre comportarea gazelor reale si a celor perfecte (fig. 1.25).
|
|
Fig. 1.25 - Izotermele gazelor reale |
Astfel, urmarind curba trasata
pentru temperatura
Pentru temperaturile Tb > Ta si Tc > Tb, portiunile orizontale ale curbelor izoterme se reduc.
La atingerea temperaturii Tk, denumita temperatura critica, transformarea gazului in lichid are loc instantaneu, fara variatie de volum, atunci cand presiunea atinge valoarea corespunzatoare punctului (K), denumit punct critic.
Pentru temperaturi mai mari decat TK, curbele izoterme sunt continue, apropiindu-se de forma izotermelor gazului ideal, iar starea lichida nu mai poate fi obtinuta, oricat de mare ar fi presiunea.
Parametrii punctului critic depind de natura substantei; pentru apa, punctul critic se inregsitreaza la 3710C si 222 bar, in timp ce pentru CO2 punctul critic se atinge la 310C si 74 bar.
Curba (K- n) pe care se gasesc punctele (A), pana la punctul critic, se numeste curba de condensare, iar curba (K - m) pe care se gasesc punctele (A') se numeste curba de vaporizare (parcurgand curbele izoterme din a' catre A, la atingerea punctului A' in masa de lichid apar primele bule de vapori). Curba (m-K-n) in ansamblu se numeste curba de saturatie si delimiteaza trei zone in diagrama presiune - volum:
Dupa cum s-a mentionat anterior, dincolo de izoterma corespunzatoare temperaturii Tk substanta nu se mai poate gasi decat in stare gazoasa.
Pentru ecuatiile de stare ale gazelor reale s-au stabilit numeroase ecuatii, care incearca sa aproximeze cat mai bine comportarea reala a gazelor; dintre acestea se pot mentiona:
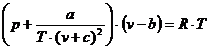 ,
,in care a, b, c, R sunt constannte, determinate pe cale experimentala;
![]() , in care
, in care ![]() se numeste factor
de compresibilitate, iar A, B, A', B'. sunt constante.
se numeste factor
de compresibilitate, iar A, B, A', B'. sunt constante.
Dupa cum s-a mentionat anterior, pe diagrama p - V pentru gaze reale sunt delimitate urmatoarele domenii (fig. 1.25):
Pe curba (K-n) substanta se gaseste sub forma de vapori saturati uscati.
Data fiind dependenta dintre presiunea si temperatura de vaporizare, precum si din cauza proportiilor variabile in care se pot gasi in echilibru vaporii si lichidul, pentru localizarea unei anumite stari din domeniul vaporilor saturati umezi s-a introdus o noua marime, denumita titlul vaporilori, care reprezinta participatia masica a vaporilor in amestecul de vapori si lichid:
![]()
in care mv este masa vaporilor saturati uscati, iar ml este masa de lichid. Pe curba de vaporizare mv = 0 si deci x = 0, iar pe curba de condensare ml = 0 si deci x = 1.
Volumul specific al vaporilor saturati umezi din punctul (1, fig. 1.26) se determina cu relatia:
![]()
|
|
Fig. 1.26 - Determinarea volumului specific al vaporilor saturati umezi |
Diagrama entropica T - s pentru gaze
reale este prezentata in fig. 1.27; procesul de incalzire 1 5 se desfasoara la
presiune
Se observa ca izobara se suprapune peste izoterma
in zona vaporilor saturati umezi, procesul 2 4 reprezentand
schimbarea de faza (vaporizarea), care are loc la presiune si temperatura
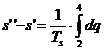
|
|
Fig. 1.27 - Diagrama entropica pentru gaze reale |
|
|
|
||
|
Fig. 1.28 - Diagrama lg p - i 1-curbe T = ct., in domeniul vaporilor supraincalziti; 2-curbe s = ct. |
||
Marimea 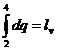 se numeste caldura latenta de vaporizare si reprezinta cantitatea de caldura
necesara vaporizarii unui kilogram de lichid.
se numeste caldura latenta de vaporizare si reprezinta cantitatea de caldura
necesara vaporizarii unui kilogram de lichid.
Folosind diagrama entropica, caldura latenta de vaporizare se poate determina cu relatia:
![]()
In studiul functionarii instalatiilor
frigorifice se utilizeaza frecvent si diagrama presiune - entalpie (fig.
1.28). Aceasta utilizeaza o scara logaritmica a presiunilor, ceea ce permite
reprezentarea unui domeniu larg de presiuni, cu mentinerea relativ
Punctul (K) reprezinta punctul critic; pe curba de saturatie sunt marcate izotermele, care in domeniul vaporilor umezi se suprapun peste izobare; in domeniul vaporilor supraincalzitti, izotermele sunt reprezentate prin curbele (1).
Pe diagrama sunt trasate si curbele
de entropie
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |