
Termodinamica, mecanismul si cinetica proceselor de rafinare a aliajelor
Principalele procese care au loc la rafinarea aliajelor sunt: dezoxidarea, desulfurarea, modificarea incluziunilor, degazarea.
1. Dezoxidarea otelului
Continutul de oxigen din otel trebuie strict controlat deoarece oxigenul dauneaza calitatii acestuia:
provoaca "fragilitatea la cald" a otelului, care se manifesta prin susceptibilitate marita la supraincalzire si aparitia de crapaturi in timpul deformarii plastice la cald, ca urmare a depunerilor de oxizi si oxisulfuri la limitele grauntilor structurali;
determina formarea suflurilor (golurilor)in timpul
solidificarii semifabricatelor, ca urmare a segregarii oxigenului spre centrul
semifabricatului, determinata de scaderea solubilitatii lui
cu scaderea temperaturii poate avea loc reactia ![]() , iar bulele de CO care nu reusesc sa se degajeze
formeaza defectul numit sufluri.
, iar bulele de CO care nu reusesc sa se degajeze
formeaza defectul numit sufluri.
Din aceste motive continutul de oxigen dizolvat in otelul calmat (complet dezoxidat) nu trebuie sa depaseasca limitele de 0,004.0,008% (40.80 ppm). In cazul otelurilor semicalmate si necalmate (incomplet dezoxidate), in care suflurile nu sunt considerate defecte, deoarece aceste oteluri sunt sudabile avand continut mic de carbon (< 0,2%), se admite un continut mai mare de oxigen dizolvat (150 - 300 ppm).
Continutul de oxigen in otel dupa afinare (decarburare) este functie de continutul de carbon al otelului asa cum reiese din diagrama de echilibru prezentata in figura 3.167, din care rezulta ca pe masura ce continutul de carbon se micsoreaza, continutul de oxigen in echilibru cu el este mai mare. De aceea in baia metalica la sfarsitul perioadei de afinare continutul de oxigen dizolvat este relativ mare (0,02 - 0,03%) si deci el trebuie micsorat pana la valorile la admisibile care nu mai dauneaza calitatii otelului pentru fiecare marca de otel.
Dezoxidarea este operatia tehnologica prin care se micsoreaza continutul de oxigen dizolvat pana la limita admisibila in fiecare tip de otel (calmat, semicalmat sau necalmat).
Dezoxidarea se poate realiza prin urmatoarele metode: dezoxidarea prin extractie (difuziune) de regula in agregatul de elaborare dar si in afara cuptorului la tratarea otelului cu zguri sintetice, prin precipitare, in agregatul de elaborare sau in oala (oala cuptor) si cu ajutorul vidului, in instalatii speciale.
Dezoxidarea prin extractie
Aceasta metoda se bazeaza pe faptul ca oxigenul, respectiv oxidul feros, este solubil atat in otel cat si in zgura. Conform legii repartitiei (distributiei) a lui Nerst in cele doua faze se stabileste un echilibru de repartitie, redat de raportul de repartitie a oxigenului sau oxidului feros:
![]() (3.916)
(3.916)
![]() (3.917)
(3.917)
In esenta, in cazul dezoxidarii prin extractie se creeaza conditii pentru ca oxigenul din otel sa fie "extras" in zgura. Actionandu-se asupra zgurii se micsoreaza concentratia de oxigen in aceasta si in virtutea raportului de repartitie care are valoare constanta la o temperatura data, se obtine micsorarea continutului de oxigen in baia metalica. Acest lucru se realizeaza prin:
a) introducerea pe zgura a unor elemente cu afinitate mare fata de oxigen (C,Si,Al) care reduc oxidul feros, conform reactiilor:
![]() (3.918)
(3.918)
![]() (3.919)
(3.919)
![]() (3.920)
(3.920)
b) inlocuirea zgurii de afinare (oxidanta) cu o noua zgura, reducatoare, cu continut foarte mic de FeO (sub 1% FeO).
c) tratarea cu zguri sintetice cu continut scazut de FeO(sub 1%).
Varianta a) se realizeaza in agregatul de elaborare atunci cand zgura de afinare cu continut mare de FeO (oxidanta) contine si oxizi ai unor elemente de aliere, elemente valoroase (Cr, Ti, V, W etc) care pot fi recuperate (regenerate) din zgura prin reactii de genul:
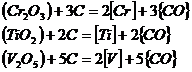
![]()
Varianta b) se aplica atunci cand zgura nu contine elemente care merita a fi recuperate. In acest caz oxidanta se evacueaza din cuptor si se formeaza o noua zgura, reducatoare, formata din amestec de var, fluorina, cocs, ferosiliciu cu 75% Si aluminiu metalic.
Exista doua tipuri de zguri reducatoare:
zgura alba, care contine mai putin de 1% CaC2, se foloseste la dezoxidarea otelurilor cu continut mediu si mic de carbon;
zgura carbidica, cu peste 1% CaC2 (in mod obisnuit 2 -3 %CaC2), se foloseste la dezoxidarea otelurilor cu continut ridicat de carbon.
Aceste doua variante sunt specifice dezoxidarii otelurilor elaborate in cuptoare electrice cu arc, in care in zona arcurilor electrice se formeaza carbura de calciu dupa reactia:
![]() . (3.924)
. (3.924)
CO rezultat mentine in cuptorul inchis o atmosfera relativ reducatoare cu 2,5 % O2, 22 %CO, 5 % CO2, 1,5 % H2 si 69 %N2, care permite mentinerea in zgura a unui continut scazut de FeO si deci o dezoxidare avansata.
Avantajul principal al dezoxidarii prin extractie este acela ca acela ca otelul astfel dezoxidat are puritate mare.
Dezavantajele dezoxidarii prin extractie in cuptor sunt:
durata dezoxidarii este mare, pentru o dezoxidare avansata sunt necesare 60.90 minute, ceea ce afecteaza foarte mult productivitatea cuptorului si consumul de energie electrica;
zgurile reducatoare cu CaC2 au aderenta mare fata de otel, ceea ce conduce la impurificarea otelului cu incluziuni de zgura.
Din aceste motive dezoxidarea prin extractie in cuptor se aplica din ce in ce mai putin in otelarii.
Varianta c) se aplica la tratarea otelului in afara cuptorului de elaborare. Dezoxidarea cu zguri sintetice in afara agregatului de elaborare nu prezinta aceste dezavantaje, realizandu-se in conditiile emulsionarii otelului cu zgura (care nu contine CaC2) si decurgand foarte rapid (10 - 12 min). Din aceste motive aceasta varianta de dezoxidare este din ce mai agreata de producatorii de otel.
Tabelul 3.60 Compozitii caracteristice de zguri dezoxidante, %
|
Tipul de zgura |
CaO |
SiO2 |
MgO |
Al2O3 |
FeO max |
MnO max |
CaS max |
CaF2 |
CaC2 |
|
Alba | |||||||||
|
Carbidica | |||||||||
|
Sintetica |
1.2. Dezoxidarea prin precipitare
Metoda consta in introducerea in baia metalica a unor elemente care au afinitatea fata de oxigen mai mare decat a fierului si care nu dauneaza calitatii otelului, denumiti dezoxidanti.
Aceste elemente reactioneaza cu oxigenul dizolvat in otel si formeaza oxizi stabili si insolubili in otelul lichid, care se separa (precipita) in faze oxidice distincte. Reactia generala de dezoxidare prin precipitare este:
![]() (3.925)
(3.925)
sau
![]() (3.926)
(3.926)
unde
![]() si
si![]() sunt oxigenul sau oxidul feros dizolvate in otel;
sunt oxigenul sau oxidul feros dizolvate in otel;
![]() - este elementul dezoxidat;
- este elementul dezoxidat;
![]() - oxidul dezoxidantului (faza oxidica).
- oxidul dezoxidantului (faza oxidica).
Pentru ca reactia de dezoxidare sa poata avea loc, este necesar sa se indeplineasca conditia:
![]() (3.927)
(3.927)
de unde:
![]() (3.928)
(3.928)
Deci conditia ca un element sa poata avea rol de dezoxidant este ca afinitatea lui fata de oxigen sa fie mai mare decat a fierului fata de oxigen.
Prin dezoxidare se urmareste micsorarea potentialului de oxigen in otel, prin urmare trebuie indeplinita conditia:
![]() (3.929)
(3.929)
Dar 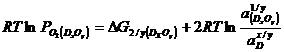 si
si ![]() , deci conditia (3.929) devine:
, deci conditia (3.929) devine:
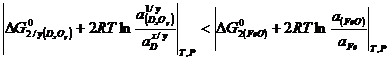 (3.930)
(3.930)
Puterea de dezoxidare a unui dezoxidant este data de continutul de oxigen din otel, aflat in echilibru cu dezoxidantul.
Constanta de echilibru a reactiei de dezoxidare 3.925 este:
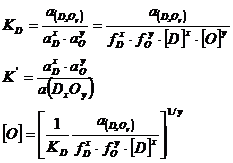
![]()
Cu cat
puterea de dezoxidare a dezoxidantului D este mai mare, cu atat ![]() este mai mic.
este mai mic.
Se poate spune ca puterea de dezoxidare a unui dezoxidant este cu atat mai mare, cu cat potentialul de oxigen al otelului este mai mic.
Continutul minim de oxigen care poate sta in echilibru cu elementul dezoxidant depinde de urmatorii factori:
temperatura; cu cat temperatura este mai scazuta, cu atat puterea de dezoxidare a unui dezoxidant este mai mare, deoarece KD creste cu scaderea temperaturii, reactiile de dezoxidare fiind exoterme;
activitatea
termodinamica a oxidului elementului dezoxidant; cu cat aceasta este mai
mica, cu atat puterea de dezoxidare aste mai mare. In cazul
utilizarii dezoxidantilor complecsi (silicomangan,
silicicocalciu, silicomanganaluminiu etc) produsii de dezoxidare sunt
compusi complecsi in care activitatea termodinamica a
fiecarui oxid este mai mica decat unu. De exemplu, in cazul
dezoxidarii cu silicomangan se formeaza silicati complecsi
de fier si mangan in care ![]() si, conform
relatiei (3.933), in echilibru cu aceeasi concentratie a
elementului dezoxidant se afla o concentratie mai mica de
oxigen, adica puterea de dezoxidare a elementului dezoxidant creste.
si, conform
relatiei (3.933), in echilibru cu aceeasi concentratie a
elementului dezoxidant se afla o concentratie mai mica de
oxigen, adica puterea de dezoxidare a elementului dezoxidant creste.
Pentru ca un dezoxidant sa fie eficient, pe langa faptul ca trebuie sa indeplineasca conditia (3.928) sau (3.930), trebuie sa aiba greutate specifica si granulatie mari pentru a putea patrunde in otelul lichid si sa reactioneze cu oxigenul dizolvat in otel. De aceea elementele dezoxidante se folosesc sub forma de feroaliaje (fierul mareste densitatea aliajului) in bucati.
Daca consideram otelul lichid solutie
infinit diluata (fD,fO=1), iar oxidul dezoxidantului
ca un oxid pur ![]() , constanta de echilibru a reactiei de dezoxidare are
forma:
, constanta de echilibru a reactiei de dezoxidare are
forma:
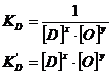
![]()
Cu cat puterea de dezoxidare a unui dezoxidant este mai
mare cu atat ![]() este mai mic.
este mai mic.
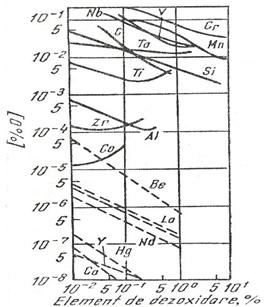
Din relatia 3.933 rezulta ca ![]() . In fig. 3.184 este prezentata dependenta
concentratiei de oxigen dizolvat in otel functie de
concentratia diferitelor elemente dezoxidante utilizate pentru dezoxidarea
otelului.
. In fig. 3.184 este prezentata dependenta
concentratiei de oxigen dizolvat in otel functie de
concentratia diferitelor elemente dezoxidante utilizate pentru dezoxidarea
otelului.
Fig. 3.184.
Continutul de oxigen in otel aflat in echilibru cu diferiti
dezoxidanti la temperatura de 1600 C.
Cercetarile experimentale si analiza
termodinamica a reactiilor de dezoxidare [58,59,60] arata
ca functia ![]() nu este monotona,
ci prezinta un minim [58] sau chiar un maxim [60] care se explica
prin variatia coeficientilor de activitate ai oxigenului si
dezoxidantului in functie de compozitie.
nu este monotona,
ci prezinta un minim [58] sau chiar un maxim [60] care se explica
prin variatia coeficientilor de activitate ai oxigenului si
dezoxidantului in functie de compozitie.
Pentru stabilirea caracterului functiei ![]() se poate utiliza
constanta KD a reactiei de dezoxidare:
se poate utiliza
constanta KD a reactiei de dezoxidare:
![]() (3.936)
(3.936)
![]() (3.937)
(3.937)
Logaritmand relatia (3.936) ti rearanjand termenii se obtine:
![]() (3.938)
(3.938)
Pentru a se studia caracterul functiei ![]() (existenta unor
extreme) trebuie sa se ia in consideratie prima si a doua
derivata a relatiei (3.938) in raport cu
(existenta unor
extreme) trebuie sa se ia in consideratie prima si a doua
derivata a relatiei (3.938) in raport cu ![]() . Pentru cazurile cand a doua derivata
. Pentru cazurile cand a doua derivata 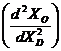 este pozitiva, ceea ce insemna ca functia
prezinta un minim, concentratia elementului dezoxidant,
corespunzatoare acestui minim, se determina din prima derivata,
este pozitiva, ceea ce insemna ca functia
prezinta un minim, concentratia elementului dezoxidant,
corespunzatoare acestui minim, se determina din prima derivata, ![]() , prin egalarea ei cu zero:
, prin egalarea ei cu zero:
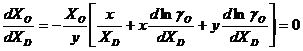 (3.939)
(3.939)
Valoarea lui ![]() pentru care
pentru care ![]() este data de relatia:
este data de relatia:
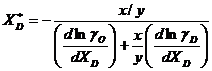 (3.940)
(3.940)
dar:
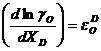 ; iar
; iar 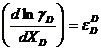 (3.941)
(3.941)
si astfel:
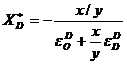 . (3.942)
. (3.942)
Pentru calcule este preferabila folosirea expresiei:
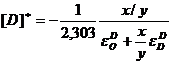 (3.943)
(3.943)
sau:
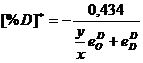 (3.944)
(3.944)
unde
![]() este concentratia
critica a elementului dezoxidant, corespunzatoare concentratiei
minime a oxigenului la echilibru.
este concentratia
critica a elementului dezoxidant, corespunzatoare concentratiei
minime a oxigenului la echilibru.
Relatiile 3.943 si 3.944 au sens numai daca se indeplineste conditia:
![]() sau
sau ![]() (3.945)
(3.945)
Din relatiile (3.943) sau (3.944) reiese
ca este preferabila utilizarea dezoxidantilor care formeaza
oxizi in care raportul y/x este cat mai mare, pentru a obtine o
concentratie critica ![]() cat mai mica.
cat mai mica.
Calculul
concentratiei critice ![]() pentru unele reactii de dezoxidare.
pentru unele reactii de dezoxidare.
Pentru calcul se vor adopta valorile coeficientilor de interactiune din tabelul 3.61
Echilibrul C - O
Conditia 3.945: 1(-0,45) + 1(0,196) = - 0,274< 0 este indeplinita.
![]() .
.
Tabelul 3.61. Date pentru calculul echilibrului unor reactii de dezoxidare la 1600 0C si P=1 atm
|
Produsul de dezoxidare |
|
|
|
|
|
|
|
|
CO |
5 x102 |
||||||
|
V2O3 |
1.334x102 |
||||||
|
Cr2O3 |
9,09x103 |
||||||
|
SiO2 |
4,55x104 |
||||||
|
TiO2 |
1,15x106 |
||||||
|
Al2O3 |
2,33x1014 |
Echilibrul Cr - O
Conditia 3.945: 3/2(-0,04) - 0,0003 = - 0,051< 0 este indeplinita.
![]() .
.
Echilibrul Si - O
Conditia 3.945: 2(-0,12)+1(0,161) = -0,079< 0 este indeplinita.
![]() .
.
Echilibrul Ti - O
Conditia 3.945: 2(-0,4)+1(0,0295) = - 0,77< 0 este indeplinita.
![]() .
.
Echilibrul V - O
Conditia 3.945: 3/2(-0,20)+0,015= - 0,28< 0 este indeplinita.
![]() .
.
Echilibrul V - O
Conditia 3.945: 3/2(-1,85)+0,045= - 2,73< 0 este indeplinita.
![]() .
.
Rezultatele calculelor sunt prezentate in figura 3.185.
Fig.3.186. Curba
[%O]=f([%Al]) calculata de G.R.
Pierre [103]. Fig. 3.185. Curbele
[%O]=f ([%D])calculate pe baza datelor din tabelul 3.61.
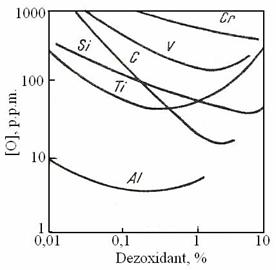
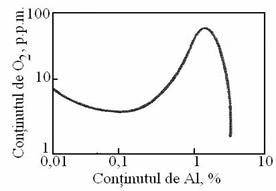
Daca in calculul coeficientilor de activitate se folosesc si coeficientii de interactiune de ordinul doi [58] se obtine curba [%O]=f ([%D]) din figura 3.186 care prezinta un maxim identificat anterior pe cale experimentala.
Compozitia chimica a produselor de dezoxidare (oxizi, solutii, compusi complecsi) difera in functie de continutul de dezoxidant:
daca in fierul lichid se afla multi atomi de oxigen si putini atomi de dezoxidant, rezulta compusi oxidici in care unui atom de dezoxidant ii revine un numar mare de atomi de oxigen;
la continuturi mari de dezoxidant este mai probabil sa se formeze produsi de dezoxidare in care unui atom de dezoxidant ai revin mai putini atomi de oxigen.
1.3. Particularitatile dezoxidarii cu diferiti dezoxidanti
Reactiile de dezoxidare au fost studiate de foarte multi cercetatori. O trecere in revista a rezultatelor obtinute sunt prezentate in lucrarea [61].
1). Dezoxidarea cu mangan
Manganul este un dezoxidant slab. Din acest motiv el nu poate lega tot oxigenul dizolvat in otel, iar produsul dezoxidarii nu este MnO pur, ci solutii solide sau lichide FeO-MnO:
![]() . (3.946)
. (3.946)
Solutiile lichide se formeaza cand ![]() . Starea de echilibru a otelului cu produsul de
dezoxidare Mn(Fe)O este prezentata in figura 3.187.
. Starea de echilibru a otelului cu produsul de
dezoxidare Mn(Fe)O este prezentata in figura 3.187.
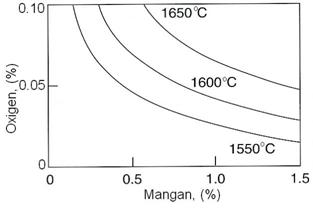
Fig. 3.187.
Continuturile de mangan si oxigen ale fierului in echilibru cu produsul de dezoxidare
FeO-MnO.
Pe baza studiului reactiei:
![]() (3.947)
(3.947)
s-a stabilit ca, continutul minim de oxigen care poate sta la 1600 0C in echilibru cu 1% Mn este de 0,0765%, adica mult mai mare decat cel admis in otelurile calmate (0,004.0,008). Deci dezoxidarea completa cu mangan nu este posibila.
In realitate, continutul de oxigen in echilibru cu manganul este mai mic decat cel rezultat din calculul termodinamic, deoarece concentratiile locale de mangan in zona din baia metalica unde a ajuns feromanganul introdus in cuptor pot fi mult mai mari, pana la dizolvarea completa si difuzia lui in toata masa de otel, decat media luata in calcule. Cu toate acestea, manganul nu poate fi utilizat singur ca dezoxidant numai pentru otelurile necalmate sau semicalmate.
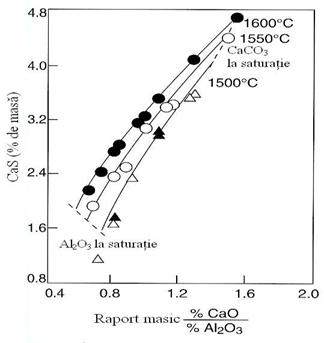
2). Dezoxidarea cu siliciu
Siliciul este un dezoxidant mai puternic decat manganul. Calculele arata ca la 1600 0C in echilibru cu numai 0,25 % Si se afla circa 0,01 %O. Aceasta face ca siliciul sa poata fi folosit cu eficienta la dezoxidarea otelurilor semicalmate, necalmate si calmate.
La continuturi mici de siliciu, produsii de dezoxidare sunt silicati de fier lichizi mai mult sau mai putin bogati in SiO2. La continuturi mari de siliciu se poate forma si SiO2 solid, figura 3.188.
In practica industriala, el se foloseste sub forma de ferosiliciu, silicomangan, sau alte feroaliaje complexe (AlMnSi, AlCaSi etc).
La dezoxidarea cu ferosiliciu si feromangan sau silicomangan (SiMn) adaugati in cuptor sau
in oala de turnare, produsii de dezoxidare sunt, functie de continutul de Si si de Mn, silicati de mangan lichizi (MnO.SiO2) sau SiO2 solid.
Reactiile sunt:
![]()
![]()
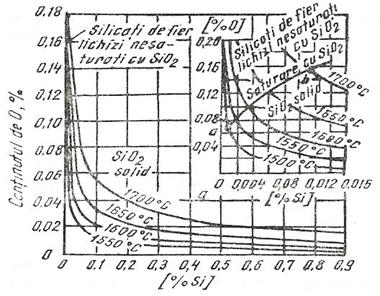
Fig. 3.188. Echilibrul
[O] - [Si] la diferite temperaturi.
Fig. 3.189.
Activitatile oxizilor solizi MnO-SiO2 din topituri.
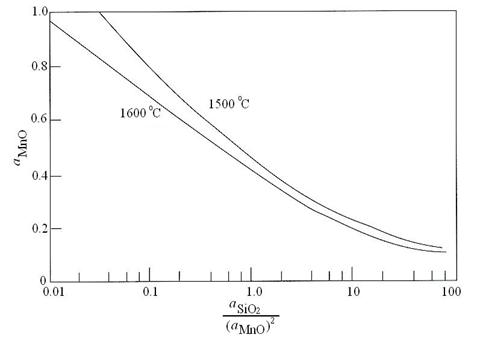
Din cercetarile experimentale efectuate pentru reactia de dezoxidare cu Si si Mn:
![]() (3.953)
(3.953)
constanta de echilibru la concentratii mici de siliciu este:
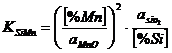 pentru care
pentru care ![]() (3.954)
(3.954)
unde activitatile oxizilor le putem considera unitare corespunzator oxizilor solizi puri.
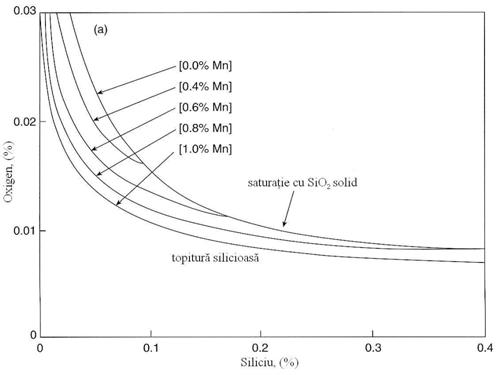
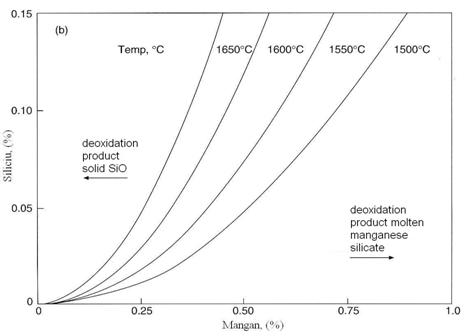
Fig. 3.190. Echilibrul relatiilor de dezoxidare a
otelului cu mangan si siliciu.
Pentru concentratii mai mari de siliciu ( >0,4%)
coeficientul de activitate ![]() poate fi utilizat in
ecuatia de mai sus, deci:
poate fi utilizat in
ecuatia de mai sus, deci:
![]() (3.955)
(3.955)
Activitatea MnO in silicatul de mangan lichid a fost masurata de Rao si Gaskell [50].
Rezultatele obtinute sunt in buna concordanta cu rezultatele altei lucrari de Abraham si altii [50]. Activitatea oxizilor (relativ la oxidul solid) este prezentata in figura 3.189.
Pentru otelul lichid care contine sub 0,4% Mn produsul de dezoxidare este un silicat bogat in MnO cu FeO < %, de aceea datele referitoare la activitate din figura 3.198 pot fi utilizate impreuna cu ecuatia (3.953) in estimarea starii de echilibru a dezoxidarii cu Si/Mn asa cum sunt prezentate in figura 3.190. Produsul de dezoxidare sunt fie silica solida fie silicatul de mangan functie de temperatura, continuturile de Si si Mn asa cum arata figura 3.190.
In cazul formarii silicei saturate, dezoxidarea este numai cu siliciu pentru care relatia de echilibru, considerand activitatea silicei egala cu unu, este redusa la:
![]() . (3.956)
. (3.956)
3. Dezoxidarea cu aluminiu
Aluminiul are putere mai mare decat manganul si siliciul. Se foloseste atat sub forma de aluminiul primar sau secundar, cat si sub forma de feroaliaje (feroaluminiu, ferosilicoaluminiu, AlMnSi, AlCaSi etc), dar aproape intotdeauna numai pentru completarea dezoxidarii, dupa dezoxidarea cu Mn si Si, fiind un dezoxidant foarte puternic. Produsul de dezoxidare la dezoxidarea numai cu aluminiu este Al2O3 solid sau spinel FeO.Al2O3.
In cazul formarii aluminatului de fier dupa reactia:
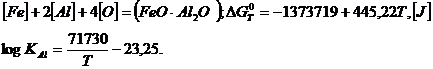
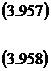
La continuturi obisnuite de aluminiu in otel, continutul de oxigen care poate fi realizat in conditii de echilibru este de ordinul a 0.001 - 0,0005 % (10-5 ppm) asa cum rezulta din figura 3.191, adica mult sub limita necesara pentru otelurile calmate.
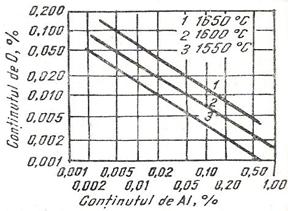
Fig. 3.191. Echilibrul
[O] - [Al] in otel.
Numeroasele experimentari de laborator efectuate pentru dezoxidarea cu aluminiu a fierului topit folosind tehnica EMF pentru masurarea activitatii oxigenului in topitura constantele de echilibru obtinute din studii experimentale independente s-a ajuns la concluzia ca valoarea medie a constantei de echilibru pentru reactia de mai jos, este:
![]() (3.959)
(3.959)
![]() , (3.960)
, (3.960)
considerand activitatea aluminei = 1 corespunzator Al2O3 solid pur.
Efectul aluminiului asupra coeficientului de activitate a
oxigenului dizolvat in otelul lichid este ![]() . La concentratii mici de aluminiu,
. La concentratii mici de aluminiu, ![]()
In alte lucrari, pentru o concentratie data de Al, fara corectia pentru conductia electronica partiala, se inregistreaza pe aparate comerciale, o activitate a oxigenului mai mare decat valoarea adevarata la echilibru. In acest caz, pentru reactia de mai sus constanta aparenta de echilibru este:
![]() . (3.961)
. (3.961)
De asemenea aceste aparate de masura
afiseaza oxigenul remanent in ppm ca si cum coeficientul de
activitate ![]() in otelul dezoxidat cu Al.
in otelul dezoxidat cu Al.
Daca otelul dezoxidat cu Al contine 0,05 %Al, activitatea aparenta a oxigenului utilizand relatia (3.961) va fi (ppm O x fO) = 3,62; notand ca la 0,05% Al, fO=0,64, concentratia aparenta a oxigenului dizolvat va fi 3.64/0,64=5,65 ppm O.
Pentru a aprecia comparativ puterea de dezoxidare a manganului,
siliciului si aluminiului se poate retine ca oxigenul rezidual
in otel, corespunzator echilibrului cu 0,1 %Mn, si Al are valori de 0,175 %, 0,021%, 0,0028 % la
1600 0C si de o,12 %, 0,009 % si 0,00013 % la temperatura
de 1500 0C. Cu toate acestea nu se practica dezoxidarea numai
cu aluminiu din cauza produsilor de reactie solizi care pot obtura
orificiul de turnare al oalei si mai ales duzele la turnarea
continua.![]()
De regula aluminiul adaugat in oala se
foloseste pentru completarea dezoxidarii. Astfel, otelul
semicalmat cu un oxigen remanent de 40 - 25 ppm se dezoxideaza prin adaugarea in oala de turnare a unei
cantitati mici de aluminiu impreuna cu SiMn, sau o
combinatie de feosiliciu si feromangan. In acest caz produsul de
dezoxidare este aluminosilicatul de mangan avand o compozitie
similara cu ![]() . Cu o cantitate mica de aluminiu adaugat, de
exemplu 35 kg pentru o topitura de 220 - 240 t impreuna cu Si/Mn, cea
mai mare parte din aluminiu se consuma in aceasta dezoxidare
combinata cu Si si Mn. Aluminiul rezidual dizolvat in otel va fi
sub 10 ppm.
. Cu o cantitate mica de aluminiu adaugat, de
exemplu 35 kg pentru o topitura de 220 - 240 t impreuna cu Si/Mn, cea
mai mare parte din aluminiu se consuma in aceasta dezoxidare
combinata cu Si si Mn. Aluminiul rezidual dizolvat in otel va fi
sub 10 ppm.
Pentru produsul de dezoxidare ![]() saturat cu Al2O3 activitatea silicei
este 0,27 la 1650 0C, 0,17 la
1550 0C si scade posibil pana la]0,12 la 1500 0C.
Folosind aceste valori ale activitatii silicei, s-a calculat
echilibrul dezoxidarii pentru Al/Si/Mn. Aceste valori sunt comparate in
figura 3.192 cu oxigenul rezidual in ppm pentru dezoxidarea cu Si/Mn la
aceleasi concentratii de Mn si Si.
saturat cu Al2O3 activitatea silicei
este 0,27 la 1650 0C, 0,17 la
1550 0C si scade posibil pana la]0,12 la 1500 0C.
Folosind aceste valori ale activitatii silicei, s-a calculat
echilibrul dezoxidarii pentru Al/Si/Mn. Aceste valori sunt comparate in
figura 3.192 cu oxigenul rezidual in ppm pentru dezoxidarea cu Si/Mn la
aceleasi concentratii de Mn si Si.
Cand se utilizeaza foarte putin Al pentru dezoxidare sau nu se utilizeaza deloc, Al existent in ferosiliciu formeaza produsul de dezoxidare care la echilibru poate fi Al2O3 solid, silicat de mangan lichid sau SiO2 solid. Evitarea obturarii duzelor la turnarea continua este posibila daca se obtin incluziuni lichide. Produsul de dezoxidare la echilibru este functie de continuturile de Al si Si asa cum se puteau vedea in figura 3.193. Asa cum reiese din aceasta figura chiar si la continuturi mici de Al in solutie vor rezulta incluziuni de alumina solide care pot obtura duzele.
Comparatie intre puterea de dezoxidare a Mn, Si si Al.
Pentru a aprecia comparativ puterea de dezoxidare a manganului, siliciului si aluminiului se poate retine ca concentratiile reziduale de oxigen in otel, corespunzatoare echilibrului cu 0,1% Mn, Si si Al sunt respectiv 0,175; 0,021 si 0,0028% la 1600 0C si de 0,12%; 0,009% si 0,00013% la 1500 0C.
4. Dezoxidarea cu vanadiu.
Vanadiul are o putere de dezoxidare comparabila cu cea a manganului. Reactia de dezoxidare a [%V]< 0,2% este:
![]() ;
; ![]() (3.962)
(3.962)
![]() (3.963)
(3.963)
pentru care:
![]() (3.964)
(3.964)
Fig. 3.192. Echilibrul
dezoxidarii cu Si/Mn comparat cu Al/Si/Mn pentru produsele dezoxidate
saturate cu Al2O3.
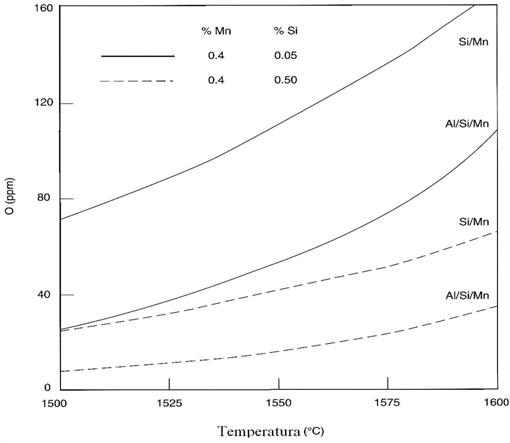
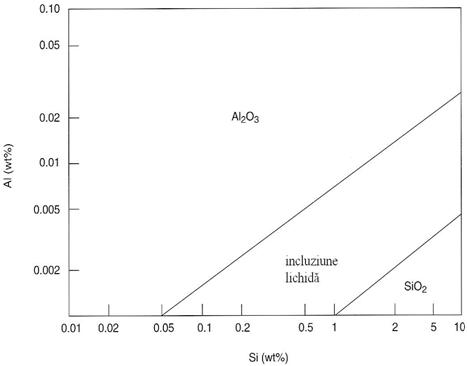
Fig.3.193. Echilibrul
incluziunilor pentru un otel Fe-Al-Si-1,0% Mn la 1600 C.
Peste 0,2% V produsul de dezoxidare este V2O3, obtinut conform reactiei:
![]() ; (3.965)
; (3.965)
![]() ;
; ![]()
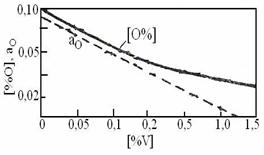
Continutul de oxigen in echilibru cu vanadiul la 1600 0C este prezentat in figura 3.194.
Fig. 3.194. Echilibrul O
- V in otel la 16000C(dupa Dastur si Chipman) Fig. 3.195. Echilibrul
[O] - [Ti] in otel.
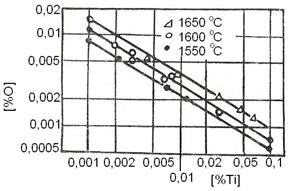
5. Dezoxidarea cu titan
Titanul este un dezoxidant puternic, comparabil cu aluminiul. Daca dezoxidarea se face numai cu titan, la un continut de titan sub 0,05 % se formeaza un spinel titanomagnetitic:
![]() (3.966)
(3.966)
La continuturi mari de titan (0,1.0,5) se formeaza o faza foarte bogata in TiO2 (rutil):
![]() . (3.967)
. (3.967)
Unii cercetatori au identificat in produsii de reactie si oxizii Ti3O5, Ti2O3 si TiO.
Calmarea otelului se realizeaza la circa 0,15 % Ti, de aceea pentru a se evita formarea oxizilor inferiori, solubili in fier, la dezoxidare se limiteaza continutul de titan la 0,16.0,2 %. In figura 3.195 este redat echilibrul oxigen-titan in fierul lichid.
6. Dezoxidarea cu zirconiu.
Zirconiul este un dezoxidant puternic. Reactia de dezoxidare este:
![]() (3.968)
(3.968)
![]() ;
; ![]()
7. Dezoxidarea combinata
Aceasta metoda de dezoxidare este cea mai utilizata pentru dezoxidarea otelurilor calmate nealiate si aliate. Cel mai frecvent se efectueaza cu Mn+Si+Al. Elementele dezoxidante se adauga in succesiunea cresterii puterii lor dezoxidante sau concomitent, sub forma de aliaj complex, continand cele trei elemente. In figura 3.196 este redata comparatia intre dezoxidarea separata cu Mn, Si si Al si dezoxidarea combinata cu toate trei elementele. Este evidenta eficienta dezoxidarii combinate. Aceasta se explica prin activitatea subunitara a MnO, SiO2 si Al2O3in produsii de dezoxidare, care sunt aluminosilicati de mangan si fier.
Echilibrul siliciului si titanul in otelul dezoxidat cu Al
Cand otelul s-a dezoxidat cu aluminiu si de asemenea contine siliciu si titan echilibru zgura- metal s-a stabilit pentru aceste elemente in conformitate cu reactiile:
![]()
![]()
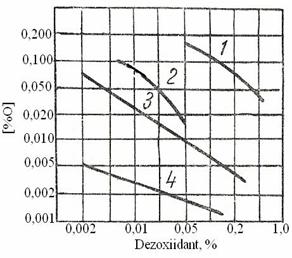

Fig. 3.198. Distribuirea
siliciului si titanului dupa degazare.
Dezoxidarea cu aliaje complexe continand calciu
Calciul este un dezoxidant foarte puternic. Reactia de dezoxidare cu calciu este:
![]() (3.970)
(3.970)
![]() (3.971)
(3.971)
Datorita faptului ca fierbe la 1421 0C si are presiune mare de vapori la 1600 0C (temperatura otelului lichid), calciul nu poate fi folosit ca atare, ci numai sub forma de aliaje cu circa 30% Ca: CaSi, CaAl, CaSiAl (30% Ca +38% Si +21% Al) etc. si dupa o predezoxidare cu dezoxidanti mai slabi.
O mentine speciala merita dezoxidarea cu Al si SiCa care conduce la obtinerea unor produsi de dezoxidare globulari, fin dispersati si usor decantabili, ceea ce face ca otelul sa aiba un continut foarte scazut de oxigen [61].
Rezultate foarte bune se obtin la dezoxidarea cu feroaliajul complex CaSiAl, care permite obtinerea unui continut foarte scazut de oxigen in otel (circa 24 ppm la un consum de 2 kg Ca/t de otel) si a unor incluziuni globulare usor decantabile, cu efecte remarcabile asupra calitatii otelului. Pentru reactia:
![]() (3.972)
(3.972)
![]() (3.973)
(3.973)
Dezoxidarea cu aliaje complexe care contin calciu si bariu
Pe langa reactia de dezoxidare cu calciu (3.970) are loc si reactia de dezoxidare cu bariu:
![]() (3.974)
(3.974)
![]() (3.975)
(3.975)
8. Dezoxidarea cu elemente din grupa lantanidelor.
Lantanidele au afinitate foarte mare fata de oxigen si de aceea sunt dezoxidanti puternici, fapt dovedit de datele din tabela 3.62.
Avantaje si dezavantajele dezoxidarii prin precipitare
Avantajele sunt:
- durata mica a operatiunii de dezoxidare in comparatie cu dezoxidarea prin extractie;
- posibilitatea obtinerii unui continut foarte redus de oxigen in otel.
Dezavantajele metodei sunt:
- consum important de dezoxidanti, care conduce la cresterea pretului otelului;
- impurificarea otelului cu produse de dezoxidare (incluziuni nemetalice).
Cu toate acestea este principala metoda de dezoxidare utilizata pentru oteluri.
1.4. Dezoxidarea in vid.
Dezoxidarea se realizeaza pe doua cai:
disocierea oxidului feros prin reactia:![]() ; (3.976)
; (3.976)
volatilizarea oxizilor dizolvati in otel ![]() ; (3.976)
; (3.976)
cu ajutorul carbonului ![]() . (3.977)
. (3.977)
Primele nu au importanta practica pentru elaborarea otelului.
Fig. 7.28. Echilibrul O
- C functie de presiune.
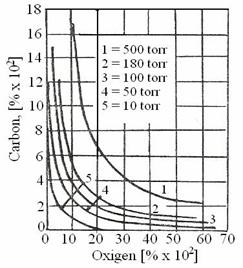
Dezoxidarea cu carbon in vid este posibila datorita faptului ca scaderea presiunii mareste puterea de dezoxidare a carbonului (scade continutul de oxigen in echilibru cu carbonul) conform relatiei 3.787 din care rezulta:
![]() (3.978)
(3.978)
Grafic influenta scaderii presiunii asupra echilibrului O - C este redata in figura 7.28 3.199. la presiuni suficient de scazute, puterea de dezoxidare a carbonului o intrece pe cea a aluminiului si a altor dezoxidanti puternici. Astfel, pentru PCO =0,1 atm la un continut de 0,003% carbonul este un dezoxidant mai puternic decat siliciul pentru aceeasi concentratie, la PCO=0,01 atm la continuturi de peste 0,15% carbonul devine dezoxidant mai puternic decat aluminiul la aceeasi concentratie la care numai Ca si Mg au putere de dezoxidare mai mare decat carbonul
Avantajele si dezavantajele dezoxidarii in vid.
Avantajul principal il constituie puritatea avansata a otelului, deoarece produsul de dezoxidare este un gaz, oxidul de carbon, care se degaja din otel. Pentru a accentua cat mai mult acest avantaj este indicata tratarea in vid a otelului inaintea dezoxidarii prin precipitare si alierea otelului. In acest fel oxigenul dizolvat in otel se elimina in cea mai mare parte sub forma de CO, iar cand se adauga feroaliajele pentru dezoxidare si aliere, otelul este deja aproape dezoxidat si deci se formeaza o cantitate foarte mica de incluziuni nemetalice, facandu-se totodata si economie de feroaliaje.
Daca otelul este tratat in vid dupa ce a fost dezoxidat prin precipitare, carbonul actioneaza in principal asupra oxizilor deja formati, care fiind stabili, se reduc mai greu cu carbon si deci otelul ramane cu puritate mica.
Dezavantajele dezoxidarii in vid sunt legate de cheltuielile de investitie si exploatare a instalatiilor de vid si de necesitatea supraincalzirii otelului pentru a acoperii pierderile de caldura in timpul vidarii.
2. Termodinamica desulfurarii fontei si otelului
Sulful este un element daunator calitatii fontei si otelului, de aceea el este limitat la 0.05 - 0,06% in fonte si la 0,03 - 0,05 % la otelurile obisnuite si la 0,005 - 0,01% la otelurile speciale. Numai in otelurile pentru prelucrare pe strunguri automate continutul de sulf este de 0,1 - 0,3% pentru asigurarea unei prelucrabilitati superioare prin aschiere.
Efectul daunator al sulfului in oteluri se manifesta prin fragilitatea la rosu (craparea otelului in timpul deformarii plastice la cald si susceptibilitatea mai mare a otelului la supraincalzire) si se datoreaza sulfurii de fier care formeaza cu fierul un eutectic cu temperatura de topire de 985 0C. In cursul solidificarii otelului, acest eutectic sau oxisulfurile se separa la limitele grauntilor si cand otelul este incalzit in vederea deformarii plastice prin laminare, forjare sau extruziune, se topeste, slabind coeziunea grauntilor cristalini si determinand aparitia crapaturilor. Fragilitatea la rosu apare in intervalul de 820 - 12000C.
Fig. 3.200.
Influenta diferitelor elemente asupra coeficientului de activitate al
sulfului.
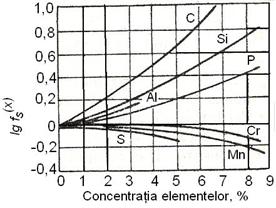
Solubilitatea sulfului in fierul lichid este nelimitata. Solubilitatea sulfului in fierul solid depinde de prezenta diferitelor elemente dizolvate in fier. Acestea pot fi impartite in urmatoarele grupe:
elemente care micsoreaza solubilitatea sulfului si ii maresc astfel activitatea (C, Mn, Cu, Si, Al etc.) ;
elemente care ale caror sulfuri sunt mai putin stabile decat sulfura de fier,FeS; acestea nu influenteaza solubilitatea sulfului in fier decat prin diluarea solutiei (Ni, Co, W);
elemente care micsoreaza solubilitatea sulfului si ale caror sulfuri sunt mai stabile decat sulfura de fier, FeS (Mn, Ba, Ca, Na, Mg, La) si nu sunt solubile in fier. Acestea pot avea un rol important in desulfurarea aliajelor feroase.
Influenta diferitelor elemente asupra coeficientului de activitate al sulfului este redata in figura 3.200.
2.1. Desulfurarea minereurilor de fier
In minereurile de fier, sulful se afla in mod obisnuit sub forma de sulfuri (FeS2 pirita sau FeS pirotina). In prezent marea majoritate a minereurilor de fier se supun aglomerarii sau peletizarii inaintea introducerii lor in furnal.
In cursul aglomerarii are loc un proces de disociere si oxidare a sulfurilor de fier. Pirita disociaza usor (la 690 0C PS2 =1 atm) dupa reactia:
![]() ;
; ![]() , [J] (3.979)
, [J] (3.979)
apoi pirotina se oxideaza dupa reactia:
![]() ;
; ![]() , [J] (3.980)
, [J] (3.980)
Pe aceasta cale se indeparteaza circa 95% din sulful din minereurile de fier in timpul aglomerarii.
In furnal de asemenea are loc un proces de trecere a sulfului in faza gazoasa, prin reactiile:
![]() ;
; ![]() ,[J] (3.981)
,[J] (3.981)
![]() ;
; ![]() , [J] (3.982)
, [J] (3.982)
2.2.Termodinamica desulfurarii cu participarea zgurilor lichide
In furnale si in agregatele bazice pentru elaborarea otelului, desulfurarea se face cu participarea activa a zgurii, adica prin interactiunea fazelor lichide, otelul lichid si zgura lichida.
Forma de existenta si activitatea sulfului in topiturile feroase au fost tratate in capitolul 3.4.
In zgura sulful se gaseste sub forma de sufluri (MnS, CaS, FeS), sau dupa teoria ionica a zgurilor, sub forma de anioni (S2-). Solubilitatea sulfurilor in silicati este mare, ajungand la 20 - 30% la 1500 0C si la 40 - 50% la 16500C. In figura 3.201 este redata solubilitatea CaS in sistemele binare CaO - SiO2 si CaO - Al2O3.
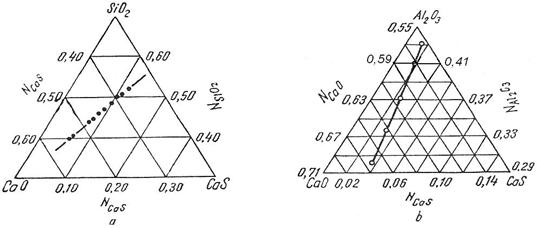
Fig. 3.201.
Solubilitatea CaS la 1500 C in Cao + SiO2 (a)
si CaO + Al2O3.
Capacitatea zgurii de a asimila sulfurile
Aceasta notiune exprima capacitatea zgurilor de a absorbi sulful din faza gazoasa cu anumite valori ale presiunii partiale ale oxigenului si sulfului. Ea se deduce pe baza relatiei:
![]() ; (3.983)
; (3.983)
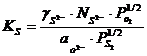 . (3.984)
. (3.984)
Dupa
Richardson si Fincham [52] capacitatea zgurii de a asimila sulfuri ![]() este data de
relatia:
este data de
relatia:
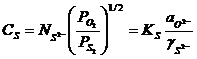 . (3.986)
. (3.986)
In scopuri practice, este mai comod sa se utilizeze expresia:
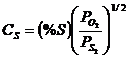 . (3.986)
. (3.986)
Valoarea concreta a indicelui ![]() depinde de compozitia zgurii. Ea creste cu
cresterea concentratiei oxizilor bazici (CaO, MgO) si scade cu
cresterea concentratiei de oxizi acizi (SiO2, P2O5).
In figura 3.203 este redata
capacitatea de asimilare a sulfurilor in cateva sisteme de silicati,
aluminati si fluoruri dupa Richardson [53].
depinde de compozitia zgurii. Ea creste cu
cresterea concentratiei oxizilor bazici (CaO, MgO) si scade cu
cresterea concentratiei de oxizi acizi (SiO2, P2O5).
In figura 3.203 este redata
capacitatea de asimilare a sulfurilor in cateva sisteme de silicati,
aluminati si fluoruri dupa Richardson [53].
Fig. 3.203. Capacitatea
de asimilare a sulfurilor in zguri de silicati, aluminati si
floruri la 1500 C: F - zgura
tipica de furnal la 1500 C; SMB - zgura tipica
de cuptor Siemens-Martin bazic; SMA - zgura tipica de cuptor
Siemens-Martin acid. Pentru zgura de tip CaO-Al2O3-CaF2
raportul molar Al2O3/CaF2 = 1,3 : 1,0.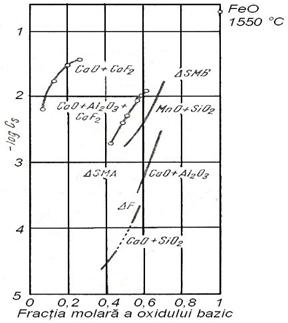
In figura 3.204 sunt trasate liniile valorilor egale ale ![]() in sistemul CaO-Al2O3-CaF2,
caracteristic zgurilor cu fluorura de calciu de tipul celor de rafinare a
otelului.
in sistemul CaO-Al2O3-CaF2,
caracteristic zgurilor cu fluorura de calciu de tipul celor de rafinare a
otelului.
Trebuie remarcat ca indicele ![]() nu reflecta
capacitatea de desulfurare a zgurilor in conditiile reale de
desfasurare a proceselor siderurgice prin interactiunea intre
zgura si baia metalica. De aceea, studiul echilibrului
reactiilor de desulfurare este preferabil sa se foloseasca o
forma modificata a indicelui
nu reflecta
capacitatea de desulfurare a zgurilor in conditiile reale de
desfasurare a proceselor siderurgice prin interactiunea intre
zgura si baia metalica. De aceea, studiul echilibrului
reactiilor de desulfurare este preferabil sa se foloseasca o
forma modificata a indicelui ![]() , bazata pe echilibrul reactiei:
, bazata pe echilibrul reactiei:
![]() ; (3.987)
; (3.987)
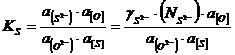 ; (3.988)
; (3.988)
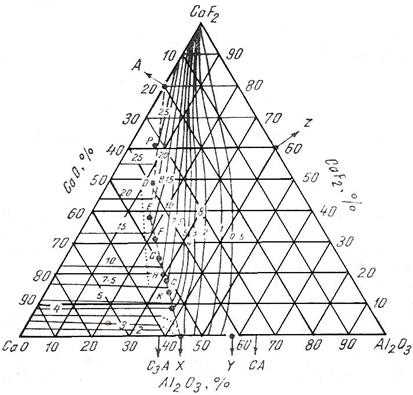
Fig. 3.204. Capacitatea
de asimilare a sulfurilor (Cs X 102) din sistemul
CaO+Al2O3+CaF2 la 1500 C.
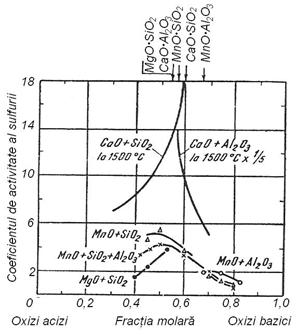
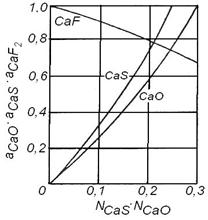
Fig. 3.205. Coeficientul de activitate a CaS in
diferite sisteme de zguri la 1650 C (in CaO+SiO2
si CaO+Al2O3 la 1500 C). In sistemul MnO+SiO2+Al2O3
raportul molar SiO2 : Al2O3 = 1 : 1. Fig. 3.206. Activitatea
CaO(S), CaF2(1) la 1500 C in zguri CaO+CaF2.
Curba pentru CaF2 este aceeasi in ambele sisteme.
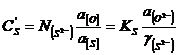 sau
sau ![]() . (3.989)
. (3.989)
Raportul de repartitie a sulfului este ![]() . (3.990)
. (3.990)
Activitatea sulfurilor in diferite sisteme de zguri este data in figurile 3.205 si 3.206.
2.3. Distributia sulfului intre zgura si baia metalica. Reactii de desulfurare
Urmarea interactiunii intre zgura si baia metalica este stabilizarea unui echilibru al distributiei sulfului intre aceste faze. Componentii zgurii, care au rolul cel mai important in acest proces, sunt CaO si MgO, care participa la reactii de desulfurare de tipul:
![]() ;
; ![]() ,
, ![]() (3.991),
(3.991),
![]() (3.992)
(3.992)
![]() ;
; ![]() . (3.993)
. (3.993)
Adoptand pentru analiza termodinamica reactia 3.991 se poate scrie in continuare:
![]() ; (3.993)
; (3.993)
![]() (3.994)
(3.994)
Expresia (3.994) permite o analiza termodinamica a procesului de desulfurare cu zgura. In principiu, se poate conchide ca reactia de desulfurare (trecerea sulfului din baia metalica in zgura) este favorizata de urmatorii factori:
temperatura nu prea inalta, deoarece reactia (3.991) este usor exoterma si KS scade cu temperatura;
zgura bazica (aCaO mare) si cu continut redus de FeO (aFeO mica).
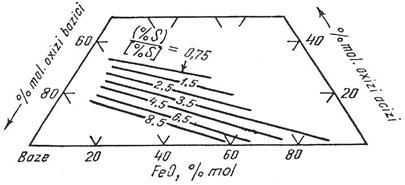
Modul in care compozitia chimica a zgurii se reflecta asupra raportului de repartitie a sulfului este redat in figurile (3.207) si (3.208).
Fig. 3.207.
Influenta bazicitatii zgurii si a continutului ei
de FeO asupra raportului de repartitie a sulfului intre zgura
si baia metalica in diferite procese siderurgice la 1600 C.
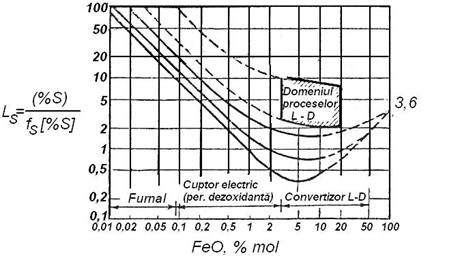
Fig. 3.208. Raportul de
repartitie al sulfului in zgurile de afinare de tip (CaO+MnO+MgO)-FeO-(SiO2+P2O5)
la 1600 C.
Se observa ca pana la 1% (mol) FeO, relatia intre LS si (%FeO) este lineara si deci se poate scrie:
![]() , (3.995)
, (3.995)
adica
raportul de repartitie a sulfului este invers proportional cu
concentratia molara a oxidului feros in zgura. In acest domeniu,
se incadreaza procesul de desulfurare in furnal si in cuptorul
electric in perioada dezoxidanta. La concentratii mari de FeO nu mai
exista o relatie univoca intre raportul de repartitie Ls
si continutul de FeO. In ansamblu rezulta ca la cuptoarele
pentru elaborarea otelului zgura de
afinare (oxidanta9 nu permite o desulfurare buna a otelului.
Valorile raportului de repartitie a sulfului in diferite agregate siderurgice
confirma aceasta ipoteza. Astfel la furnal, la care zgura
contine sub 1% FeO ti bazicitate de 0,8 - 1,2 raporul de repartitie al sulfului Ls
= 15 - 50, in timp ce la cuptorul
electric bazic, in perioada dezoxidanta cand zgura contine sub 1% FeO
si bazicitatea zgurii, ![]() , raportul de repartitie al sulfului,
, raportul de repartitie al sulfului, ![]() .
.
Influenta manganului asupra distributiei sulfului
In furnal si, in oarecare masura, in cuptoarele de elaborat otel, distributia sulfului este afectata si de reactia.
![]() ;
; ![]() , [J] (3.996)
, [J] (3.996)
![]() ; (3.997)
; (3.997)
![]() ; (3.998)
; (3.998)
Fig. 3.209. Raportul de
repartitie a sulfului functie de raportul [%Mn]/(%Mn)[54].
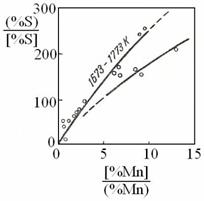
La elaborarea otelului [%Mn]/(%Mn) ~ 0,025, ceea ce
corespunde unei valori foarte mici a raportului Ls. De aceea,
reactia 3.996 are un apor foarte mic la desulfurarea otelului. La
ceasta contribuie si faptul ca reactia 3.996 este exoterma
si constanta de echilibru ![]() are valoare mica
(0,92) la 1600 0C.
are valoare mica
(0,92) la 1600 0C.
Darken si Larsen [54] au propus urmatoarea expresie pentru calculul raportului de repartitie a sulfului in functie de compozitie chimica a zgurii si de continutul de mangan al otelului:
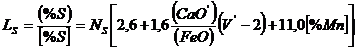 (3.999)
(3.999)
![]()
![]() ;
; ![]()
unde:
![]() este concentratia
totala a oxidului de calciu, iar
este concentratia
totala a oxidului de calciu, iar ![]() este concentratia
oxidului de calciu liber.
este concentratia
oxidului de calciu liber.
Toate concentratiile sunt in g-moli la 100 g zgura.
2.4. Interpretarea ionica a reactiei de desulfurare
Din punct de vedere al teoriei ionice, desulfurarea topiturilor feroase prin interactiune cu zgura este un proces electrochimic. La trecerea sulfului din baia metalica in zgura are loc procesul catodic:
![]() , (3.1000)
, (3.1000)
care conduce la incarcarea suprafetei baii metalice cu sarcini pozitive, iar a suprafetei zgurii, in contact cu ea - cu sarcini negative. Dublul strat electric de la interfata metal - zgura ar impiedica trecerea sulfului in zgura prin procesul daca nu ar avea loc in paralel si procese anodice, ca:
![]() (3.1001)
(3.1001)
![]() (3.1002)
(3.1002) ![]() (3.1003)
(3.1003)
care anuleaza potentialul electric creat de procesul 3.1000 la interfata zgura baie metalica.
Combinand procesele 3.1000 cu 3.3.1001 rezulta schema ionica a reactiei de desulfurare:
![]() ;
; ![]()
![]() (3.1004)
(3.1004)
S-a constatat experimental ca in baia metalica a cuptoarelor de elaborare a otelului este respectata relatia:
![]() (3.1005)
(3.1005)
Tinand seama ca produsul ![]() , rezulta ca la echilibru:
, rezulta ca la echilibru:
![]() . (3.1006)
. (3.1006)
Constanta de echilibru a reactiei (3.1004) este:
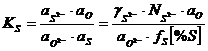 ;
; 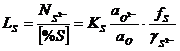 . (3.1007)
. (3.1007)
Din relatia (3.1007)
rezulta ca o desulfurare buna se poate realiza numai in
conditiile folosirii unei zguri in care activitatea anionilor de oxigen
este mare (zgura bazica) si continutul de FeO este mic,
deoarece ![]() si in virtutea
raportului de repartitie a oxigenului intre zgura si baie
metalica:
si in virtutea
raportului de repartitie a oxigenului intre zgura si baie
metalica:
![]() . (3.1008)
. (3.1008)
In zgurile acide, activitatea anionilor de oxigen este foarte redusa, datorita unor procese, cum ar fi:
![]() . (3.1009)
. (3.1009)
De aceea desulfurarea cu zguri acide nu este posibila
La fel ca si SiO2 se comporta si alti oxizi acizi sau amfoteri.
Teoria ionica a lui Flood, Forland si Grjotheim permite evaluarea capacitatii desulfurante a diferitilor oxizi bazici. Daca se noteaza cu K raportul global de echilibru al reactiei de desulfurare:
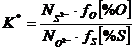 (3.1010)
(3.1010)
iar
cu ![]() etc., rapoartele de repartitie partiale la echilibru
ale reactiilor de desulfurare cu cate un oxid bazic, ca de exemplu:
etc., rapoartele de repartitie partiale la echilibru
ale reactiilor de desulfurare cu cate un oxid bazic, ca de exemplu:
![]() (3.1011)
(3.1011)
se obtine reactia:
![]() (3.1012)
(3.1012)
Pentru 1600 0C expresia 2.31 devine:
![]() (3.1013)
(3.1013)
Ulterior, pe baza datelor practice s-a dedus expresia:
![]() (3.1014)
(3.1014)
Pe baza acestor relatii a fost calculata puterea relativa de desulfurare a diferitilor cationi (tabelul 3.62).
Tabelul 3.62. Puterea relativa de desulfurare a oxizilor bazici
|
Cationul,i |
Ca2+ |
Fe2+ |
Mn2+ |
Mg2+ |
Na2+ |
|
log | |||||
|
| |||||
|
Puterea desulfuranta raportata la CaO |
Se remarca puterea foarte mare de desulfurare a oxidului de sodiu (Na2O)cunoscuta de altfel din experimentarile de desulfurare a fontei cu acest oxid. Dintre oxizii bazici obisnuiti in zguri, CaO este de departe cel mai puternic desulfurant, ceea ce explica dependenta neta a raportului de desulfurare de concentratia lui in zgura (fig. 3.210).
Fig. 3.210. Raportul de
repartitie a sulfului in functie de concentratia oxidului de
calciu excedentar in zgura.
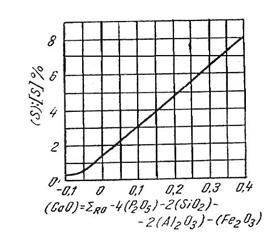
Se desprinde de asemenea regula ca, cu cat raza cationului este mai mare cu atat puterea lui de desulfurare este mai mare.
2.5. Desulfurarea in conditii reducatoare
Conditiile reducatoare din cuptoarele electrice cu arc in perioada dezoxidanta favorizeaza procesul de trecere a sulfului din baia metalica in zgura, deoarece le permit mentinerea unui continut scazut de FeO in zgura si in topitura metalica.
In furnal reactiile de desulfurare cu CaO sunt:
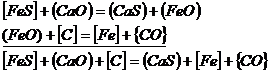
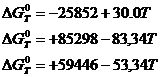
![]() (3.1015)
(3.1015)
sau:
![]() (3.1016)
(3.1016)
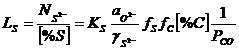 (3.1017)
(3.1017)
![]() ;
; ![]() ,[J] (3.1018)
,[J] (3.1018)
sau:
![]() (3.1019)
(3.1019)
Pentru zguri de furnal cu bazicitatea (CaO)/(SiO2) = 1,15 - 1,45 au fost deduse relatiile [27], valabile pentru 1500 0C:
![]() (3.1020)
(3.1020)
![]() (3.1021)
(3.1021)
in
care: ![]() ,
, ![]() este viscozitatea
zgurii, in Ns/m2, iar
este viscozitatea
zgurii, in Ns/m2, iar ![]() este tensiunea superficiala a zgurii, in mJ/m2.
este tensiunea superficiala a zgurii, in mJ/m2.
Relatia (3.1021) arata ca repartitia sulfului depinde nu numai de compozitia zgurii, ci si de proprietatile fizice ale acesteia.
In furnal desulfurarea este facilitata si de faptul ca siliciul si carbonul, aflate in concentratii mult mai mari decat in otel (circa 0,8 - 1,2 %Si si 3,8 - 4,2 %C), maresc substantial coeficientul de activitate al sulfului. Luand in considerare numai coeficientii de ordinul intai se obtine:
Pentru un
otel
cu 0,25% C, 0,25% Si, 0,50% Mn, 0,03% P si 0,03% S:
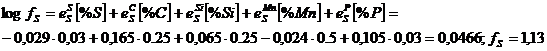
Pentru fonta cu 4,0 %C; 1,0 %Si; 1,0 %Mn; 0,2 %P si 0,05 %S:
![]() ;
; ![]()
Deci in fonta coeficientul de activitate al sulfului este de aproape cinci ori mai mare decat in otel, ceea ce mireste raportul de repartitie a sulfului (vezi relatia 3.1015).
In cuptorul electric, in perioada dezoxidanta, au loc reactiile:
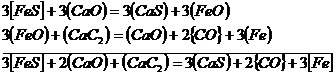
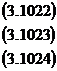
Aici coeficientul de repartitie creste atat prin scaderea continutului de oxigen in zgura si in otel, cat si prin cresterea bazicitatii.
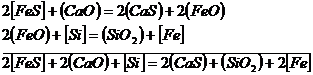
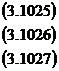
Din cele de mai sus se desprinde concluzia foarte importanta ca pentru o desulfurare buna este necesara mentinerea unui potential scazut de oxigen in zgura si in baia metalica. Acest lucru se realizeaza prin dezoxidarea zgurii si otelului cu elemente avand afinitate mare fata de oxigen (C, Mn, Si, Al etc).
2.6. Desulfurarea in afara agregatelor de elaborare
In ultimii ani se manifesta tot mai mult tendinta de a se realiza desulfurarea in afara furnalului si a cuptoarelor pentru elaborarea otelului, realizandu-se astfel importante economii de energie si materiale. Pentru desulfurare se folosesc in acest caz materiale desulfurante in stare solida (granule, pulberi etc.) cum sunt: CaO, CaC2, Na2CO3, Ca, Mg etc . In ultimul timp se prefera pulberile injectate in fonta sau otel cu ajutorul unei lanci, folosindu-se ca gaz purtator aeru, azotul la fonta sau argonul in otel.
Desulfurarea fontei in afara furnalului
Se poate realiza in instalatii rotative (tip Kalling) sau prin injectare. Se folosesc agenti desulfuranti, cum sunt CaO, CaC2, Na2O, Ca si Mg. In cazul utilizarii CaO, au loc reactiile:
![]() ;
; ![]() , [J] (3.1028)
, [J] (3.1028)
![]() ;
;![]() (3.1029)
(3.1029)
La 1300 0C (temperatura fontei in timpul
desulfurarii), ![]() , iar
, iar 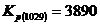 . Calculele arata [46] ca acestor constante le
corespund urmatoarele continuturi de sulf intr-o fonta cu 4,0
%C; 1 %Si; 1 %Mn; si 0,20 %P, fs
~5,0, iar fSi =12,0 (la PCO=1
atm. si aC= 1; aCaO =1; aCaS =1 este
circa 0,001 %S pentru relatia (3.1028) si de 1,5 10-5 %S.
. Calculele arata [46] ca acestor constante le
corespund urmatoarele continuturi de sulf intr-o fonta cu 4,0
%C; 1 %Si; 1 %Mn; si 0,20 %P, fs
~5,0, iar fSi =12,0 (la PCO=1
atm. si aC= 1; aCaO =1; aCaS =1 este
circa 0,001 %S pentru relatia (3.1028) si de 1,5 10-5 %S.
In practica desulfurarii fontei cu CaO solid, adeseori se obtin continuturi de sulf apropiate de 0,005 %, uneori chiar mai mici.
La desulfurarea cu Na2O au loc reactiile:
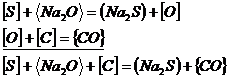 (3.1030)
(3.1030)
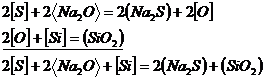 (3.1031)
(3.1031)
Na2O se introduce de regula sub forma de Na2CO3.
O mare eficienta are desulfurarea cu CaC2 dupa reactia:
![]() ;
; ![]() , [J] (3.1032)
, [J] (3.1032)
![]() (3.1033)
(3.1033)
Desulfurarea otelului prin injectie de pulberi continand CaO, BaO, Ca, Mg, Ba, Lantanidele (La, Ce, Nd, Pr) au mare eficienta, dar numai daca otelul este in prealabil bine dezoxidat, pentru a i se cobori potentialul de oxigen. In majoritatea pulberilor folosite pentru injectie in otel, elementul desulfurant este calciul sau magneziul, care au o foarte mare afinitate fata de sulf, ceea ce reiese din datele de mai jos privind reactiile de desulfurare:
![]() (3.1034)
(3.1034)
![]() (3.1035)
(3.1035)
![]() (3.1036)
(3.1036)
![]() (3.1037)
(3.1037)
![]() (3.1038)
(3.1038)
Pe langa faptul ca au afinitate mare fata de sulf, calciul si magneziul mai au proprietatea de a fi foarte putin solubile in otel (0,02.0,03%) si de a avea temperatura joasa de fierbere, ceea ce face ca ele sa fie in stare de vapori la temperatura de 1600 0C la care se afla otelul in momentul injectarii lor. Ajungand repede la saturatie, activitatea lor in fonta si otel este practic egala cu unu.
Temperatura de fierbere a calciului este de 1491 0C, iar a magneziului de 1090 0C.
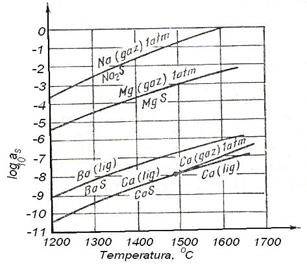
Calculele arata [57] ca prin injectarea de Ca sau Mg se poate ajunge la concentratii foarte mici de sulf in fonta si in otel (0,001 %in fonta si 0,004% in otel), cu conditia ca potentialul de oxigen al baii metalice sa fie foarte mic (0,002%). In figura 3.210 este redata puterea de desulfurare a Ca, Ba, Mg si Na in functie de temperatura. Ea scade cu cresterea temperaturii la echilibrul cu metalul desulfurant (aS creste cu temperatura).
Fig. 3.210. Activitatea
sulfului in fonta sau otel in prezenta metalului desulfurat
si a sulfurilor in stare pura (aS [%S] in otel si aS
5[%S] in fonta).
Se observa ca la temperatura de 1600 0C, log aS = 0 pentru desulfurarea cu natriu, ceea ce inseamna ca Na nu poate servi drept desulfurant pentru otel.
Alte studii [10,11] au aratat ca la desulfurarea
cu Ca, formarea fazei lichide nemetalice este posibila numai la
concentratii mari de oxigen si sulf in otel si la
continut redus de calciu. La un continut de 0,03.0,05% S in otel
se formeaza CaS solid, dar numai daca otelul contine sub
0,001%O, iar concentratia calciului se afla la limita de solubilitate
(0,01.0,02%). La continuturi mai mari de oxigen si mai mici de
calciu, acesta actioneaza ca dezoxidant si se formeaza
solutie solida pe baza de CaO. Cand ![]() , calciul nu poate
reactiona cu sulful in otelul lichid. Acest lucru se explica
prin faptul ca in conditiile concrete din otelul lichid, calciul
are afinitate mai mare fata de oxigen decat fata de sulf
si deci cand otelul contine mult oxigen, calciul (si
magneziul) se consuma cu acesta:
, calciul nu poate
reactiona cu sulful in otelul lichid. Acest lucru se explica
prin faptul ca in conditiile concrete din otelul lichid, calciul
are afinitate mai mare fata de oxigen decat fata de sulf
si deci cand otelul contine mult oxigen, calciul (si
magneziul) se consuma cu acesta:
![]() (3.1039)
(3.1039)
![]() (3.1040)
(3.1040)
Conditiile desulfurarii cu Ca si Mg in
prezenta oxigenului sunt ilustrate in fig. 3.211, in care este redat
echilibrul ![]() Cu cat raportul
Cu cat raportul ![]() este mai mic, cu atat puterea de desulfurare a metalului este
mai mare.
este mai mic, cu atat puterea de desulfurare a metalului este
mai mare.
Faptul ca atat Ca cat si Mg trec in vapori si ca presiunea lor de vapori este mare (fig.3.212) face ca eficacitatea desulfurarii sa fie mare, datorita barbotarii otelului sau fontei cu bulele de calciu sau de magneziu. Cu toate acestea se pare ca procesul se desfasoara in regim de difuziune, ceea ce inseamna ca transferul de masa este lent.
Este posibila desulfurarea otelului dezoxidat cu aluminiu in oala sau in cuptorul oala pana la mai putin de 20 ppm, folosind CaO din zgura bazica.
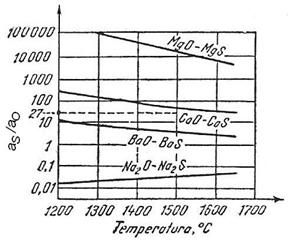
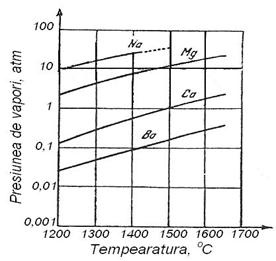
Fig. 3.211.
Conditiile de desulfurare cu Mg, Ca, Ba si Na in prezenta
oxigenului la 1600 C. Fig. 3.212. Presiunea de
vapori a Ca, Mg, Ba si Na in functie de temperatura.
Reactia chimica poate fi scrisa astfel:
![]() (3.1041)
(3.1041)
Raportul de repartitie al sulfului la echilibru se poate calcula din termodinamica reactiei:
![]()
![]() (2.1042)
(2.1042)
pentru care raportul de echilibru este:
![]() (3.1043)
(3.1043)
Valoarea lui KSA pentru CaO-Al2O3 si CaO-Al2O3-SiO2-MgO este aratata in figura 3.213.
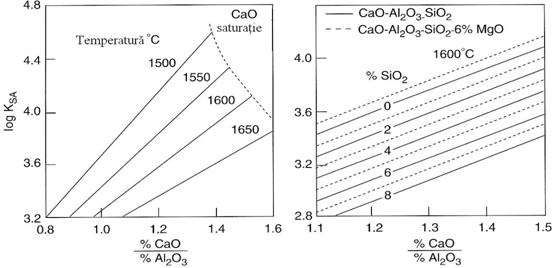
Fig. 3.213.
Influenta temperaturii si compozitiei zgurii asupra
echilibrului KSA pentru silicoaluminatul de calciu si
magneziu topit.
Raportul de distributie al sulfului este aratat in fig. 3.214 si 3.215 pentru continuturi de aluminiu fixate. Din date prezentate si din bilantul masic pentru sulf este posibil sa se estimeze continutul de sulf final la echilibru.
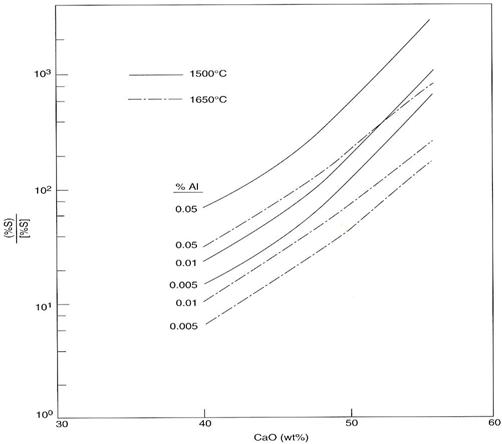
Fig. 3.214.
Distributia sulfului pentru zguri continand CaO-Al2O3
la 1600 C.
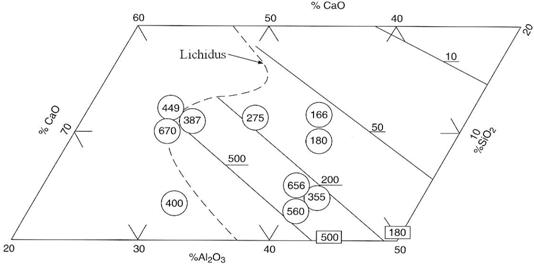
Fig. 3.215.
Distributia sulfului intre zguri de tipul CaO-Al2O3-SiO2
si otel cu 0,03%Al, la 1600 C.
Zgura va absorbi sulf sub forma de CaS micsorand cantitatea de CaO dizolvat si micsorand KSA. Solubilitatea CaS este data in figura 3.216.
Otelul dezoxidat cu siliciu are dificultati la desulfurare deoarece potentialul de oxigen este semnificativ mai mare decat in otelul dezoxidat cu aluminiu. Pentru aceste oteluri desulfurarea este limitata la 10-20%.
Fig. 3.216.
Solubilitatea CaS din aluminatul de calciu topit functie de raportul %CaO / %Al2O3.
Carbura de calciu este un desulfurant eficient deoarece micsoreaza potentialul de oxigen si rezulta CaO care poate participa la desulfurare.
Desulfurarea este controlata de transferul de masa in faza lichida. Desi raportul de distributie al sulfului este mare transferul de masa al sulfului in metal este principalul proces care controleaza viteza de desulfurare. Pentru acest caz viteza de desulfurare este de urmatoarele relatii:
![]() (3.1044)
(3.1044)
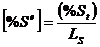 (3.1045)
(3.1045)
![]() (3,1046)
(3,1046)
Ecuatiile de mai sus pot fi rezolvate si viteza este data prin:
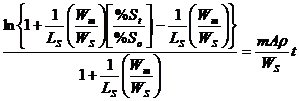 (3.1047)
(3.1047)
unde m- coeficientul de transfer de masa; A - aria suprafetei; Wm- greutatea (masa) metalului; WS - greutatea (masa) otelului; ρ - densitatea otelului; LS - raportul de repartitie (distributie) al sulfului; (%St) - continutul de sulf al zgurii; [%St] - continutul de sulf al metalului; [%Se] - Continutul de sulf la echilibru al metalului; [%So] - continutul de sulf initial al metalului.
Desulfurarea creste cu viteza de agitate, care creste m si mai important pe A, cu conditia amestecarii zgura-metal, creste valoarea lui LS si foarte mult volumul zgurii.
S-a constatat ca 90% desulfurare poate fi realizata in 10-15 minute de amestecare intensa.
Tratamentul cu calciu al otelului
Calciul este uzual folosit in metalurgia in oala sub forma de Ca sau fir cu miez de SiCa sau prin injectie de CaSi pulbere.
Calciul este un reactant puternic si poate dezoxida, desulfura otelul si modifica incluziunile nemetalice oxidice sau sulfidice. El poate fi utilizat numai la dezoxidarea otelului dar este prea scump pentru a fi utilizat ca dezoxidant.
Deoarece scopul injectarii calciului in baia de otel este transformarea incluziunilor solide de Al2O3 in aluminati de calciu lichizi pentru prevenirea obturarii duzelor la turnarea cu Al2O3, este necesar sa stim in ce conditii calciul va reactiona cu incluziunile sau simplu cu sulful. Exista numeroase calcule termodinamice de predictie a conditiilor pentru modificarea incluziunilor de Al2O3. conditiile pot fi estimate pe baza proprietatilor termodinamice ale incluziunilor insasi.
Luand in considerare echilibrul urmatoarei reactii de la tratare otelului cu calciu:
![]() (3.1048)
(3.1048)
unde CaS s-a format prin reactia dintre calciu si sulf, (Al2O3) este o incluziune bogata in alumina cum ar fi Al2O3, CaO Al2O3 etc iar (CaO) reprezinta o incluziune bogata in CaO.
Rezultatele
acestor calcule sunt prezentate in figura 3.217 in care stabilitatea
incluziunilor este data ca o functie a continuturilor de Al
si S. Sub curba CA ![]() este oxid stabil iar
sub curba C12A7 lichid, sub forma de
aluminat de calciu lichid.
este oxid stabil iar
sub curba C12A7 lichid, sub forma de
aluminat de calciu lichid.
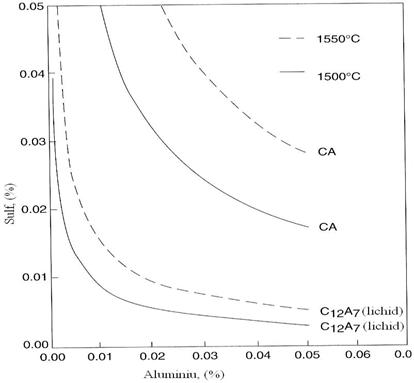
Fig. 3.217.
Variatia echilibrului CaS (aCaS = 0,74) si C12A7
sau CA in functie de %Al si %S la 1550 si 1500 C.
De exemplu, daca calciul este adaugat intr-un otel care contine 0,04%Al si 0,015 %S incluziunea de alumina va fi transformata in aluminat de calciu solid si calciul va reactiona cu formarea de CaS. Aceste incluziuni vor obtura duzele la turnare.
Pentru modificarea efectiva a incluziunilor, continutul de sulf va trebui sa fie sub 0,01 % S pentru 0,04 %Al in otel.
Calciul de asemenea ajuta la eliminarea incluziunilor sub forma de MnS care se formeaza in timpul solidificarii. Pentru un otel cu continut scazut de sulf care contine incluziuni de aluminati de calciu lichizi, mult sulf remanent va fi absorbit in timpul racirii si solidificarii din aceste incluziuni care sunt desulfurati excelenti. De asemenea daca un anumit calciu remanent dizolvat , desi unii autori cred ca acesta va fi foarte mic, va reactiona cu sulful din incluziuni.
Rezultatul este un duplex continand incluziuni de aluminati de calciu lichid inconjurasi de CaS(MnS. Aceasta este preferabila MnS care poate cauza ruperea fragila.
2.7. Desulfurarea in vid
Din numeroase date experimentale rezulta ca in vid desulfurarea este mai accentuata, fapt explicabil, pentru ca reactiile de desulfurare ca (3.1015), avand loc cu crestere de volum sunt favorizate de scaderea presiunii in sistem.
In cazul otelului, produsul ![]() scade cu scaderea
presiunii, potentialul de oxigen in otel scade si in
consecinta desulfurarea se imbunatateste in
virtutea relatiei (3.106):
scade cu scaderea
presiunii, potentialul de oxigen in otel scade si in
consecinta desulfurarea se imbunatateste in
virtutea relatiei (3.106):
![]()
In plus, s-a constata ca in vid sulful se elimina si sub forma compusilor volatili CS, CS2, SiS2 si SiS, a carorpresiune de vapori este data in tabelul 3.63.
Tabelul 3.63. Presiunea de vapori a unor compusi
|
Compusul |
Presiunea de vapori, atm |
|
|
La 1280 0C |
La 1600 0C |
|
|
S |
fs |
|
|
CS |
fs |
|
|
CS2 |
fs |
|
|
SiS2 |
fs |
|
|
SiS |
fs |
|
Se observa ca SiS are cea mai mare presiune de vapori. Reactiile de formare a SiS2 si SiS:
![]() (3.1049)
(3.1049)
![]() (3.1050)
(3.1050)
au loc la suprafata topiturii metalice, unde sulfu ocupa 75 - 100 % din stratul de absorbtie, datorita tensoactivitatii foarte mari pe care o manifesta.
3. Mecanismul si cinetica desulfurarii
Mecanismul procesului de desulfurare cuprinde urmatoarele etape: transportul sulfului spre limita de separare metal-zgura, trecerea sulfului peste limita de separare si redistribuirea sulfului in zona.
Pana in prezent nu exista un punct de vedere unanim cu privire la etapa limitativa a procesului de desulfurare. Unii cercetatori considera ca etapa limitativa este trecerea sulfului peste limita de separare metal-zgura. Altii considera ca viteza procesului de desulfurare in ansamblu este limitata de reactia chimica care are loc la limita de separare metal-zgura, sau ca in cazul zgurilor bazice etapa limitativa este difuzia sulfului.
Daca se porneste de la premisa ca etapa limitativa a desulfurarii este difuzia sulfului in zgura (la zgurile bazice), viteza de desulfurare poate fi exprimata astfel:
![]() (3.1051)
(3.1051)
unde:
![]() este viteza
globala de desulfurare;
este viteza
globala de desulfurare; ![]() este coeficientul de
difuzie al sulfului in zgura;
este coeficientul de
difuzie al sulfului in zgura; ![]() este aria
suprafetei de contact dintre baia metalica si zgura;
este aria
suprafetei de contact dintre baia metalica si zgura; ![]() este grosimea
stratului de zgura, in care are loc difuzia moleculara;
este grosimea
stratului de zgura, in care are loc difuzia moleculara; ![]() concentratia
medie a sulfului in stratul superficial ti in interior. Daca
concentratia
medie a sulfului in stratul superficial ti in interior. Daca 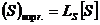 atunci:
atunci:
![]() (3.1052)
(3.1052)
De aici rezulta urmatoarele:
la inceput, cand ![]() poate fi neglijat
si deci reactia de desulfurare va fi de ordinul unu in raport cu
continutul de sulf in baia metalica;
poate fi neglijat
si deci reactia de desulfurare va fi de ordinul unu in raport cu
continutul de sulf in baia metalica;
deoarece viteza de desulfurare este direct proportionala
cu ![]() si invers
proportionala cu
si invers
proportionala cu ![]() , o amestecare buna a metalului cu zgura
mareste viteza de desulfurare;
, o amestecare buna a metalului cu zgura
mareste viteza de desulfurare;
viteza de desulfurare mai este direct proportionala cu ![]() , ceea ce inseamna ca desulfurarea decurge cu atat
mai rapid, cu cat zgura are o putere de desulfurare mai mare.
, ceea ce inseamna ca desulfurarea decurge cu atat
mai rapid, cu cat zgura are o putere de desulfurare mai mare.
Aceste concluzii au fost confirmate prin numeroase date
experimentale obtinute in laborator si industriale, ceea ce
arata ca desulfurarea decurge in regim de difuziune. Astfel, s-a
constatat ca raportul de repartitie ![]() depinde de
viscozitatea zgurii si de temperatura. Din practica furnalelor se
cunoaste ca la un mers fierbinte, desulfurarea se realizeaza mai
eficient datorita in buna parte micsorarii
viscozitatii zgurii.
depinde de
viscozitatea zgurii si de temperatura. Din practica furnalelor se
cunoaste ca la un mers fierbinte, desulfurarea se realizeaza mai
eficient datorita in buna parte micsorarii
viscozitatii zgurii.
In unele cazuri (la adancimi mari ale baii metalice), desulfurarea poate fi limitata si de difuzia sulfului prin baia metalica.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |