
FUNCTIA GENELOR (EXPRESIA INFORMATIEI EREDITARE)
1. CONCEPTIA CLASICA DESPRE FUNCTIA GENEI
1.1. Gena - unitate de functie si mutatie
Gregor Mendel (1865) a fost primul care a intuit ca "factorii ereditari" (notiunea de factor ereditar a fost inlocuita ulterior cu cea de gena) se asociaza in perechi determinand caracterele indivizilor. Genetica clasica, mendeliana este concentrata in axioma o gena - un caracter, demonstrabila prin faptul ca o modificare a genei produce modificarea caracterului determinat de gena. Astfel in toate studiile de genetica clasica, gena era considerata unitatea de functie si de mutatie.
Relatia o gena - un caracter este insa mult mai complexa. Astfel s-a observat ca, in afara caracterelor monogenice, produse de o singura pereche de gene alele, exista un numar mare de caractere poligenice sau multifactoriale, la realizarea carora participa mai multe gene nealele influentate de factorii de mediu. Alteori, o gena poate interveni in determinismul mai multor caractere, fenomen numit pleiotropie. De asemenea, mutatii ale unor gene diferite se pot manifesta identic sau asemanator, fenomen numit heterogenitate genetica.
1.2. Poligenia
Numeroase caractere fenotipice sunt rezultatul actiunii mai multor gene nelalele care au efecte cantitative, mici si cumulative; fenomenul este numit poligenie, iar fiecare gena determina, de fapt, o parte din caracter. Numarul genelor care participa la realizarea caracterului nu este cunoscut si variaza de la o persoana la alta (distributie de tip gaussian).
Genele care produc caracterul actioneaza independent unele de altele, iar expresia lor fenotipica este influentata frecvent de factori de mediu; caracterele rezultate din actiunea combinata a factorilor genetici si de mediu se numesc multifactoriale.
1.3. Pleiotropia
Pleiotropia reprezinta fenomenul in care o singura gena dominanta sau o pereche de gene recesive produc simultan mai multe caractere diferite si necorelate. In patologia umana sunt descrise numeroase cazuri de pleiotropie, un exemplu fiind sindromul Marfan caracterizat prin modificari scheletice, modificari oculare si afectare cardiovasculara. Toate aceste modificari sunt rezultatul mutatiei unei singure gene. Se stie astazi ca aceste manifestari au un mecanism comun - mutatia genei care codifica o componenta majora a tesutului conjunctiv (fibrilina); in acest caz pleiotropia este relationala.
Un alt exemplu este sindromul Laurence-Moon-Bardet-Biedl, caracterizat prin polidactilie, surditate, obezitate, hipogonadism, retinita pigmentara si retard mental. Intre diferitele semne, cauzate de mutatia recesiva a unei singure perechi de gene alele, nu exista o legatura evidenta, pleiotropia fiind, in acest caz, este nerelationala.
1. Heterogenitatea genetica
Heterogenitatea genetica reprezinta situatia in care aceeasi boala este determinata independent de mutatii genice ale unor loci diferiti; cu alte cuvinte, aceeasi boala este determinata de mutatii ale unor gene diferite. De exemplu, distrofia musculara (miopatie determinata genetic, caracterizata prin slabiciune musculara progresiva) este prezenta sub mai multe forme, diferite prin modul de transmitere, varsta de debut si severitatea bolii (vezi Boli monogenice, vol. II).
1.5. Relatiile genei
Expresia fenotipica a unei gene poate depinde de interactiunea cu gena alela, de influenta altor gene, la care se poate adauga actiunea mediului.
a.) Relatiile dintre genele alele
Genele alele sunt situate pe loci omologi; la homozigoti sunt identice, iar la heterozigoti diferite. La heterozigoti, manifestarea fenotipica a genelor alele depinde de relatiile dintre ele. Atunci cand se manifesta fenotipic numai una dintre genele alele, gena si caracterul respectiv se numesc dominante si se noteaza cu majuscule. Gena care nu se exprima in aceasta situatie se numeste recesiva si se noteaza cu litere mici.
In cazul genelor, notiunile de dominanta si recesivitate se refera numai la expresia lor fenotipica, deoarece la nivel molecular se manifesta (codifica o proteina) de obicei ambele gene.
Dominanta poate fi completa, atunci cand fenotipul heterozigotului este identic cu al homozigotului pentru gena dominanta, sau incompleta, cand fenotipul heterozigotului este intermediar intre cel al homozigotilor. In patologia umana, un exemplu ilustrativ este anemia drepanocitara, boala autozomal recesiva, in care gena mutanta βs codifica hemoglobina S. Homozigotii pentru alela mutanta sufera de anemie severa, adesea fatala. Heterozigotii, la care se depisteaza atat HbA, cat si HbS, sunt sanatosi, dar in anumite conditii, cum ar fi expunerea la presiune scazuta de oxigen, pot manifesta semne clinice.
Codominanta este termenul aplicat situatiilor in care ambele alele ale unei perechi se exprima complet la heterozigoti; alelele sunt codominante una in raport cu cealalta, dar complet dominante fata de alte alele; de exemplu, alelele HLA, alelele A si B pentru grupul sanguin ABO, alelele Lutheran (Lua, Lub), alelele Duffy (Fya, Fyb).
b.) Relatiile dintre genele nealele
Expresia fenotipica a unei gene depinde de multe ori de actiunea altei gene (nealele), la care se poate adauga si efectul factorilor de mediu.
(1) Penetranta, notiune cantitativa, se defineste prin frecventa manifestarii fenotipice a unei gene mutante dominante la heterozigoti. O gena are penetranta completa atunci se cand toti purtatorii ei manifesta caracterul. Penetranta incompleta sau lipsa penetrantei (non-penetranta) se refera la situatia in care numai o parte din purtatorii genei mutante manifesta caracterul, dar o transmit la descendenti care o manifesta complet sau mai putin complet; gena a "sarit" astfel o generatie. Non-pentranta reprezinta, deci, situatia in care gena mutanta este mostenita, dar nu se exprima. Penetranta, ale carei cauze sunt inca neclare, poate fi influentata de varsta, sex sau de capacitatea diagnosticarii cu tehnici uzuale.
(2) Expresivitatea, notiune calitativa, reprezinta intensitatea manifestarii fenotipice a unei gene mutante si penetrante la bolnavi din aceeasi familie sau din familii diferite. Unele gene dominante se exprima diferit la persoane heterozigote; expresivitatea variabila se poate referi la severitate, varsta de debut a bolii, anomaliile manifeste.
Expresivitatea variabila poate fi explicata prin interactiunea genei mutante cu alte gene (numite gene modificatoare) sau cu factorii de mediu.
(3) Epistazia reprezinta fenomenul in care o gena, denumita epistatica, inhiba expresia fenotipica a unei alte gene nealele, denumita hipostatica.
Fenomenul este intalnit, de exemplu, la persoane normale cu fenotip Bombay. Un alt exemplu il constituie o forma de surditate. Dezvoltarea si functionarea normala a aparatului auditiv presupun actiunea a doua perechi de gene: una controleaza formarea cohleei, iar cealalta dezvoltarea nervului auditiv. Mutatia uneia dintre aceste gene produce surditate, chiar daca cealalta pereche de gene este normala.
c.) Relatiile genelor cu mediul
Activitatea genelor are loc in mediul celular, care la randul lui este influentat de factori ai mediului extern. Astfel, penetranta si expresivitatea multor gene depinde, intr-o oarecare masura, de factorii de mediu (fizici sau chimici).
2. CONCEPTIA ACTUALA DESPRE FUNCTIA GENEI
2.1. Genele controleaza sinteza proteinelor
Relatia "o gena → un caracter" nu poate explica modul de actiune al genelor in formarea, dezvoltarea si functia organismului. Relatia a devenit "o gena → o enzima" (1959). Aproape toate caracterele organismului sunt determinate de proteine. Astfel, relatia "o gena → o enzima" a devenit la scurt timp "o gena → un polipeptid", deoarece unele proteine sunt formate din doua sau mai multe polipeptide codificate fiecare de gene distincte.
Relatia "o gena → un polipeptid" nu este general valabila, deoarece unele gene codifica diferite tipuri de ARN. Astfel gena a fost definita ca un segment de ADN care codifica un produs functional. Genele care codifica proteine sunt numite si gene structurale. Genele structurale contin informatia codificata necesara pentru asamblarea intr-o anumita ordine a aminoacizilor in proteina.
Relatia "o gena → un polipeptid" este mult mai complexa. Exista situatii in care o gena poate produce mai multe polipeptide asemanatoare sau diferite. Acest fenomen este realizat prin diferite mecanisme care intervin in diferitele etape ale expresiei genei (vezi Reglarea expresiei genelor) .
Alteori, mai multe gene distincte pot codifica un singur polipeptid, fenomen observat in cazul proteinelor formate din regiuni diferite cum ar fi, de exemplu, imunoglobulinele.
2.2. Relatiile genei descrise de genetica clasica sunt mult mai evidente la nivel molecular; efectul mediului se manifesta prin reglarea cantitatii, uneori si calitatii sintezei proteinelor.
3. MECANISMELE MOLECULARE ALE EXPRESIEI GENICE
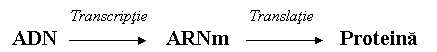 Expresia
informatiei genetice se realizeaza in toate celulele pe baza dogmei
centrale a geneticii:
Expresia
informatiei genetice se realizeaza in toate celulele pe baza dogmei
centrale a geneticii:
Prima etapa a expresiei informatiei genetice este sinteza ARN, cu ajutorul ARN-polimerazei, prin copierea informatiei din ADN. Ea are loc in nucleu si in mitocondrii si se numeste transcriptie.
A doua etapa este sinteza unui polipeptid, prin decodificarea (traducerea) informatiei din ARNm intr-o secventa specifica de aminoacizi. Procesul are loc in citoplasma, pe ribozomi, si se numeste translatie.
Numai un procent mic din ADN (ADN genic codant) este exprimat si produce o proteina; din acest ADN, diferitele tipuri de celule transcriu numai anumite segmente de ADN.
Prin controlul riguros al expresiei informatiei genetice este stabilit atat tipul de celula in care sintetizeaza proteina, cat si momentul, cantitatea si ritmul acestei sinteze.
3.1. TRANSCRIPTIA
Transcriptia este procesul prin care informatia genetica a unei gene este copiata intr-o molecula de ARN complementara si antiparalela, numita ARN mesager (ARNm). Acest proces are loc in nucleu.
Acidul ribonucleic (ARN) prezinta o serie de particularitati structurale.
ARN este alcatuit din ribonucleotide. Fiecare ribonucleotid este format din riboza (o pentoza care prezinta cate o grupare OH in pozitiile 2' si 3'), o baza azotata (adenina - A, guanina - G, citozina - C sau uracil - U) si un grup fosfat. Prin polimerizarea in sensul 5'→3' a ribonucleotidelor rezulta o monocatena, de obicei scurta, de ARN.
Se deosebesc mai multe tipuri de ARN, cu functii diferite:
ARNm sau mesager este codant, deoarece prin translatie determina sinteza unui polipeptid;
ARNt sau de transfer are rolul de a transporta aminoacizii la ribozomi;
ARNsn (mic nuclear) si ARNsno (mic nucleolar) intervin in procesarea intronilor, respectiv a ARNr.
In cele ce urmeaza, este prezentata sinteza ARNm catalizata de ARN-polimeraza II.
(1) Ribonucleotide activate. Prin ruperea legaturilor fosfat macroergice dintre fosfatii α si β ai ribonucleozid-trifosfatilor (adenozintrifosfat - ATP, guanozintrifosfat - GTP, citidintrifosfat - CTP si uridintrifosfat - UTP) se elibereaza ribonucleotidele (ribonucleozid-monofosfatii) si energia necesara polimerizarii acestora.
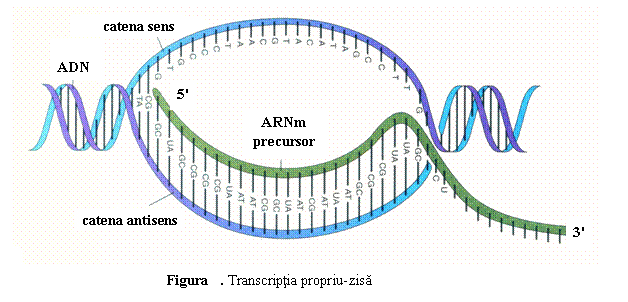
(2) Matrita este reprezentata de o singura catena de ADN. Numai una dintre cele doua catene ale ADN (3'→5') este transcrisa si serveste ca matrita pentru sinteza moleculei complementare si antiparalele de ARNm (5'→3'); catena transcrisa este denumita si catena antisens. Catena ADN netranscrisa, ale carei secvente nucleotidice sunt identice cu cele ale ARNm, este numita si catena sens (fig. 1). Cele doua catene ale ADN se vor separa astfel temporar si pe lungimi scurte, pentru ca una din ele sa serveasca drept matrita pentru ribonucleotidele complementare. Alegerea catenei transcrise depinde in mare parte de localizarea si orientarea promotorului.
5'.ATGTTACGACGT.3' catena ADN netranscrisa (catena sens)
![]() 3'.TACAATGCTGCA.5' catena
ADN transcrisa (catena antisens)
3'.TACAATGCTGCA.5' catena
ADN transcrisa (catena antisens)
Transcriptie
5'.AUGUUACGACGU.3' ARNm
Figura 1. Transcriptia
(3) Enzima care catalizeaza tanscrierea ADN genic in ARNm este ARN-polimeraza II (transcriptaza, ARN-polimeraza ADN-dependenta).
3.1.2. Etapele procesului de transcriptie
Pentru realizarea transcrierii, este necesara relaxarea (decondensarea) cromatinei, acetilarea histonelor si interventia elementelor reglatoare din regiunea 5' a genei (asupra carora actioneaza factorii de transriptie).
Procesul transcriptiei se desfasoara in doua mari etape:
formarea ARN mesager precursor (pre-ARNm sau transcript primar);
procesarea (maturarea) ARN mesager precursor.
3.1.2.1. Formarea ARNm precursor
 Formarea ARN mesager
precursor (ARN premesager, transcript primar, ARN heterogen nuclear) incepe
prin decondensarea zonei din ADN care contine gena sau genele ce vor fi
transcrise. Acest proces intervin factori de transcriptie de clasa I (TF
I), acetilarea histonelor si deplasarea histonei H
Formarea ARN mesager
precursor (ARN premesager, transcript primar, ARN heterogen nuclear) incepe
prin decondensarea zonei din ADN care contine gena sau genele ce vor fi
transcrise. Acest proces intervin factori de transcriptie de clasa I (TF
I), acetilarea histonelor si deplasarea histonei H
ARNm precursor se formeaza in trei etape:
initiere
elongare
terminare.
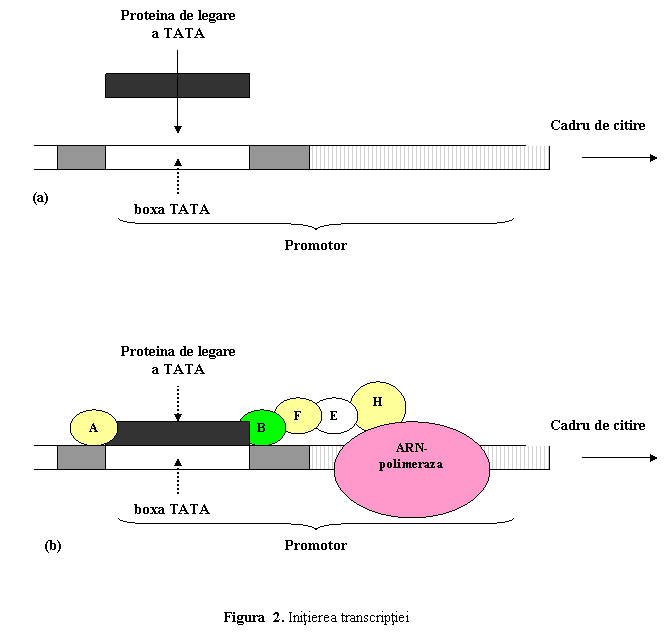
 1) Initierea transcriptiei. Deoarece ARN-polimeraza nu poate recunoaste direct
promotorul si nu poate initia singura transcriptia, sunt
necesari o serie de factori de transcriptie
de clasa II (TFII), care se
fixeaza pe secventele promotorului, dirijand si activand astfel
enzima. Primul factor de transcriptie care se leaga de promotor - TFIID - are o subunitate
numita proteina de legare a TATA
(TATA binding protein-TBP) care recunoaste
si se fixeaza de boxa TATA. TFIID atrage dupa sine si
alti FT (in ordinea TFIIA, TFIIB, TFIIF, TFIIE si TFIIH), care permit
fixarea ARN-polimerazei in regiunea promotor si activarea enzimei (fig. 2).
Transcriptia incepe (este initiata) la nivelul situsului de
initiere a transcriptiei; primul nucleotid transcris este
numerotat conventional "+1".
1) Initierea transcriptiei. Deoarece ARN-polimeraza nu poate recunoaste direct
promotorul si nu poate initia singura transcriptia, sunt
necesari o serie de factori de transcriptie
de clasa II (TFII), care se
fixeaza pe secventele promotorului, dirijand si activand astfel
enzima. Primul factor de transcriptie care se leaga de promotor - TFIID - are o subunitate
numita proteina de legare a TATA
(TATA binding protein-TBP) care recunoaste
si se fixeaza de boxa TATA. TFIID atrage dupa sine si
alti FT (in ordinea TFIIA, TFIIB, TFIIF, TFIIE si TFIIH), care permit
fixarea ARN-polimerazei in regiunea promotor si activarea enzimei (fig. 2).
Transcriptia incepe (este initiata) la nivelul situsului de
initiere a transcriptiei; primul nucleotid transcris este
numerotat conventional "+1".
(2) Transcriptia propriu-zisa (elongarea). Dupa fixarea ARN-polimerazei pe regiunea promotor, cele doua catene ale ADN sunt separate prin actiunea TFIIF, care are actiune de helicaza, eliberandu-se catena antisens, 3'→5'; catena antisens serveste ca matrita pentru atasarea complementara, in sensul 5'- 3', a ribonucleotidelor activate (fig. 3); prin polimerizarea ribonucleotidelor sub actiunea ARN-polimerazei se formeaza ARNpre-m. ARNm se desprinde treptat de pe catena transcrisa, iar cele doua catene refac treptat dublul helix.
(3) Terminarea transcriptiei se produce atunci cand ARN-polimeraza intalneste situsul de terminare a transcriptiei, unde pe catena antisens se afla secventa AATAAA. La 15-30 pb in aval de aceasta secventa, in dreptul situsului de poliadenilare, se va produce sectionarea (sub actiunea unei nucleaze) a ARNm. ARN-polimeraza si factorii de transcriptie se detaseaza de matrita ADN si se elibereaza molecula de ARNm precursor sau transcriptul primar care contine atat exonii, cat si intronii genei copiate.
O gena poate fi transcrisa simultan de mai multe molecule de ARN-polimeraza, formandu-se astfel mai multe copii de ARNm ce contin aceeasi informatie genetica.
3.1.2.2. Procesarea (maturarea) ARNm precursor
Maturarea ARNm precursor are loc la nivel nuclear si se realizeaza prin doua procese: (1) insertia de secvente nucleotidice la extremitatile moleculei si (2) matisarea ARN precursor (fig. 4).
(1) Insertia de secvente nucleotidice la cele doua capete ale moleculei de ARNm precursor faciliteaza cresterea stabilitatii moleculei, transportul spre citoplasma, recunoasterea si fixarea sa la subunitatea mica (40S) a ribozomilor.
La primul nucleotid al capatului 5' al transcriptului primar se adauga o molecula de 7-metil-guanozina, formand o structura denumita boneta (cap).
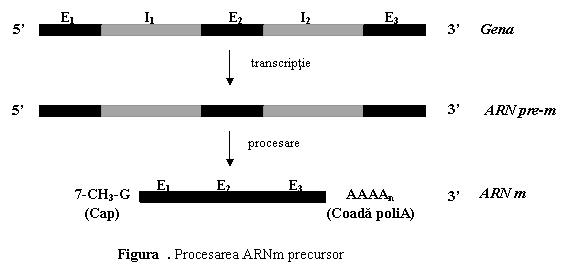 La capatul 3' se adauga
intre 50-200 nucleotide cu adenina, formand o coada poliadenilica.
La capatul 3' se adauga
intre 50-200 nucleotide cu adenina, formand o coada poliadenilica.
(2) Matisarea ARN precursor.
ARNm precursor contine secventele compementare intregului cadru de citire, deci atat exonii cat si intronii. Matisarea (splicing) consta in decuparea si eliminarea intronilor, urmata de reunirea (legarea "cap la cap") a exonilor, cu formarea ARNm matur.
Atat decuparea, cat si reunirea sunt procese care trebuie sa fie foarte precise si care depind de existenta secventelor nucleotidice-semnal situate la limita dintre introni si exoni (situsuri de clivare) - 5'GU (situs donor) si 3'AG (situs acceptor).
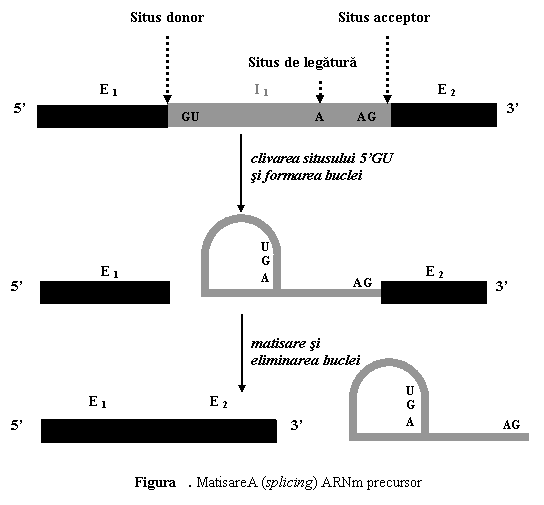
Matisarea (splicing) implica urmatoarele procese: (1) clivarea jonctiunii 5'GU; (2) atasarea nucleotidului G la nucleotidul A al situsului de legatura si formarea unei bucle; (3) sectionarea intronului la jonctiunea 3'AG; (4) indepartarea intronului si sudarea secventelor exonice (fig. 5).
Procesul de matisare este mediat de un complex format din ARN nuclear mic (ARNsn) si proteine numit spliceosome sau particule mici ribonucleoproteice (small ribonucleotide particles - snurps). In cadrul procesului de matisare exonii sunt sudati, de cele mai multe ori, in ordinea in care acestia sunt dispusi in interiorul genelor - matisare constitutiva (constitutive splicing) (vezi Reglarea expresiei genelor).
3.2. TRANSLATIA
Translatia (traducerea) reprezinta a doua etapa a expresiei genice si consta in decodificarea informatiei genetice din ARNm care permite aranjarea specifica a aminoacizilor si polimerizarea lor intr-un lant polipeptidic
Procesul de translatie necesita un "dictionar" reprezentat de codul genetic si un aparat de translatie, care cuprinde un "traducator", reprezentat de moleculele de ARN de transfer (ARNt), ribozomi, enzime si cofactori proteici.
Tabel 1. Codul genetic
|
Primul nucleotid (capatul 5') ↓ |
Al 2-lea nucleotid |
Al 3-lea nucleotid (capatul 3') ↓ |
|||
|
U |
C |
A |
G |
||
|
U |
Phe |
Ser |
Tyr |
Cys |
U |
|
Phe |
Ser |
Tyr |
Cys |
C |
|
|
Leu |
Ser |
STOP |
STOP |
A |
|
|
Leu |
Ser |
STOP |
Trp |
G |
|
|
C |
Leu |
Pro |
His |
Arg |
U |
|
Leu |
Pro |
His |
Arg |
C |
|
|
Leu |
Pro |
Gln |
Arg |
A |
|
|
Leu |
Pro |
Gln |
Arg |
G |
|
|
A |
Ile |
Thr |
Asn |
Ser |
U |
|
Ile |
Thr |
Asn |
Ser |
C |
|
|
Ile |
Thr |
|
Arg |
A |
|
|
Met |
Thr |
|
Arg |
G |
|
|
G |
Val |
|
Asp |
Gly |
U |
|
Val |
|
Asp |
Gly |
C |
|
|
Val |
|
Glu |
Gly |
A |
|
|
Val |
|
Glu |
Gly |
G |
|
3.2.1. Codul genetic
Conform dogmei centrale a geneticii moleculare informatia din structura unei gene, stocata sub forma unei anumite secvente a celor patru tipuri de nucleotide (A, T, G, C) este copiata (transcrisa) complementar (U, A, C, G) in ARNm si apoi tradusa intr-o anumita secventa de aminoacizi, care vor forma un lant polipeptidic. Translatia este efectuata cu ajutorul codului genetic.
Codul genetic reprezinta relatia de corespondenta intre o anumita secventa de trei nucleotide numita codon si un anumit aminoacid. Cele patru litere (nucleotide) pot forma cuvinte alcatuie din trei litere, iar gena este un "mesaj coerent" format dintr-o insiruire de codoni (tabel 1).
Caracteristicile codului genetic.
(1) "Cuvintele" codului sunt reprezentate de grupuri de cate trei nucleotide, numite codoni. Codul genetic este triplet.
Combinatiile celor patru baze luate cate trei (43) realizeaza 64 de triplete de baze sau codoni, dintre care 61 codifica un aminoacid (codoni sens).
(2) Codul genetic are un codon initiator (start) (AUG) si trei codoni stop (UAA, UAG, UGA) (codoni nonsens).
(3) Deoarece exista 61 de codoni sens si numai 20 de aminoacizi, inseamna ca unii aminoacizi pot fi specificati de mai multi codoni; codonii diferiti ce codifica acelasi aminoacid se numesc codoni sinonimi (diferiti, de obicei, prin a treia baza), iar codul genetic este degenerat (redundant). Cu exceptia metioninei si a triptofanului, codificati fiecare de un singur codon, ceilalti 18 aminoacizi sunt codificati de doi sau mai multi codoni.
Caracterul degenerat al codului genetic constituie un avantaj pentru celula, oferind protectie impotriva efectelor mutatiilor (mutatiile genice care produc codoni sinonimi nu afecteaza structura proteinei codificate).
(4) Codul genetic este nesuperpozabil: codonii vecini nu au nici un nucleotid comun.
(5) Codul genetic prezinta continuitate (fara pauze): intre codonii adiacenti nu exista nucleotide cu rol de "virgula".
(6) Codul genetic este lipsit de ambiguitate: un codon specifica intotdeauna un aminoacid, totdeauna acelasi.
(7) Codul genetic este universal, acelasi la toate organismele (bacterii, plante, animale si om). Cu toate acestea, codul genetic mitocondrial are cateva mici diferente fata de cel nuclear.
3.2.2. Aparatul de translatie
Aparatul de translatie este alcatuit din ARNm, ARNt, ribozomi, aminoacizi, factori de initiere, factori de elongare, enzime, surse de energie (GTP, etc)
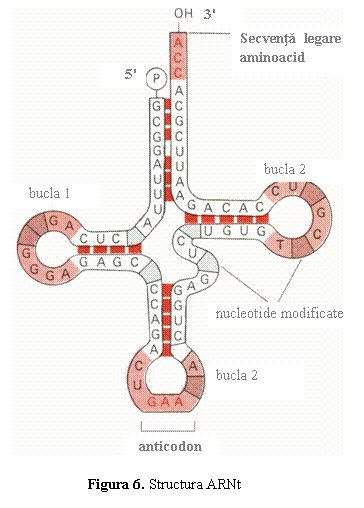 a) ARN de transfer (ARNt) transporta aminoacizii din citoplasma la
ribozomi, sediul sintezei proteice, unde ii pozitioneaza in ordinea
dictata de codonii din ARNm; ARNt are deci rolul de "translator".
a) ARN de transfer (ARNt) transporta aminoacizii din citoplasma la
ribozomi, sediul sintezei proteice, unde ii pozitioneaza in ordinea
dictata de codonii din ARNm; ARNt are deci rolul de "translator".
ARNt este un poliribonucleo-tid monocatenar de dimensiuni mici (75-100 nucleotide), cu structura secundara "in trifoi": prezinta trei regiuni scurte, dublu catenare numite tulpini, care se termina cu bucle monocatenare (fig. 6), structura care este identica la toate tipurile de ARN. ARNt contine doua secvente importante: (1) secventa CCA de la capatul 3'OH de care se leaga aminoacidul cu ajutorul enzimei aminoacil-ARNt-sintetaza; (2) anti-codonul, o secventa de trei nucleotide situata in bucla opusa capatului 3'; anticodonul recunoaste, prin complementaritate, codonul din ARNm corespunzator aminoacidului.
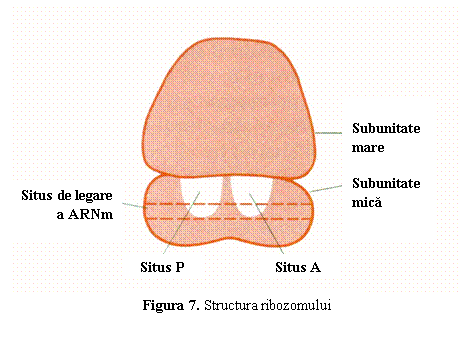
(b) Ribozomii sunt organite citoplasmatice in care are loc asamblarea aminoacizilor in proteine pe baza informatiei din ARNm. Sunt alcatuiti din doua subunitati deosebite prin constanta de sedimentare (S). In perioada in care nu sunt implicate in sinteza proteica, cele doua subunitati sunt disociate si libere in citoplasma; ele se asociaza la inceputul translatiei formand ribozomul activ. Fiecare subunitate este alcatuita din ARN ribozomal (ARNr) si proteine. Subunitatea mica (40S) prezinta un situs de legare a capatului 5' a ARNm. Subunitatea mare (60S) prezinta doua situsuri invecinate: situsul A (aminoacil) si situsul P (peptidil) unde se fixeaza moleculele de ARNt cuplate cu aminoacizi (fig. 7).
(c) Enzimele implicate in procesul translatiei sunt aminoacil-ARNt-sintetaza si peptidil-transferaza. Aminoacil-ARNt-sintetazele sunt 20 de enzime care recunosc si leaga fiecare atat un aminoacid, cat si ARNt corespunzator. Peptidil-transferaza cata-lizeaza formarea de legaturi peptidice intre aminoacizi.
 (d) Cofactorii
proteici, reprezentati de factorii de initiere (IF), factorii de elongatie (EF) si factorul de terminare, intervin in
diferite etape ale translatiei.
(d) Cofactorii
proteici, reprezentati de factorii de initiere (IF), factorii de elongatie (EF) si factorul de terminare, intervin in
diferite etape ale translatiei.
Translatia se desfasoara in trei faze succesive: initierea, elongarea si terminarea translatiei.
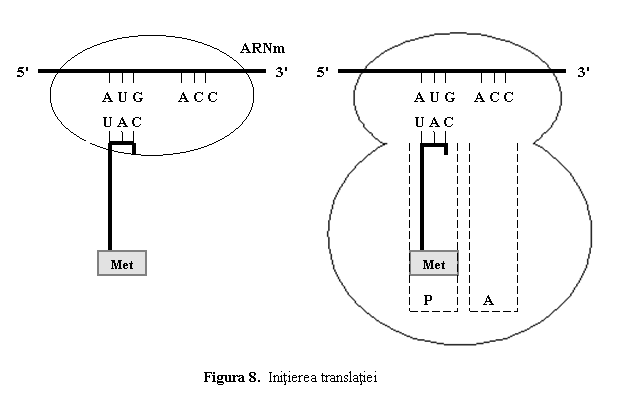
(1) Initierea translatiei este etapa in care primul aminoacid al proteinei (de la capatul NH2-terminal) este pozitionat in dreptul codonului start AUG din ARNm (ce corespunde metioninei) si sunt asamblate cele doua subunitati.
Initial, ARNm se fixeaza cu "boneta" (cap) si secventa 5'-AUG-3' pe subunitatea mica (40S) a ribozomului; apoi ARNm si primul ARNt "incarcat" cu primul aminoacid metionina (ARNt initiator) formeaza complexul de initiere; anticodonul ARNt-1 este in contact cu codonul AUG al ARNm. Urmeaza fixarea subunitatii mari (60S), iar ribozomul devine activ. ARNt-initiator ocupa situsul P al subunitatii mari, situsul A fiind liber (fig. 8).
(2) Elongarea este etapa in cursul careia se formeaza legaturi peptidice intre aminoacizii aranjati pe baza ordinii codonilor din ARNm.
Dupa pozionarea ARNt initiator in situsul P al ribozomului, pe situsul A liber se plaseaza al doilea ARNt incarcat cu aminoacidul codificat de al doilea codon din ARNm. Sub actiunea peptidil-transferazei, se formeaza o legatura peptidica intre primii doi aminoacizi; rezulta astfel un dipeptid care este legat la cel de-al doilea ARNt. Apoi, sub actiunea unui factor de elongare, GTP si a unei translocaze, ribozomul se deplaseaza cu trei nucleotide in lungul ARNm, in directia 5'→3'. Astfel, ARNt initiator paraseste situsul P, care va fi ocupat de cel de-al doilea ARNt ce contine dipeptidul. In situsul A eliberat se fixeaza a treilea ARNt cu aminoacidul corespunzator, iar acest al treilea aminoacid se leaga de dipeptid (fig. 9).
Cele trei faze - atasarea aminoacid-ARNt la ribozom, formarea legaturii peptidice si translocarea ribozomului - se repeta ciclic, determinand cresterea lantului polipeptidic.
Pe masura ce un ribozom avanseaza in lungul moleculei de ARNm, si alti ribozomi pot incepe citirea moleculei, formandu-se astfel sute sau mii de polipeptide identice (amplificare).
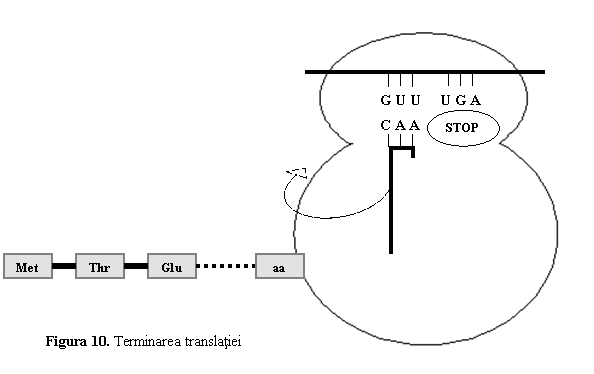
(3) Terminarea traducerii are loc in momentul cand in situsul A ajunge un codon stop (UAA, UAG sau UGA) (fig. 10). Deoarece nu exista un ARNt corespunzator codonilor stop, pe situsul A se ataseaza factorii de terminare care leaga o molecula de apa la nivelul peptidului. Polipeptidul eliberat astfel din ribozom va suferi o serie de modificari si va dobandi forma tridimensionala specifica.
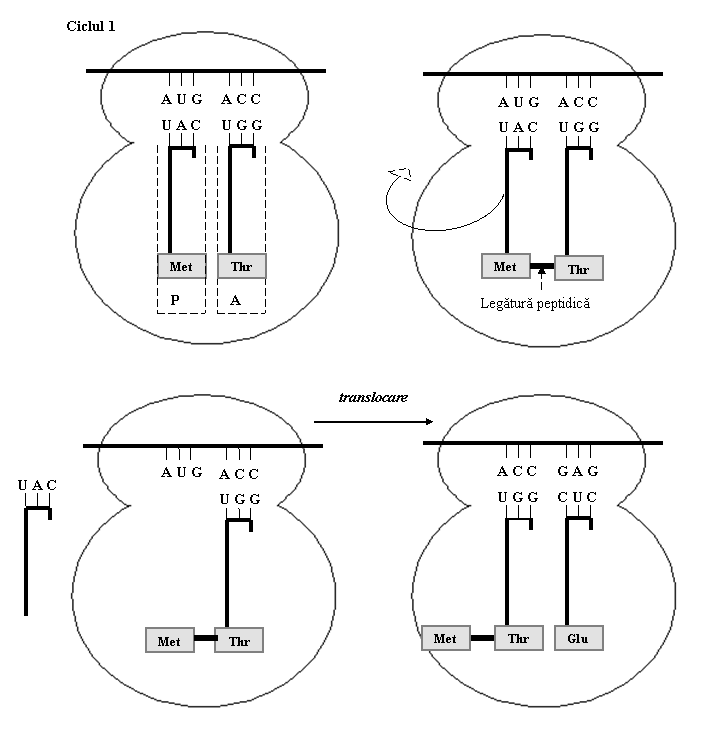
Figura 9. Translatie - elongare
PROCESAREA POSTTRANSLATIONALA A PROTEINELOR
(1) Fiecare proteina sintetizata va functiona intr-un anumit compartiment al celulei sau in spatiul extracelular. Astfel proteinele sunt dirijate (targeting) spre o anumita destinatie cu ajutorul unor secvente semnal, prezente in structura acestora (fig. 11.).
Intr-o prima etapa sunt separate proteinele destinate celulei de cele care vor fi eliminate la exteriorul acesteia. Astfel, proteinele care urmeaza a fi excretate prezinta la capatul N-terminal o secventa de 10-30 de aminoacizi denumita peptid-semnal (signal peptide), absent la proteinele destinate celulei.
In momentul in care secventa semnal devine vizibila la suprafata ribozomului, de ea se leaga o particula de recunoastere a semnalului (SRP-signal recognition particle), care opreste procesul de translatie (SRP este o particula ribonucleoproteica, alcatuita din sase proteine diferite si ARN 7S). Complexul ribozom-peptid semnal-SRP recunoaste si se fixeaza de un receptor al particulei de recunoastere a semnalului (docking protein sau signal recognition particle receptor) aflat pe fata citosolica a membranei reticulului endoplasmic (RE). Odata fixat la RE, translatia se reia, iar polipeptidul traverseaza membrana RE printr-un canal de translocare (translocon); ajuns in lumenul RE, peptidul-semnal se desprinde de proteina sub actiune enzimatica (signal peptidase).
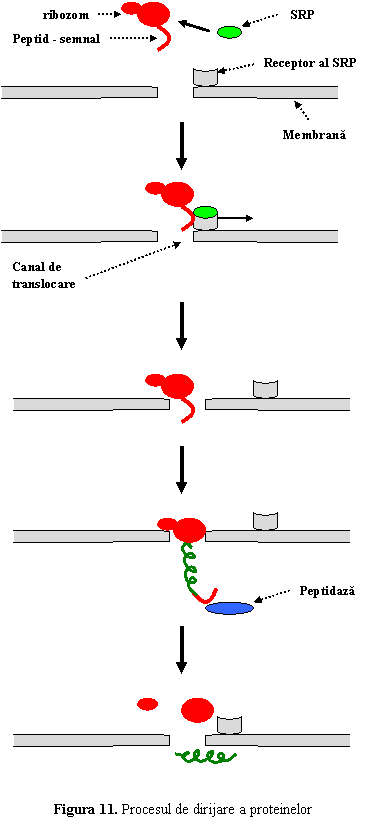 Mecanismul
dirijarii este asemanator pentru proteinele destinate nucleului,
complexului Golgi sau mitocondriilor.
Mecanismul
dirijarii este asemanator pentru proteinele destinate nucleului,
complexului Golgi sau mitocondriilor.
Proteinele destinate lizozomilor - proteaze - contin o secventa aminoacidica ce determina atasarea posttrans-lationala de manoza-6-fosfat.
(2) Pe masura sintezei unui polipeptid, acesta se pliaza in anumite regiuni realizand structuri secundare (α-helix sau β-pliere) prin interactiuni intre diferiti aminoacizi. Aceasta pliere este posibila numai in prezenta unor proteine numite chaperones. Astfel, la sfarsitul sintezei, polipeptidul are o configuratie tridimensionala specifica functiei sale.
Polipeptidele sufera, de asemenea, diferite modificari permanente sau reversibile, care fac proteina sa devina activa.
Fosforilarea serinei (kinaze), acetilarea lizinei (histone) sunt exemple de modificari chimice reversibile.
Modificarile permanente sunt reprezentate de:
a) Clivarea proteolitica a lantului polipeptidic
Dupa sinteza are loc frecvent clivarea si indepartarea metioninei initiale sau, la unele proteine, a peptidului semnal de la extremitatea NH2.
Numeroase proteine sunt sintetizate sub forma de precursori inactivi (pro-hormoni, pro-enzime); acesti precursori sunt clivati proteolitic, rezultand proteina matura activa. De exemplu, in cazul insulinei, din produsul genic rezulta mai multe lanturi polipeptidice.
b) Glicozilarea are loc in RE sau in complexul Golgi in cazul glicoproteinelor secretate.
c) Hidroxilarea unor aminoacizi, de exemplu a prolinei si lizinei, este intalnita in cazul proteinelor tesutului conjunctiv - colagen si elastina (asigura integritatea structurala); hidroxi-prolina este prezenta in structura acetilcolinesterazei si a complementului.
e) Adaugarea de lipide caracterizeaza proteinele membranei celulare. Cele mai frecvente sunt acilarile (atasarea de acizi grasi) si prenilarile. Dintre acizii grasi, cel mai frecvent se adauga acidul N-miristic la nivelul glicinei amino-terminale.
Proteinele pot fi alcatuite din unul sau mai multe polipeptide, de exemplu hemoglobina, fibra de colagen, fiecare dintre ele fiind supusa modificarilor postranslationale.
REGLAREA EXPRESIEI GENELOR
In toate celulele organismului uman, informatia genetica este aceeasi, indiferent de structura si functia lor, deoarece rezulta prin mitoze succesive dintr-un zigot. Expresia genelor este insa diferita. Unele gene se exprima continuu in toate tipurile de celule (gene comune sau constitutive); un numar mare de gene se exprima doar in anumite tesuturi sau pe perioade de timp limitate; alte gene sunt complet si permanent inactivate. Toate aceste fenomene sunt rezultatul unor mecanisme complexe de control al expresiei genelor. Acestea actioneaza in fiecare etapa a exprimarii genelor. In afara de factorii genetici, controlul expresiei genelor este influentat si de factori negenetici, denumiti epigenetici.
1. Reglarea epigenetica (pretranscriptionala) a expresiei genelor
Acest tip de reglare are ca scop expresia genelor in anumite organe, tesuturi, tipuri de celule sau celule individuale (deci organizarea lor spatiala). Pentru aceasta in celulele embrionare diferentiate sunt selectate anumite gene, care se vor exprima si la descendentii lor. Aceste fenomene presupun modificarea structurii cromatinei, realizata in principal prin mecanisme epigenetice.
In nucleu, ADN formeaza cu histonele structuri cu diferite grade de compactare - cromatina. Pentru ca o gena sa poata fi transcrisa, factorii reglatori trebuie sa aiba acces la promotorul genei. Aceasta necesita o modificare a structurii cromatinei, mai ales a eucromatinei, si anume modificari ale histonelor si metilarea ADN. Acestea sunt reversibile si sunt transmisibile ereditar.
a) Modificarile histonelor au drept consecinta modificarea cromatinei. De exemplu, metilarea lizinei 4 din structura histonei H3 este asociata cu activarea expresiei genelor, in timp ce metilarea lizinei 9 a aceleiasi histone diminua expresia lor. Acetilarea histonelor este asociata cu relaxarea cromatinei, deci cu activarea transcriptiei genelor.
Cromatina inactiva (heterocromatina) este puternic condensata ca urmare a fixarii stranse a histonei H1. Cromatina activa (eucromatina) este mai relaxata datorita acetilarii histonelor din structura nucleozomului.
b) Metilarea ADN este datorata enzimei ADN-metiltransferaza, care introduce o grupare metil in pozitia 5' a citozinei secventelor CG si GC, localizate in promotorul majoritatii genelor. Metilarea ADN reprezinta cel mai important mecanism de represie a transcriptiei.
Imediat dupa fecundare sunt activate numeroase gene prin demetilarea ambelor genomuri parentale, cromatina se relaxeaza si sunt activate astfel genele necesare dezvoltarii embrionare precoce. Pe masura ce are loc diferentierea celulara, unele dintre aceste gene vor fi inactivate selectiv.
Metilarea ADN este responsabila si pentru fenomenul de amprentare genomica, care consta in exprimarea diferentiata a unei gene in functie de originea, materna sau paterna, a acesteia.
c) Se considera ca trecerea temporara de la configuratia B la forma Z a ADN unor gene face ca acestea sa fie mai accesibile la factorii de transcriptie.
2. Reglarea transcriptionala
Etapa principala a reglarii expresiei genice are loc in toate celulele la nivelul initierii transcriptiei, mai precis la reglarea activitatii ARN-polimerazei II, enzima care transcrie genele care codifica proteine. Aceasta reglare necesita interactiunea proteinelor trans-reglatoare (factorii de transcriptie) cu secvente specifice, cis-reglatoare, de ADN. Ca rezultat al acestei interactiuni, gene specifice sunt transcrise intr-un anumit moment.
2.1. Secventele cis-reglatoare sunt secvente scurte de ADN la care se fixeaza factori specifici de transcriptie; in acest fel este gena este recunoscuta de catre ARN-polimeraza si este reglata specificitatea si intensitatea transcriptiei in functie de necesitatile celulare.
Unele dintre aceste secvente au localizare precisa, la nivelul promotorului genei (TATA, CAAT, GC). Alte secvente, situate in amonte, confera genelor specificitate tisulara. Secventele care regleaza intensitatea transcriptiei (intensificatori, atenuatori) au localizare variabila.
In urma fixarii factorilor de transcriptie pe aceste secvente, cromatina se decondenseaza, ceea ce permite atasarea ARN-polimerazei langa situsul de initiere si declansarea transcrierii.
2.2. Factorii de transcriptie
Factorii de transcriptie (transcription factors) (FT) sunt proteine trans-reglatoare care recunosc si se leaga de secventele de reglare (cis) ale ADN. Pentru transcrierea unei gene umane este necesara interactiunea mai multor FT (se cunosc sute de FT).
 Toti factorii de transcriptie contin
doua domenii: un domeniu de activare
(care activeaza transcrierea) si un domeniu de fixare la ADN; domeniul de fixare are o structura
particulara de aminoacizi ce formeaza un motiv structural; in
functie de aceasta, se descriu mai multe tipuri de FT:
Toti factorii de transcriptie contin
doua domenii: un domeniu de activare
(care activeaza transcrierea) si un domeniu de fixare la ADN; domeniul de fixare are o structura
particulara de aminoacizi ce formeaza un motiv structural; in
functie de aceasta, se descriu mai multe tipuri de FT:
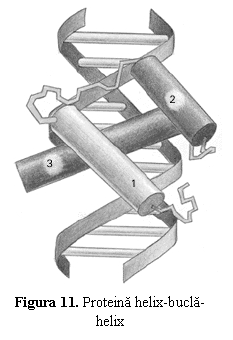
. Proteine helix-bucla-helix (helix-loop-helix) la care domeniul de fixare este format din doua α-helixuri separate printr-o bucla scurta (fig. 11); acest model structural este prezent la FT care stimuleaza sinteza de imunoglobuline.
. Proteine cu degete de zinc (zinc finger), in care aminoacizii se dispun in spatiu sub forma unor degete de manusa, la baza carora se fixeaza un ion de zinc (Zn ) (cel mai frecvent de cisteina sau histidina) (fig. 11); acestea se intalnesc in structura FT ai promotorului genelor menajere;
. Proteine cu fermoar de leucine (leucine
zipper) sunt proteine dimerice; fiecare monomer, α-helicoidal, contine cate o leucina la fiecare
sapte aminoacizi (fig. 13). Cele 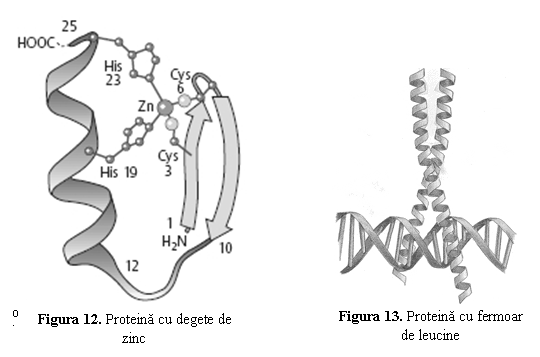 doua
helixuri interactioneaza strans (ca un fermoar), mai ales prin
legaturi intre leucine. Acest tip de FT se gasesc la unele
protooncogene.
doua
helixuri interactioneaza strans (ca un fermoar), mai ales prin
legaturi intre leucine. Acest tip de FT se gasesc la unele
protooncogene.
Deoarece aceste secvente sunt situate adesea la distante foarte mari, in amonte sau in aval de situsul de initiere, se presupune ca activatorul fixat pe secventa intensificatoare interactioneaza cu o componenta a complexului bazal de transcriptie, formand o bucla de ADN care apropie cele doua secvente.
Factorii de transcriptie sunt codificati de asa-numitele gene reglatoare (master genes sau selector genes), situate aproape sau la distanta mare (40.000 pb) de genele pe care le controleaza.
2.3. Promotori alternativi
Unele gene umane au doi sau mai multi promotori. Prin folosirea lor alternativa rezulta diferite izoforme ale unei proteine, cu proprietati diferite. Alegerea promotorilor nu se face la intamplare, ci prin actiunea unor factori trans-reglatori, dintre care unii specific tisulari. Selectarea promotorilor are loc, de exemplu, in cazul genei distrofinei, care are cel putin opt promotori. Patru promotori sunt situati in regiunea 5' si sunt specifici pentru cortexul cerebral, cerebel, muschi, limfocite; datorita folosirii unui prim exon diferit, produc patru izoforme de distrofina, diferite prin capatul N-terminal. Ceilalti patru promotori sunt intragenici, in structura cadrului de citire; atunci cand transcriptia incepe la nivelul acestor promotori sunt folositi numai o parte din exoni, rezultand izoforme mici de distrofina prezente in retina, celulele Schwann, rinichi.
3. Reglarea postranscriptionala
Dupa transcriptie, reglarea expresiei genelor poate consta intr-o modificarea calitativa sau cantitativa a ARNm.
(1) In procesul de matisare exonii sunt reuniti, de cele mai multe ori, in ordinea in care sunt dispusi in gene - matisare constitutiva (constitutive splicing)
La numeroase gene umane, din ARNm precursor sunt eliminati atat intronii, cat si o parte din exoni; moleculele de ARN matur contin doar anumiti exoni care pastreaza ordinea in care sunt dispusi in gena. Prin acest proces de matisare alternativa (alternative splicing), dintr-un transcript primar se formeaza molecule diferite de ARNm matur. In felul acesta o gena poate determina sinteza mai multor proteine diferite.
Uneori, aceste proteine sunt izoforme, avand functii similare. Alteori se produc proteine complet diferite ca structura si functie; de exemplu, gena calcitoninei produce in celulele C din glanda tiroida calcitonina (hormon cu rol in reglarea metabolismului fosfo-calcic), iar in hipotalamus un peptid inrudit cu calcitonina (calcitonin-related peptide) (cu functii neuromodulatoare si trofice).
Amestecarea exonilor (exon shuffling) reprezinta un alt proces prin care, din aceeasi gena, se obtin proteine cu structuri si functii diferite: ARNm matur contine toti exonii, dar intr-o ordine diferita fata de gena;
(3) Editarea ARN (RNA editing) este o forma rara de procesare a ARNm in care se produce deletia, insertia sau substitutia unui nucleotid. In felul acesta, in tesuturi diferite acelasi ARNm isi modifica structura, producand proteine diferite ca lungime. La om, fenomenul de editare a fost descris in gena pentru apolipoproteina B (apoB este un transportor de grasimi); in intestinul subtire, in codonul 2152 al ARNm pentru apo B, C este inlocuita cu U, transformand un codon sens intr-un codon stop, oprind astfel translatia (varianta scurtata a apo B leaga si transporta grasimile de origine alimentara); in ficat, acelasi ARNm nu este modificat, producand o proteina apo B mai lunga (transporta grasimile sintetizate de catre ficat).
(4) Poliadenilarea alternativa
Genele care contin la nivelul regiunii 3'UTR doua sau mai multe situsuri de poliadenilare pot suferi procese de adenilare alternativa, specifice pentru anumite tesuturi.
(5) Modificarea stabilitatii (duratei de viata) a ARNm
Durata de viata a ARNm depinde de cantitatea acestuia. De exemplu, ARNm al histonelor are o stabilitate crescuta in timpul replicarii ADN, cand sinteza acestor proteine este intensa, si foarte scazuta in alte faze ale ciclului celular. ARNm al unor protooncogene are o stabilitate anormal de crescuta si determina o sinteza excesiva a proteinelor corepunzatoare.
(6) Modificarea stocajului ARNm
Dupa transcriptie moleculele de ARNm pot fi stocate in nucleu sau citoplasma printr-un mecanism inca necunoscut. Unii hormoni pot produce o crestere rapida a sintezei de proteine prin eliberarea ARN stocat si nu prin stimularea transcriptiei.
Reglarea translationala
(1) Reglarea prin molecule citoplasmatice
Cel mai cunoscut exemplu este reglarea sintezei de feritina (proteina care fixeaza si transporta Fe2+) in functie de concentratia fierului: cresterea concentratiei stimuleaza producerea de feritina si invers. In regiunea 5'UTR a ARNm al feritinei se gaseste un element de raspuns in forma de agrafa de par (hairpin), numit element de raspuns la fier (IRE-Iron Response Element), pe care se fixeaza un factor de transcriptie represor (IRE-binding repressor protein). Cresterea concentratiei de Fe2+ induce desprinderea proteinei represoare de IRE si translatia ARNm al feritinei. In absenta Fe2+, represorul ramane fixat pe IRE si opreste temporar translatia.
(2) Reglarea prin factori de initiere ai translatiei
Factorii de initiere, notati IF (initiation factors) 1-6, intervin in diferitele etape ale translatiei. De exemplu, fosforilarea IF-2 (in soc termic, infectii virale, etc) reduce procesul de sinteza proteica.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |