
Membranele eritrocitare- model pentru ințelegerea structurilor membranare
Primele și cele mai detaliate informații asupra proteinelor membranare au fost obținute din studiul membranelor eritrocitare.
Motivația este simpla: materialul biologic este ușor de obținut, in cantitate suficienta; populația celulara omogena este ușor de asigurat, membranele se obțin fara dificultate printr-un simplu șoc hipoton urmat de centrifugare, iar membranele obținute (numite și fantome eritrocitare) nu sunt impurificate cu endomembrane (membrane ale organitelor celulare), inexistente in acest caz.
Proteinele membranelor astfel purificate au fost rezolvate prin electroforeza in gel de poliacrilamida in prezența de dodecilsulfat de sodiu (SDS-PAGE). Avantajele acestui tip de electroforeza constau in faptul ca detergentul (dodecilsulfatul de sodium numit și laurilsulfat de sodiu) pe de o parte elibereaza toate proteinele (atat pe cele periferice, cat și pe cele integrale) din arhitectura membranei, solubilizandu-le, iar pe de alta parte se adsoarbe unitar pe lanțurile polipeptidice, conferindu-le o densitate de sarcina negativa unitara. In aceste condiții migrarea proteinelor se face numai in funcție de greutatea lor moleculara.
Rezultatele unei asemenea abordari pentru descrierea proteinelor membrane eritrocitare se infațișaza sub forma unui spectru de benzi proteice distribuite intre 20 și 250 kD, benzi care inițial au primit denumiri sub forma de cifre (banda 1, banda 2, etc.), nuanțandu-se cu, spre exemplu, banda 4.1, banda 4.2, acolo unde benzile apareau ca dublete. Ulterior, unele dintre proteine au primit denumiri specifice.
Organizarea și funcționarea membranei eritrocitare poate fi discutata pe baza informațiilor pe care le avem referitor la proteinele ei. Comentariile asupra proteinelor membranei eritrocitare ne vor ajuta sa ințelegem mai aprofundat organizarea acestor macromolecule in arhitectura biomembranelor, care este in stransa legatura cu funcționalitatea lor.
- Cea mai bine cunoscuta proteina a membranei eritrocitare, sub aspectul structurii biochimice este glicoforina (o glicoproteina, numita, prezenta din abundența in membrana eritrocitului, care migreaza atipic -se dispune electroforetic undeva pe la 90kD, deși masa ei moleculara este de numai ~30kD). Are 131 aminoacizi, cunoscandu-i-se integral secvența;
-este proteina transmembranara unipas, tip I (capatul amino in ectodomeniu);
- ectodomeniul este mare și poarta, din cate știm in momentul de fața, 16 lanțuri glucidice care practic dubleaza marimea acestei molecule (explicație pentru migrarea electroforetica atipica),
endodomeniul este mic purtand capatul carboxil al lanțului polipeptidic; domeniul transmembranar este structurat in α- helix și conține 26 de aminoacizi.
Paradoxul este ca, deși structural glicoforina pare a nu avea secrete, nu i se cunoaște funcția. Ciudațenia este cu atat mai mare cu cat exista eritrocite din a caror membrana glicoforina lipsește fara ca funcționalitatea sa le fie afectata.
- O situație diametral opusa o reprezinta proteina banda 3, despre care avem mai puține informații structurale, dar a carei funcție este clar stabilita: este proteina care structureaza canalul anionic de schimb intre bicarbonat (HCO3 -) și clorura (Cl-).
Este proteina transmembranara, are masa moleculara de ~100kD (in jur de 930 aminoacizi) și cel puțin 13 treceri in α-helix prin bistratul lipidic (cam 50kD din masa moleculara);
endodomeniul este mare (~400 din aminoacizii care o formeaza, ~40kD) și poarta capatul amino (proteina transmembranara de tip II);
ectodomeniul, mic, ~20 aminoacizi, poarta o mica incarcatura glucidica (se pare ca doar 2 lanțuri) și reprezinta capatul carboxil al proteinei.
Cea de-a treia proteina pe care o amintim este spectrina, care, impreuna cu celelalte doua amintite mai sus, reprezinta peste 60% (procente de masa) din proteinele membranei eritrocitare. Spectrina este o proteina periferica situata pe peretele intern al membranei (așadar o endoproteina) și reprezinta componenta de baza a ceea ce numim citoschelet asociat membranei.

Citoscheletul asociat membranei este o rețea de endoproteine cu ochiuri și noduri,
solidara membranei prin atașarea la endodomeniul unor proteine transmembranare
Grosimea acestei structuri membranare este de 5-10nm. Citoscheletul asociat membranei
este responsabil de menținerea și/sau modificarea formei celulelor, ca și de geometria membranei (de exemplu: forma biconcava a eritrocitului, structurarea specializarilor de membrana cum ar fi microvili, stereocili, cili, flageli).
Spuneam ca spectrina este componenta de baza a citoscheletului asociat membranei. Ea este un heterodimer format dintr-o subunitate α (α-spectrina, ~240kD) și o subunitate β (β-spectrina, ~220kD). Cele doua subunitați cu geometrie fibrilara se rasucesc ușor una in jurul alteia intr-o structura elicoidala, formand bastonașe flexibile, cu lungimea de ~100nm.
Rasucirea este in contra-direcție (antiparalel), fiecare bastonaș avand la capete gruparea amino-terminala a unei subunitați și gruparea carboxi-terminala a celeilalte. Capatul conținand gruparea amino-terminala a subunitații α și gruparea carboxi-terminala a subunitații β este numit capul bastonașului, iar celalalt capat este coada acestuia.
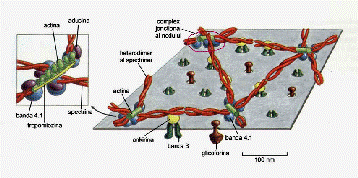
Bastonașele au capacitatea de a interacționa cate doua, cap la cap, formand tetrameri lungi de ~200nm. Acești tetrameri formeaza laturile rețelei citoscheletului asociat membranei. Capetele tetramerilor, ce reprezinta cozile bastonașelor de spectrina, au capacitatea de a se asocia, de regula cate 5 sau 6, prin interacțiuni cu filamente scurte de actina, formand nodurile rețelei.
Așadar actina este o alta proteina ce participa la structurarea citoscheletului asociat membranei, asigurand solidarizarea componentelor acestuia la nivelul nodurilor.
In forma sa monomerica actina este o proteina globulara cu masa de ~43kD și un diametru de ~5nm. La nivelul citoscheletului asociat membranei formeaza fragmente mici, filamentare, de 8-12 monomeri, cu rolul de a asigura asocierea cozilor tetramerilor de spectrina in nodurile rețelei.
Tot in noduri se localizeaza o alta proteina periferica, banda 4.1, cu masa de ~80kD și conformație globulara (diametrul ~6nm). Banda 4.1 interacționeaza dinamic, pe de o parte cu spectrina și actina in nodurile rețelei citoscheletale și, pe de alta parte, cu endodomeniile benzii 3, sau glicoforinei, contribuind la atașarea citoscheletului de membrana.
Atașarea citoscheletului la membrane este datorata in principal unei alte proteine globulare, ankirina (masa moleculara ~210kD, diametrul ~9nm), care se leaga atat la spectrina cat și la domeniul benzii 3, asigurand ancorarea la membrana a citoscheletului, la nivelul laturilor ochiurilor.
Interacțiunile fine dintre elementele citoscheletului asociat membranei sunt intr-o dinamica permanenta, astfel incat aceasta structura nu este rigida, ci intr-o continua modelare, care sa satisfaca nevoile celulei.
Citoscheletul asociat membranei nu este doar o caracteristica a membrane eritrocitare. El se gasește in toate celulele și este structurat asemanator, chiar daca unele dintre componente au fost denumite diferit (spre exemplu echivalenta spectrinei in celulele nervoase este numita fodrina).
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |