
MINISTERUL EDUCATIEI, CERCETARII, TINERETULUI SI SPORTULUI

UNIVERSITATEA DIN ORADEA FACULTATEA DE STIINTE
SCOALA DOCTORALA
STUDII MORFO-FIZIOLOGICE, ANATOMICE SI BIOCHIMICE LA SEDUM TELEPHIUM SSP. MAXIMUM (L.) HOFMM VITROCULTIV
RAPORT DE CERCETARE STIINTIFICA
RAPORT NUMARUL III
PREZENTAREA SI INTERPRETAREA REZULTATELOR PRELIMINARII
INTRODUCERE
În urma acumularii unui urias bagaj de rezultate experimentale, atat in domeniul culturilor in vitro cat si al biologiei moleculare si celulare, exista certitudinea ca oricare celula vie, posedand nucleu, indiferent de specializarea sa functionala, poate fi determinata sa reproduca organismul din care provine, cu conditia sa-i fie oferite conditiile corespunzatoare de mediu, potrivite punerii in valoare a totipotentialitatii celulare (AUGE si colaboratorii, 1982).
Descoperirea posibilitatii de micropragare in vitro, care este tot o inmultire de tip vegetativ, a largit enorm numarul speciilor ce pot fi multiplicate astfel, a scurtat durata de obtinere a plantelor si a sporit considerabil randamentul de multiplicare. rintre alte avantaje ale micropragarii in vitro se pot enumera: afectarea unor spatii mai restranse decat pentru inmultirea vegetativa traditionala, posibilitatea practicarii pe tot parcursul anului, reducerea timpului pentru obtinerea stocului de plante mama, conservarea pe timp nelimitat a materialului de inmultire.
Pe plan mondial, cercetarile privind aceste aspecte s-au finalizat prin elaborarea de studii si tehnici referitoare la o mare diversitate de specii medicinale si aromatice, valorificate pe scara larga din punct de vedere comercial, datorita continutului in substante farmacologic active (BALAJ et al.,1988; CELLAROVA, 1992; KAUR et al.,1999).
Multe din ,,secretele,, vietii, intimitatea proceselor biochimice desfasurate la nivel celular si molecular-in contextul organismului ca intreg - au fost in mare parte dezlegate, dar au mai ramas inca necunoscute pe care omul le poate elucida, motivat fiind, printre altele, de faptul ca numeroase specii vegetale contin compusi naturali ce se preteaza la a fi utilizati in scop terapeutic.
Pentru o serie de plante importante din punct de vedere farmaceutic apar alte inconvienente, fie sunt endemisme, fie sunt specii pe cale de disparitie sau chiar foarte putin cunoscute si caracterizate anatomo-fiziologic de catre specialistii din domeniu. Dar, biotehnologiile moderne par sa fie rezolvarea acestor probleme majore. Biotehnologia vegetala, prin dezvoltarea tehnicilor moderne de culturi de tesuturi si celule, a initiat un larg domeniu aplicativ, deschis in directia multiplicarii si propagarii plantelor existente realizandu-se, in primul rand, scurtarea duratei de obtinere a plantelor, o economie de material biologic valoros, crearea de linii si deci de indivizi, cu o rezistenta si vitalitate sporita etc. Posibilitatea cresterii pe medii artificiale a organelor, tesuturilor si chiar a celulelor vegetale izolate a deschis, incepand cu anul 1962, noi si spectaculoase perspective in biologie; intr-o exprimare sintetica si plastica totodata, tehnicile de cultivare in vitro ofera conditii de producere in eprubeta a unui ,,lan de garoafe,, sau a unei ,,paduri de stejar" plecand de la un minuscul fragment vegetal.
SCOPUL CERCETARILOR
Prin studiul nostru, vom incerca sa contribuim la cunoasterea si caracterizarea morfologica, anatomica, fiziologica si biochimica a unei specii de plante mai putin intrata in atentia specialistilor nostri din domeniu, desi este o specie des intalnita in flora spontana a Romaniei, face parte dintr-o familie de plante - Fam. Crassulaceae - cu particularitati deosebite in ceea ce priveste metabolismul si compozitia in acizi organici si creste pe un sol neprielnic, superficial, unde rezervele de apa fluctueaza sezonier. Asadar, principalul obiectiv al lucrarii noastre il reprezinta cultivarea si cresterea pe medii artificiale a organelor, tesuturilor si chiar a celulelor provenite de la planta Sedum telephium ssp. maximum., studierea comportamentului in vitro a speciei sub influenta diferitelor concentratii si combinatii de regulatori de crestere. În tara noasta, experimentele privind tehnicile de separare a celulelor din diferite organe vegetale, sunt in stare incipienta, de aceea prin intermediul acestui studiu, vom analiza posibilitatile de separare a celulelor foliare la Crassula, prin punerea la punct a unei noi tehnici de separare mecanica a acestora.
Din punct de vedere histo - anatomic aceasta specie a fost foarte putin cercetata, asa cum rezulta mai cu seama din tratatele de sinteza asupra anatomiei dicotiledonatelor, mai vechi (SOLEREDER, 1899) sau mai noi (METCALFE si CHALK, 1950) ori asupra angiospermelor in general (NAPP-ZINN,1973, 1974), motiv pentru care ne-am propus sa efectuam si un studiu histologic al organelor vegetative (subterane si supraterane) atat la planta din natura cat si la cea obtinuta in vitro.
Plantele ornamentale, prin flori sau prin frunze, au constituit intotdeauna un motiv de bucurie pentru cel care le primeste dar si pentru cel care le daruieste. Omul, iubitor de plante ornamentale, cautat tot felul de mijloace prin care sa imbogateasca sortimentul floricol. Aparitia biotehnologiei, a produs o adevarata revolutie in procesul de ameliorare a florilor, putandu-se obtine prin mijloace moderne de lucru un numar nelimitat de exemplare, intr-un timp scurt, raportat la inmultirea acestora prin tehnici traditionale de cultura. Plantele obtinute prin biotehnologie sunt net superioare celor obtinute prin metode traditionale de inmultire sexuata, ele fiind clone libere de viroze, uneori fiind reprezentate de genotipuri mai rezistente la factorii stresanti din mediul septic de viata. . Cultivata in gradini ca specie ornamentala, Sedum maximum, este o planta ierboasa, perena, ce prezinta in pamant un rizom napiform, gros sau lung si subtire, uneori ramificat fara frunze solzoase.(fig.1). Radacinile sunt subtiri, fusiforme sau tuberculiforme. Tulpinile sunt inalte de 20-50 (70) cm., erecte, rareori ascendente, simple sau ramificate in partea superioara, glabre verzi inchis. (fig.2). Frunzele sunt carnoase, lungi de 5-13 cm. si late de 2-5 cm, plane, glabre, cele superioare opuse, ovale pana la aproape rotunde, cu baza scurta cordata, cele inferioare de obicei alterne, obovate, cu baza atenuata, sesile sau chiar scurt petiolate.(fig.3) Inflorescenta este un corimb terminal dens.(fig.4). Florile sunt hermafrodite, galbene-verzui in flora spontana, sau rozee pentru specia de cultura, pe tipul 5 (rar 4 sau 6). Fructele sunt formate din 5 folicule ingustate spre baza si terminate cu un varf ascutit. Semintele sunt lunguiete, au 1-2 mm lungime, de culoare cafenie.


Fig. 1- Rizom de Sedum maximum Fig. 2- Tulpina la Sedum maximum


Fig. 3- Frunza la Sedum maximum Fig. 4- Inflorescenta la Sedum maximum


Fig. 5- Sedum maximum in natura Fig 6. - Sedum maximum cultivat
Aria de raspandire: originara din Peninsula Kamceatka.
În judetul Arad, o intalnim spontan prin: paduri de foioase, Ghioroc, Lipova, Grosii Mari, Joia Mare, Debela Gora, Ilteu, Capruta- Dimbovita, Cladova, Odvos-Conop, Casoaia, Taut, Soimos, Radna, Dl. Magura, Dl. Peter si Tornitcum, Vl.Milova, Vl. Jernova, Halmagiu, Bontesti, Vl. Deznei.
Pe plan national, nu a existat pana in momentul de fata o preocupare deosebita legata de inmultirea rapida a acestei specii, prin folosirea tehnologiei de micropropagare "in vitro" a acesteia. Prin schimbarea concentratiilor nutritionale si hormonale, in mediul in care se afla cultivate explantele de Sedum maximum si prin ajustarea conditiilor de cultura, intentionam sa elaboram tehnologia sa de micropropagare in vitro pe baza observatiilor in urma experimentelor pe parcursul anilor de studiu.
Plantele medicinale si-au recapatat locul cuvenit intre remediile curative ale lumii moderne. Totusi, din cele peste 620 000 de plante: arbori, arbusti, plante ierboase, etc. care acopera pamantul nostru, numai 300 sunt plante medicinale folosite in fitoterapie.
Poate ca astazi, mai mult ca oricand, nu mai avem timp sa acordam importanta cuvenita unor astfel de probleme, sau sa ne reamintim ce ne pot oferi plantele medicinale. De aceea in aceasta lucrare vom incerca sa aducem si cateva argumente si dovezi cu privire la proprietatile curative ale plantei Sedum maximum (L) Hoffm. (fig.1) si posibilitatea utilizarii ei in terapie. Din medicina traditionala a altor popoare amintim cativa autori care mentionata compozitia chimica a plantei si utilizarea ei:
Ø G. Gastaldo - frunzele recoltate in mai-iulie contin: mucilagii, resine, principii amare, pectina, substante grase, saruri organice. Sunt utilizate ca astringente, cicatrizante, emoliente si epitelizante in toate cazurile de ulceratii cutanate.
Ø Combier H., M. Jay. - planta contine: leucoantociani totali, leucodelphinidine, leucocianidine; flavonoide totale, kemferol.
În medicina traditionala romaneasca acestei plante i se atribuie efecte vulnerare, antiseptice si cicatrizante, fiind utilizata in dureri de urechi si picioare, seva frunzelor proaspete se storcea in urechi contra durerilor, de aici si denumirea populara de " iarba de urechi" sau " urechelnita".
Ø Frunzele sau planta intreaga sunt utilizate doar extern, in urmatoarele afectiuni:
- Pentru tratarea paraliziei si a parezelor nervilor periferici
- Pentru tratarea hemoroizilor, ranilor si arsurilor, unguente.
- Pentru scoaterea bataturilor (clavus) se fac cataplasme, din frunze proaspete.
ØRizomul este utilizat intern pentru tratarea cancerului. Se foloseste extractul alcoolic obtinut din rizomii proaspeti ai plantei scosi din pamant.
Desi nici o alta specie in afara de Sedum acre L. nu a fost studiata atat de intensiv in privinta alcaloizilor, s-a presupus , pe baza observatiilor facute, ca majoritatea speciilor de Crassulaceae ar sintetiza cel putin cantitati infime de alcaloizi.
Se stie de mult timp ca speciile familiei Crassulaceae acumuleaza cantitati apreciabile de acizi organici si ca acestea prezinta variatii mari intre noapte si zi: noaptea acumuleaza cantitati mari, iar ziua continutul scade drastic.Aceasta particularitate a preocupat multi cercetatori din domeniul fiziologiei plantlor, ceea ce se reflecta in numarul mare de lucrari publicate in domeniul asa numitului ,,metabolism acidic al crasulaceelor,,(Crassulacean Acid Metabolism-CAM).
Inducerea metabolismului acizilor in cadrul acestei familii, este considerata ca fiind un raspuns la stressul cauzat de lipsa apei. Ritmicitatea desfasurarii metabolismului endogen al acizilor, este sincronizata permanent cu alternanta dintre zi si noapte si conditiile de mediu. De exemplu, Sedum telephium L. este o specie care creste pe un sol neprielnic, superficial, pe roci calcaroase,unde rezervele de apa fluctueaza sezonier. În conditiile in care planta are suficienta apa, nu se observa modificari semnificative in activitatea nocturna de asimilatie. În conditii de seceta, reducerea continutului relativ de apa este urmata de cresterea asimilatiei nocturne, datorita intensificarii metabolismului acizilor. Într-un studiu comparativ efectuat pe opt specii de Sedum, s-a descoperit ca, in timpul noptii au crescut concentratiile de malat si izocitrat iar concentratia de citrat a ramas neschimbata in frunzele speciei Sedum telephium.
În tesuturile crassulaceelor se gaseste un amestec de acizi organici format din acid citric, izocitric, malic,succinic, fumaric, tartric, etc; acidul oxalic se gaseste numai sub forma de saruri (nisip de oxalat de calciu). În amestecul de acizi, acidul izocitric domina cantitativ, dar variatiile zilnice ale continutului in acizi totali se datoreaza practic, aproape in totalitate, acidului malic. Acesta se comporta ca un metabolit activ (se formeaza peste noapte si se metabolizeaza peste zi). În schimb, acidul izocitric se comporta ca un metabolit secundar. Acumularea masiva de acid izocitric si peridiocitatea formarii si descompunerii acidului malic sunt comune tuturor crasulaceelor si au valoare taxonomica
RAMSTAD si LIEBERMAN (1955) presupun ca la crassulacee nu functioneaza ciclul Krebs ( al acizilor tricarboxilici) datorita lipsei de aconitaza; in locul acestei enzime crasulaceele ar poseda un ciclu al acizilor dicarboxilici. Se pare ca acidul izocitric si citric (acidul aconitic lipseste) se formeaza pe alta pe alta cale decat cea a ciclului Krebs.
Surprinzator la Crassulaceae este numai ,,metabolismul acidic,, diferit de alte familii ci si metabolismul glucidic aberant, ce se manifesta prin acumulare masiva de sedoheptuloza. Aceasta se comporta ca si acidul izocitric, fiind un metabolit secundar. Acumularea acestei heptoze reprezinta o caracteristica a familiei Crassulaceae. Alaturi de sedoheptuloza, speciile mai contin glucoza, fructoza si zaharoza.
Paris si Frigot ( 1959,1960) au aratat ca speciile de Sedum acre L.,Sedum album L., Sedum altissimum Poir si Sedum telephium L.contin amestecuri complexe de flavonoide.
KOESNIKOW si colab.(1940) izolat pentru prima data un alcaloid din Sedum acre L. si l-a denumit sedamina.Ulterior s-au izolat si alti alcaloizi, derivati ai piperidinei, cum ar fi nicotina ,izopelletierina ,sedridina , sedinina, sedinona.
Frunzele numeroaselor Crassulacee sunt acoperite cu un strat de ceara.
Baker si colab. au identificat in ceara de Aeonium o diterpena de tip labdan cu 2 grupari hidroxil.
BRIDEL ( 1922) a obtinut din 8 kg radacini proaspete de Sedum telephium L. 4,5 g glicozida amorfa care in urma hidrolizei cu emulsina s-a dedublat in glucoza si intr-un compus volatil cu miros de geraniol. Un compus identic sau asemanator se gaseste in cantitati foarte mici de asemenea in frunze si tulpini de Sedum telephium L.
CERCETARI PROPRII
EXPERIMENTUL 1
MATERIAL SI METODA
Selectarea corecta a materialului biologic reprezinta un factor decisiv, din punct de vedere ale calitatilor naturale pe care le detin celulele viitorilor fitoinoculi, intrucat procedurile de asepsizare pot afecta profund vitalitatea si capacitatea regenerativa a celulelor sau tesuturilor fitoinoculilor. Pentru asigurarea acuratetei rezultatelor cercetarii, este necesar ca materialul vegetal utilizat sa fie de provenienta cunoscuta, pentru existenta
unei certitudini in ceea ce priveste taxonul cu care urmeaza a se lucra, puritatea genetica a acestuia, dar si faptul ca materialul vegetal nu este contaminat. În scopul asigurarii si a mentinerii acestor cerinte, pentru inceput, in laboratorul de Biotehnologie vegetala, am creat o fitobaza de vitroplantule de Sedum maximum, prin cresterea aseptica, pe mediul mineral standard Murashige-Skoog (1962).
Pentru initierea primei vitroculturi de Sedum maximum am colectat lastari de la plante cultivate in ghivece cu pamant, rezultate in urma germinarii septice din seminte procurate din stocul Gradinii Botanice " Anastasie Fatu" din Iasi. Acesti lastari au fost sterilizati dupa metoda de asepsizare mentionata mai jos, li s-au indepartat frunzele mai mari si portiunile afectate de solutia dezinfectanta, dupa care au fost fragmentati in minibutasi apicali, intermediari si mediani de cca.1 cm.
Metoda de sterilizare a fost urmatoarea:
În perimetrul hotei cu flux laminar de aer steril, in conditii aseptice,am indepartat partile necrozate, albite in urma sterilizarii, precum si radacinitele prezente la nivelul materialului vegetal axenic. Apoi am trecut la inocularea "in vitro" in contact direct cu suprafata mediilor de cultura.
Substratul de cultura a fost constituit din mediu de baza (MB) Murashige-Skoog (MS) (1962) (MB - MS) care a constat din macroelemente si Fe EDTA, microelemente Heller, amestec mineral la care au fost adaugate vitaminele: piridoxina HCl, tiamina HCl si acid nicotinic (cate 1 ml/l fiecare), m - inozitol 100 mg/l, zaharoza 30 g/l, agar-agar 7 g/l, pH-ul fiind reglat la valoarea de 5,8, prealabil asepsizarii acestuia. dar nu numai pe mediul standard amintit, care in cadrul cercetarilor a fost considerat varianta experimentala martor (V0), ci si pe medii de cultura avand compozitii modificate de noi prin adaugarea de regulatori de crestere (auxine si citochinine), respectiv benziladenina si acid β-indolilbutiric. Variantele astfel constituite au fost:
V0- varianta martor pe mediu Murashige-Skoog lipsit de regulatori de crestere
V1- varianta experimentala pe mediu Murashige-Skoog cu BA in concentratie de 1 mg/l
V2- varianta experimentala pe mediu Murashige-Skoog cu AIB in concentratie de 1 mg/l
V3- varianta experimentala pe mediu Murashige-Skoog cu BA in concentratie de 1 mg/l si AIB in concentratie de 1 mg/l.
Sterilizarea mediilor de cultura, portionate fiind in
recipiente de 8 x
Dupa inoculare, recipientele cu explante (obturate cu folie de polietilena, imobilizate la gura flacoanelor cu elastice) au fost trecute pe rafturi, la o temperatura care a variat intre 22-25ºC si o fotoperioada de 16 ore lumina / 24h, intensitatea luminoasa fiind de cca. 1500-1700 lucsi, lumina emisa de tuburi fluorescente albe.
Iluminarea acestora s-a facut la intervale de 8 ore lumina si 16 ore de noapte.
Dupa 4 saptamani de la initierea vitroculturii de Sedum maximum pe medii agarizate s-au efectuat biometrizari, respectiv observatii ochiometrice periodice si fotografierea aspectelor celor mai importante.
Valorile biometrice medii, obtinute la diferite variante experimentale, au fost raportate la dimensiunile obtinute la parametrii similari biometrizati la plantulele apartinatoare variantei martor, valori considerate de referinta, drept 100%; aceste calcule au condus la evaluarea in valori procentuale, a evolutiei vitroplantulelor de Sedum maximum, in functie de provenienta lor, sub raportul naturii regulatorilor de crestere care au fost prezenti in cursul vitroevolutiei.
Prin biometrizari s-a urmarit capacitatea de organogeneza a vitroplantulelor, in conditiile de crestere impuse. S-au urmarit, astfel:
lungimea tulpinitei
numar ramificatii
lungime ramificatii
numar radacinite
lungime radacinite
numar frunzulite.
Toate experimentele s-au efectuat printr-o raportare a datelor rezultate la diferitele variante, la loturi de referinta (martor) si valorile obtinute au fost prelucrate conform normelor de matematica statistica.
În acest experiment, minibutasii colectati de la planta mama, in luna martie, dupa asepsizarea acestora in conditii aseptice, s-au inoculat "in vitro", cate 5 explante / varianta, pe un mediu de cultura MS, cu adaos de regulatori de crestere, pentru a aduce - la nivelul acestora - formarea de radacinite si tulpinite.
REZULTATE SI DISCUTII
Dupa 4 saptamani de la inoculare s-au facut observatii la nivelul vitroplantulelor regenerate, biometrizandu-se: lungimea tulpinitelor regenerate din fragmentele de lastari, formarea de ramificatii, numarul si dimensiunea frunzulitelor, numarul si lungimea medie a radacinitelor.
.

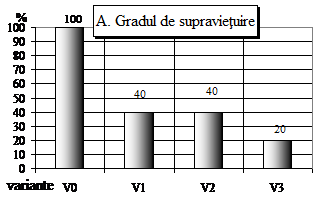
Fig.7 - Evolutia comparativa a vitroplantulelor de Sedum sp., la 12 saptamani de la inoculare "in vitro" pe medii de cultura MS (1962) simplu si cu diferiti regulatori de crestere, unde: inoculii variantelor V0 - mediu martor (lot control) - lipsit de regulatori de crestere, V1 - mediu MB-MS cu 1 ml/l BA; V2 - mediu MB-MS cu 1 ml/l AIB; V3 - mediu MB-MS cu 1 ml/l BA si 1 ml/l AIB, valori fiind exprimate in valori procentuale obtinute in raport cu valorile biometrizate la vitroplantulele lotului martor (V0), valori considerate ca 100%.
Tabel 1 - Biometrizarile efectuate la Sedum maximum dupa 30 de zile de la initierea vitroculturii
|
Variante |
V1 |
V2 |
V3 |
||
|
Numar plantute |
1 |
2 |
1 |
2 |
1 |
|
Numar tulpinite | |||||
|
Lungime tulpinite | |||||
|
Numar ramificatii |
| ||||
|
Lungime ramificatii | |||||
|
Numar frunzulite | |||||
|
Dimensiune frunzulite | |||||
|
Numar radacinite | |||||
|
Lungime radacinite | |||||
V0 V1 V2 V3
|
|
 V0 V1 V2 V3
V0 V1 V2 V3
V0 V1 V2 V3
V0 V1 V2 V3
|
|
|
 E
E
V0 V1 V2 V3
V0 V1 V2 V3
|
|
|
 G
G
V0 V1 V2 V3
V0 V1 V2 V3
|
|
|
 I
I
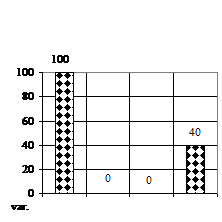
Gradul de supravietuire (fig. 1A) la Sedum sp. la 30 de zile a prezentat numai deficite fata de lotul martor, datorita numarului mare de infectii ce au aparut de la initierea culturii respective.
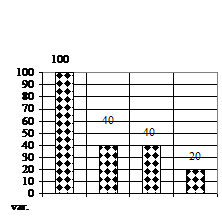
Numarul de tulpinite (fig. 1B) a prezentat doar deficite, deoarece numarul acestor vitroplantule era foarte mic, astfel, cele mai multe vitroplantule s-au obtinut doar pe variantele V1 (mediu MB - MS cu 1 ml/l BA) si varianta V2 (mediu MB - MS cu 1 ml/l AIB), acestea prezentand un deficit de 60% fata de V0.
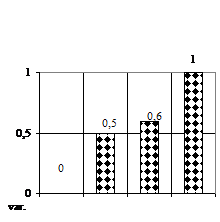
Lungimea medie a tulpinitelor (fig. 1C) a prezentat de asemenea doar deficite fata de lotul martor, unde cele mai apropiate valori le-am obtinut pe varianta V2 (mediu MB - MS cu 1 ml/l AIB), vitroplantulele atingand o lungime maxima de 2,4 mm, respectiv varianta V3 (mediu MB - MS cu 1 ml/l BA + 1 ml/l AIB) lungimea tulpinitelor atingand 3,1 mm.
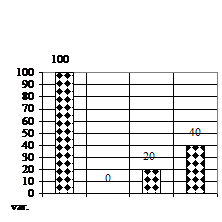
Numarul de ramificatii (fig. 1D) a prezentat numai deficite pe varianta V2 (mediu MB - MS cu 1 ml/l AIB) formand cate o ramificatie si un deficit de 60% fata de V0 (mediu MB - MS lipsit de regulatori de crestere).
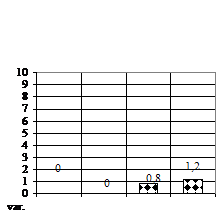
Lungimea medie a ramificatiilor (fig. 1E) a vitroplantulelor de Sedum maximum. a variat, astfel cele mai lungi ramificatii am obtinut pe varianta V3 (mediu MB-MS cu 1 ml/l BA si 1 ml/l AIB) cu ramificatii de 1,2 mm lungime, respectiv pe varianta V2 (mediu MB - MS cu 1 ml/l AIB) cu ramificatii de 0,8 mm.
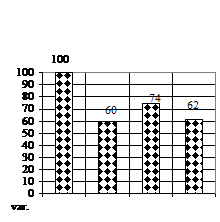
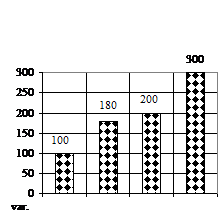
În ceea ce priveste numarul de frunzulite (fig. 1F) a prezentat doar sporuri, deoarece pe toate variantele experimentale, caulogeneza a avut loc, maximele sporuri obtinute pe varianta de cultura V3 (mediu MB-MS cu 1 ml/l BA si 1 ml/l AIB) cu un spor de 200%, respectiv pe varianta V2 (mediu MB - MS cu 1 ml/l AIB) cu un spor de 100%.
Dimensiunea medie a frunzei (fig. 1G) a variat de asemenea pe toate variantele experimentale, maximele remarcandu-se pe varianta de cultura V3 (mediu MB-MS cu 1 ml/l BA si 1 ml/l AIB).
Rizogeneza neavand loc pe variantele de cultura V1 (mediu MB - MS cu 1 ml/l BA) si varianta V2 (mediu MB - MS cu 1 ml/l AIB), doar la 90 de zile, numarul de radacinite (fig. 1H) a prezentat numai deficite pe varianta V3 (mediu MB-MS cu 1 ml/l BA si 1 ml/l AIB) si anume de 60% fata de V0, iar lungimea radacinitelor pe V3 a fost de 2 mm.
CONCLUZII
Conform cercetarilor efectuate, s-a dovedit ca desi Sedum telephium L.ssp.maximum este o specie sensibila, initierea s-a realizat cu succes, iar mediul recomandat pentru initierea acestei vitroculturi de Sedum este mediul de baza MS-MB imbogatit cu AIB si BA, semisolid. Pe acest mediu vitrocultura noastra a avut o evolutie foarte buna, prezentand si rizogeneza in comparatie cu celelalte variante de mediu.
EXPERIMENTUL 2
MATERIAL SI METODA
În vederea cercetarii din punct de vedere histo-anatomic, materialul reprezentat de organele vegetative (subterane si supraterane) ale speciei Sedum telephium ssp. maximum, cultivata in vitro pe varianta de mediu V3 obtinuta anterior, respectiv pe mediu Murashige-Skoog imbogatit cu AIB + BA 1 mg/l care a prezentat si rizogeneza, cat si ale celei din natura cultivata in ghiveci cu pamant, a fost supus mai multor etape:
1. Fixarea si conservarea materialului proaspat s-a realizat in alcool etilic 70%.
2. Sectionarea s-a realizat manual, cu ajutorul microtomului de mana si al briciului botanic, folosind drept suport maduva de soc.
3. Sectiunile obtinute au fost supuse procesului de javelizare (cu hipoclorit de sodiu) timp de 20-35 minute, dupa care au fost spalate cu apa acetica si cu apa distilata.
4. Sectiunile au fost colorate apoi prin dubla coloratie, si anume: verde iod si rosu rutheniu (coloratie utilizata in studiile de histo-anatomie vegetala). Sectiunile au fost colorate mai intai cu verde iod (1 minut), spalate cu alcool etilic 90%, iar apoi colorate cu rosu rutheniu (1 minut) si spalate cu apa distilata.
5. Sectiunile colorate au fost montate in picaturi de glicero-gelatina, intre lama si lamela, realizand astfel preparate permanente.
6. Dupa preparatele astfel obtinute s-au realizat desene la microscopul fotonic romanesc MC1, cu oglinda de proiectie (Projektionszeichenspiegel), precum si fotografii color la microscopul fotonic NOVEX (HOLLAND), cu camera foto digitala Canon A540.
REZULTATE SI DISCUTII
În cazul sectiunilor obtinute din Sedum maximum cultivat in ghivece cu pamant ( mediu septic de viata), in structura anatomica a fiecarui organ vegetativ, s- au observat urmatoarele:
1. Radacina
Într-o sectiune transversala se observa o periderma din care au mai ramas 4-6 straturi de celule turtite, cu pereti subtiri. Scoarta este compacta, groasa, nefiind diferentiata in cele 3 zone cunoscute (exoderma, parenchim cortical, endoderma), formata din 10-12 straturi de celule cu pereti subtiri, celulozici, intre care se observa meaturi de dimensiuni diferite. Pe alocuri sunt prezente celule in care se observa pereti de diviziune.
Cilindrul central este compact, reprezentat de 7-8 fascicule lemnoase, formate din vase cu pereti lignificati, dar slab ingrosati si 8 grupuri de insule liberiene mici, formate din putine elemente (tuburi ciuruite si celule anexe, cu pereti celulozici).
2. Rizomul
În sectiune transversala, rizomul prezinta la exterior o periderma relativ groasa, din care cel mai bine se observa suberul format din celule tabulare; pe alocuri acesta este exfoliat, chiar cu unele parti din parenchimul cortical.
Scoarta nu este diferentiata, ci se observa doar parenchimul cortical, amilifer, format din celule cu pereti subtiri, celulozici.
Cilindrul central este gros, cu numeroase fascicule libero-lemnoase dispersate neuniform in parenchimul fundamental. Vasele lemnoase au peretii lignificati, dar relativ slab ingrosati; aceastea sunt fie dispersate, fie grupate. Elementele liberiene reprezentate de tuburi ciuruite si celule anexe sunt grupate in insule mici. Pe alocuri se observa raze medulare inguste formate din celule poligonale alungite.
3. Tulpina aeriana
Conturul sectiunii este circular-oval.
- Într-o tulpina tanara epiderma este formata din celule mari, cu peretele extern bombat si acoperit cu o cuticula subtire. Scoarta este densa, formata din 10-12 straturi de celule ce lasa intre ele meaturi mari sau chiar lacune.
Cilindrul central este un inel compact format, relativ gros, reprezentat de 6-7 fascicule libero-lemnoase de tip colateral-inchis, de diferite dimensiuni. Lemnul cuprinde vase lemnoase de diametru mic, cu pereti slab ingrosati si nelignificati, iar insulele liberiene contin tuburi ciuruite si celule anexe. Parenchimul medular cuprinde celule mari, cu pereti celulozici, ce lasa meaturi intre ele.
- Într-o tulpina mai groasa, epiderma este suberificata, formata din 2-3 straturi de celule, cu pereti mai ingrosati. Scoarta este densa, cu numeroase straturi de celule.
Cilindrul central cuprinde fascicule libero-lemnoase de diferite dimensiuni; lemnul prezinta vase lemnoase cu pereti lignificati si ingrosati, iar liberul cuprinde tuburi ciuruite si celule anexe. Maduva este asemanatoare celei prezente la tulpina tanara.
4. Frunza
a. Petiolul
Are forma de semiluna in sectiune transversala. Epiderma cuprinde celule aproape izodiametrice, cu peretele extern bombat si acoperit de o cuticula subtire. Parenchimul fundamental este omogen, format din celule de dimensiuni diferite, cu pereti subtiri, celulozici. Se observa trei fascicule conducatoare libero-lemnoase de tip colateral inchis, cel median fiind mai mare. Lemnul cuprinde vase cu pereti ingrosati, celulozici, iar liberul este format din tuburi ciuruite si celule anexe.
b. Limbul foliar
Epiderma vazuta de fata:
Epiderma superioara prezinta celule cu pereti ondulati, intre care se observa numeroase stomate de tip anizocitic (stomate inconjurate de 3 celule, de dimensiuni diferite). Epiderma inferioara prezinta si ea celule cu pereti ondulati, dar ondulatiile au o amplitudine mai mare decat in epiderma superioara; si aici sunt prezente stomate de tip anizocitic, deci limbul este amfistomatic.
Într-o sectiune transversala prin limb, se observa o epiderma formata din celule mari, cu peretele extern mai bombat, acoperit de o cuticula subtire. Mezofilul frunzei este nediferentiat, omogen, deci frunzele au o structura bifaciala-izofaciala cu dorsiventralitate normala. Sunt prezente cateva fascicule conducatoare libero-lemnoase, cel median fiind mai mare, apartinand nervurii mediane. Lemnul cuprinde vase lemnoase cu pereti ingrosati, dar nelignificati, iar liberul cuprinde tuburi ciuruite si celule anexe.
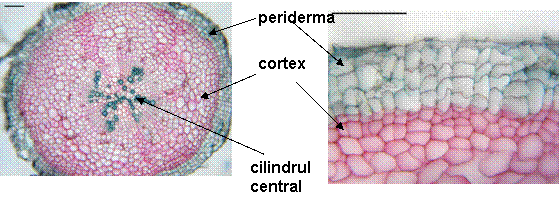

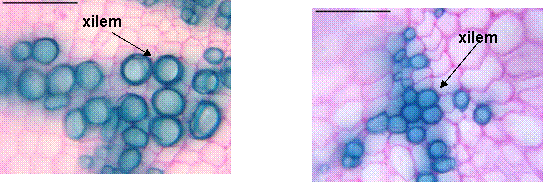
Fig. 8- Structura anatomica a radacinii mature de Sedum telephium ssp.maximum din natura
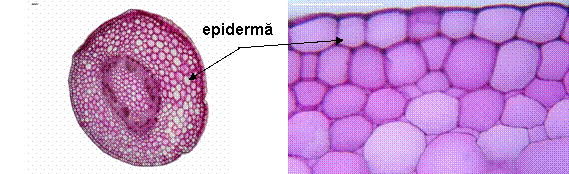
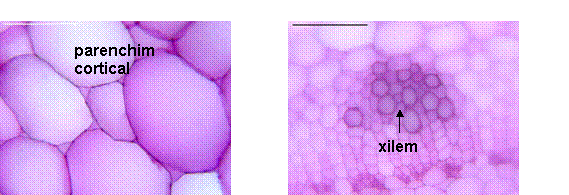
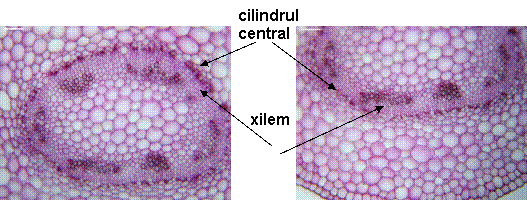
Fig. 9- Structura anatomica a tulpinii tinere de Sedum telephium ssp. maximum din natura
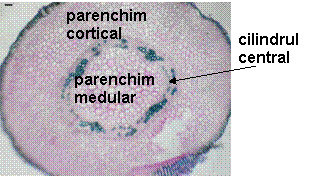
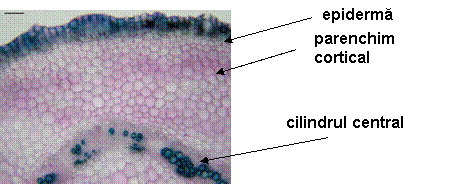
Fig. 10- Structura anatomica prin tulpina matura de Sedum telephium ssp. mximum
REZULTATE SI DISCUTII NR 2.
În cazul sectiunilor obtinute din Sedum maximum vitrocultivat ( mediu aseptic de viata), in structura anatomica a fiecarui organ vegetativ, s- au observat urmatoarele:
1. Radacina
Într-o sectiune transversala prin radacina se observa la exterior o periderma formata din mult suber cu celule cu pereti tabulari. Scoarta este amilifera, groasa, formata din celule cu pereti subtiri, celulozici.
Cilindrul central cuprinde 3-4 fascicule lemnoase cu putine vase, avand pereti lignificati si slav ingrosati. Insulele liberiene sunt numeroase, dar foarte mici. Cambiul este gros, format din cateva straturi de celule ce urmeaza sa se diferentieze in totalitate.
2. Tulpina
Prezinta un contur circular. Epiderma cuprinde celule inalte, cu peretele extern bombat. Scoarta este nediferentiata, cuprinzand 6-8 straturi de celule mari, poligonale, ce lasa intre ele meaturi de dimensiuni diferite. Cilindrul central cuprinde 4-5 fascicule conducatoare libero-lemnoase: lemnul prezinta vase cu pereti lignificati si ingrosati, iar elementele liberiene sunt grupate in insule mici. Parenchimul medular este reprezentat de celule mari poligonale. Se observa si cambiul format din celule mici, alungite tangential.
3. Frunza
a. Petiolul
Are forma de semiluna in sectiune transversala, cu partea adaxiala mai plana. Epiderma cuprinde celule cu peretele extern bombat. Parenchimul fundamental este omogen, reprezentat de celule de dimensiuni diferite, cu pereti subtiri, celulozici. Se observa trei fascicule conducatoare libero-lemnoase de tip colateral inchis, cel median fiind mai mare. Lemnul cuprinde mai putine vase decat la exemplarele din natura, cu pereti ingrosati, celulozici, iar liberul este format din tuburi ciuruite si celule anexe.
b. Limbul foliar
Epiderma vazuta de fata:
Epiderma superioara prezinta celule cu pereti ondulati, intre care se observa numeroase stomate de tip anizocitic (stomate inconjurate de 3 celule, de dimensiuni diferite). Epiderma inferioara prezinta si ea celule cu pereti ondulati, dar ondulatiile au o amplitudine mai mare decat in epiderma superioara; si aici sunt prezente stomate de tip anizocitic, deci limbul este amfistomatic. În ambele epiderme se pot observa chiar celule in diviziune, urmarindu-se astfel formarea stomatelor.
Într-o sectiune transversala prin limb, epiderma apare formata din celule mari, cu peretele extern mai bombat, acoperit de o cuticula subtire. Mezofilul frunzei este nediferentiat, omogen, deci frunzele au o structura bifaciala-izofaciala cu dorsiventralitate normala. Fascicule conducatoare libero-lemnoase sunt de dimensiuni diferite, cel median fiind mai mare, apartinand nervurii mediane. Lemnul cuprinde vase lemnoase cu pereti ingrosati, dar nelignificati, iar liberul cuprinde tuburi ciuruite si celule anexe.
In vitro

Fig. 11- Structura anatomica a radacinii de Sedum telephium ssp. maximum vitrocultvat
![]()
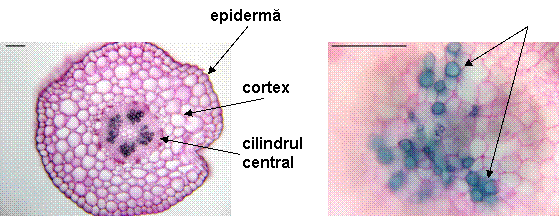
Fig. 12- Structura anatomica a tulpinii de Sedum telephium ssp. maximum vitrocultivat
![]()
![]()
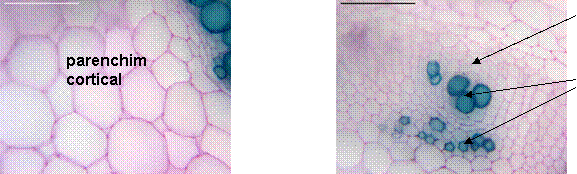
Fig. 13- Parenchimul cortical si cilindrul central al radacinii de Sedum telephium ssp. maximum vitrocultivat

Fig. 14- Cilindrul central al tulpinii de Sedum telephium ssp. maximum vitrocultivat
Planta din natura
Sectiuni transversale prin radacina
Sectiuni transversale prin tulpina tanara
Sectiuni transversale prin tulpina matura
Planta din natura
Sectiuni transversale prin radacina
Sectiuni transversale prin tulpina tanara
Bar = 100 μm
CONCLUZII
La o analiza histo-anatomica a exemplarelor din natura si a celor obtinute in vitro de la specia Sedum telephium ssp. maximum, s-a observat un inceput de structura secundara la nivelul radacinii, protejata la exterior de o periderma relativ subtire. În cilindrul central sunt prezente fascicule lemnoase si liberiene mai putine la exemplarele in vitro; elementele liberiene sunt grupate in insule mici, atat la cele in vitro cat si la cele din natura. Tulpina cuprinde cateva fascicule libero-lemnoase in care lemnul contine vase cu pereti ingrosati si lignificati. Petiolul prezinta 3 fascicule conducatoare libero-lemnoase. Limbul este amfistomatic, cu stomate de tip anizocitic atat la exemplarele in vitro cat si la cele din natura, cu un mezofil omogen. În concluzie, din punct de vedere histo- anatomic nu exista mari diferente intre planta cultivata in vitro si cea din natura, asadar regulatorii de crestere (AIB si BA) din mediul Murashige- Skoog in concentratia folosita de 1mg/l nu au indus mari modificari in structura organelor de Sedum telephium ssp. maximum vitrocultivat. Datorita acestui fapt, am considerat, ca in urmatoarele experimente va fi necesar sa initiem o alta cultura in vitro pe aceeasi varianta de mediu dar de concentratii diferite de AIB si BA si vom analiza din nou histo- anatomic exemplarele in comparatie cu cele din natura.
EXPERIMENTUL 3
MATERIAL SI METODA
În cadrul acestui experiment, am infintat a doua serie de vitroculturi de Sedum maximum pornind de la seminte ajunse in faza de maturitate. Pentru asepsizare, ele au fost introduse intr-o solutie de hipoclorit de sodiu 0,1%, diluata cu apa sterila in raport de 1:2, la care s-a adaugat Tween 20 (2-3 picaturi la 150 ml solutie dezinfectanta). În aceasta solutie, semintele au fost mentinute timp de 10 minute, dupa care au urmat repetate spalari cu apa distilata sterila, pentru a indeparta ioni de clor de la suprafata tegumentului seminal.
Semintele asepsizate au fost trecute in capsule Petri, sterile, amplasate fiind pe hirtie de filtru axenica. În hota cu flux laminar de aer steril, in incinta aseptica, au fost prelevate semintele axenizate in prealabil si au fost inoculate, pentru a fi germinate, pe un mediu de baza (MB) mineral Murashige-Skoog (1962), modificat de noi, la care s-au adaugat vitaminele:piridoxina HCl, tiamina HCl si acid nicotic (cite 1 mg/l fiecare), mezo-inozitol-100 mg/l , lipsit de regulatori de crestere, precum si a 20g/l zaharoza (in loc de 30 g/l) si agar 7 g/l ( in loc de 10g/l).
Prealabil asepsizarii mediului de cultura, pH-ul mediului a fost reglat la valoarea de 5,8, cu acid citric sau cu NaOH. Mediul de cultura a fost introduse intr-un vas Pirex si autoclavat la 1210 , timp de 24 minute. În perimetrul hotei cu flux laminar de aer steril, mediul a fost repartizat in cutii Petri de sticla incolora, cu diametrul de 10 cm, continand cate 10 ml mediu de cultura. Dupa racirea recipientelor cu medii, s-a trecut la operatiunea de inoculare a semintelor, in conditii aseptice, in hota. Dupa inoculare, acestea au fost trecute pe rafturi iluminate cu lumina fluorescenta timp de 16 ore lumina pe zi. Temperatura ambientala a variat intre 22-24°C ziua si circa 20°C noaptea.
A B


Fig. 15- Seminte de Sedum maximum germinate pe mediul de baza Murashige- Skoog in vase Petri la 7 zile de la inoculare


Fig. 16- Plantule de Sedum maximum germinate pe mediul de baza Murashige- Skoog in vase Petri la 15 de zile de la inoculare


Fig. 17- Plantule de Sedum maximum germinate pe mediul de baza Murashige- Skoog in vase Petri la 4 saptamani de la inoculare
Dupa 4 saptamani de la inocularea semintelor pe mediu de baza Murashige-Skoog (1962) (MB-MS), acestea au germinat, dezvoltandu-se tufe de plantule cu talia de 2- 4 cm fiecare. Aceste plantule cu tot cu radacinita au fost, apoi, subcultivate pe medii aseptice, cu balante hormonale variate. Plantulele au fost inoculate pe mediu de baza Murashige-Skoog (1962) (MB-MS), cu compusi anorganici introdusi potrivit retetei originale, dar cu compusi organici modificati de noi, fie eliminand total regulatorii de crestere (mediu martor = varianta V0) si glicina, dar adaos de FeEDTA (dupa reteta Murashige-Skoog (MS)-(1962), precum si a 20g/l zaharoza (in loc de 30 g/l), vitamine (tiamina HCl, piridoxina HCl si acid nicotinic, cate 1 mg/l, in loc de 0,5 mg/l), mezo-inozitol 100 mg/l si agar 7 g/l; la acest mediu de baza (MB), au fost adaugati variati regulatori de crestere, in conformitate cu schema experimentala urmarita in fiecare experiment.
Mediile de cultura, au fost repartizate in flacoane cilindrice cu inaltimea de 13,5 cm si diametru de 4 cm (volum de 176 cm3). Flacoanele cu medii au fost sterilizate prin autoclavare la temperatura de 121°C, timp de 23 de minute. Dupa racirea flacoanelor cu medii de cultura s-a procedat la inocularea explantelor.
Variantele experimentale constituite au fost:
V0- varianta martor cu plantule subcultivate pe mediu MS lipsit de regulatori de crestere.
V1- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l BA.
V2- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l ANA.
V3- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l AIB.
V4- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l BA + 1mg/l AIB.
Incubarea si cresterea vitroculturilor s-a facut prin expunerea acestora la lumina alba, fluorescenta, cu o intensitate de 1700 lucsi, in regim fotoperiodic de 16 ore lumina / 24 ore, asezate fiind pe rafturi (culturile aflandu-se situate la 38 cm distanta de sursa de lumina). Temperatura ambientala a variat intre 26°C ± 2°C in faza de lumina si de 22°C ± 2°C, in perioada de intuneric.
REZULTATE SI DISCUTII
Din analiza datelor biometrice inregistrate la 30 de zile de la subcutivarea explantelor, privind evolutia materialului vegetal utilizat in initierea de vitroculturi de Bak a rezultat faptul ca, la vitroculturile la, s-a observat ca pe mediul de cultura MS, pe varianta V4 (MB cu amestec de 1mg/l AIB + BA), din a rezultat cate o radacinita adventiva, cu lungimea medie de 1-3 cm, , in raport cu talia primei radacinite identificata la varianta martor V0.
În ceea ce priveste cea mai mare lungime atinsa la nivelul ramificatiilor crescute pe tulpinita, inoculii, pe varianta V3, a marcat valori medii superioare martorului (V0).
Pe mediul martor (V0) (MB-MS) lipsit de regulatori de crestere, inoculii s-au alungit, dar foarte putin, in timp ce pe mediul corespunzator variantei V3, cu 1mg/lBA a ramas la aceeasi dimensiune.La culturile initiate, numarul mediu de ramificatii a prezentat o evolutie asemanatoare la toate variantele.
Tabel 2 - Biometrizarile efectuate la Sedum maximum dupa 30 de zile de la subcultura pe cele 4 variante de mediu Murashige- Skoog imbogatit cu regulatori de crestere
|
Varianta |
Vo |
V1 |
V2 |
V3 |
V4 |
|
Numar tulpinite | |||||
|
Lungime tulpinite | |||||
|
Numar ramificatii | |||||
|
Lungime ramificatii | |||||
|
Numar frunzulite | |||||
|
Dimensiune frunzulite | |||||
|
Numar radacinite | |||||
|
Lungime radacinita embrionara | |||||
|
Lungime radacinite advenive |
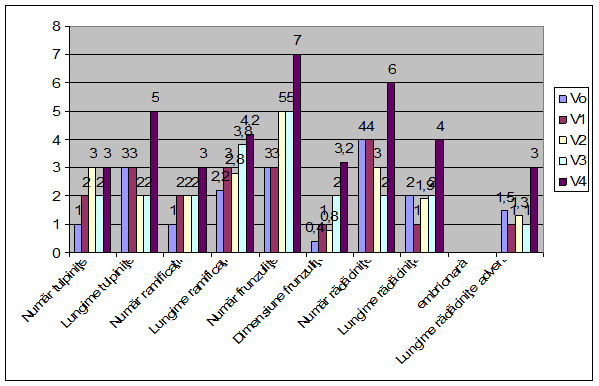 Fig. 18- Biometrizari
efectuate la nivelul inoculilor de Sedum
maximum constand din explante subcultivate pe mediu Murashige-Skoog
(1962) imbogatit cu regulatori de crestere la 30 de zile
de la inoculare.
Fig. 18- Biometrizari
efectuate la nivelul inoculilor de Sedum
maximum constand din explante subcultivate pe mediu Murashige-Skoog
(1962) imbogatit cu regulatori de crestere la 30 de zile
de la inoculare.
A B 

C D 

E F


Fig. 19 A- F. Evolutia vitroplantulelor la 4 saptamani de la subcultivare pe mediu MS lipsit de regulatori de crestere (V0) si imbogatit cu regulatori de crestere, respectiv:
V1- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l BA (fig.A,B).
V2- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l ANA (fig.C).
V3- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l AIB (fig. D).
V4- varianta experimentala cu plantule subcultivate pe mediu MS suplimentat cu 1mg/l BA+AIB (fig.E,F).
CONCLUZII
Mediul de cultura Murashige-Skoog, cu adaos de AIB si BA, cate 1 mg/l din fiecare, a exercitat o influenta pozitiva asupra inoculilor, din acestia - inca din prima luna de vitrocultura - neoformandu-se numeroase tulpinite (lastari) dar si radacinite cu geotropism negativ. La Sedum telephium ssp maximum capacitatea regenerativa si de crestere din seminte germinate aseptic ( pe mediu steril MS), in conditii experimentale similare, a fost inferioara comparativ cu reactia vitroculturilor realizate din minibutasi de lastari de Sedum telephium ssp. maximum.
EXPERIMENTUL 4
TEHNICI DE MICROSCOPIE ELECTRONICA
Realizarea preparatului vegetal in vederea evidentierii aspectelor ultrastructurale surprinse in celulele fitoinoculului a avut loc cu jutorul microscopului electronic de tip SEM, cuanta 250, marca FEI.
Studiul de microscopie electronica au fost facut deocamdata pe preparate biologice provenind de la radacinite embrionare si cele cu geotropism negativ crescute pe varianta V3 ( mediul Murashige-Skoog suplimentat cu 1mg/l AIB si BA, conform protocolului prezentat in Tratatul HAYAT din anul 2000, utilizand metoda ultrasectionarii. De asemenea am analizat si frunzulitele cresute in mediu dar si cele de deasupra mediului de la aceasta varianta.
Alegerea materialului vegetal in vederea analizarii la microscopul electronic s-a realizat respectandu-se geometria standard de prelevare.
REZULTATE SI DISCUTII
A B
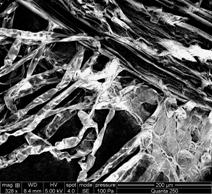
C D
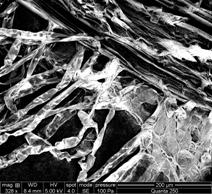

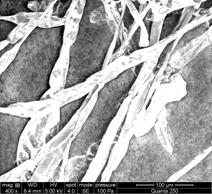
Fig.20- A-D- Analiza microscopica a radacinii cu geotropism negativ de Sedum maximum vitrocultivat
E F


G H


Fig.20 E-H- Analiza microscopica a radacinii embrionare de Sedum maximum vitrocultivat
CONCLUZII
Din analiza acestui studiu microscopic, s- a putut observa ca radacinita embrionara se deosebeste de cele crescute in afara mediului prin lipsa perisorilor absorbanti. La nivelul frunzulitelor vitrocultivate si analizate nu s-au remarcat diferente.
I J


Fig. 21- Analiza microscopica a frunzulitelor de Sedum maximum vitrocultivat
K L


Fig. 22 - Analiza microscopica a frunzulitelor crescute in mediu de Sedum maximum vitrocultivat
DOTAREA LABORATORULUI DE BIOTEHNOLOGIE VEGETALA SI ECHIPAMENTELE UTILIZATE

Fig.4. Hota cu flux de aer steril

Fig.5. Camera de preparare a mediilor de cultura

Fig.6. Incubatoare de crestere

Fig.7. Camere de crestere sterila climatizata

Fig. 8. Rafturile din camera de crestere, iluminate artificial

Fig.9. Agitator mecanic - pentru suspensiile de celule

Fig.10. Microscopul de cercetare, utilizat la observarea sectiunilor efectuate in materialul vegetal

Fig. 11. Laborator de microscopie optica si analize chimice
Se vor utiliza urmatoarele echipamente:
luxmetru - pentru masurarea intensitatii luminii in camera de crestere;
pH-metru - pentru stabilirea pH-ului mediilor de cultura;
exicatoare;
balanta analitica si tehnica;
balanta electronica;
etuva - pentru sterilizare;
termometre etalonate - pentru monitorizarea functionarii etuvelor, dar si pe etajerele cu vitroculturi;
instrumentar de taiere si inoculare, lingurite, scafe;
bidistilator;
autoclav - pentru sterilizarea sticlariei si a mediilor de cultura;
hota cu flux laminar - pentru inocularea culturilor in conditii aseptice;
lampi UV - pentru sterilizarea incaperilor;
agitator mecanic - pentru suspensiile de cellule;
microscop optic cu camera de luat vederi;
computer - pentru vizualizarea preparatelor;
microscop electronic cu transmisie;
microscop electronic cu baleaj;
microtom;
ultramicrotom;
termostat de parafina;
sticlarie de laborator;
BIBLIOGRAFIE
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |