COLOIZI DE ASOCIATIE
1 Surfactanti
1.1. Definitie
Surfactantii sunt substante tensioactive ale caror molecule sunt alcatuite dintr-o componenta polara, cu caracter hidrofil (cap polar) si o componenta nepolara, cu caracter hidrofob (coada). Aceste molecule se numesc molecule amfifile , reprezentate schematic in figura 1.

Figura 1
Structura unei molecule amfifile
Principala proprietate a moleculelor amfifile o reprezinta adsorbtia spontana la suprafata interfazica si micsorarea tensiunii interfaciale.
Din aceasta cauza surfactantii reprezinta una dintre cele mai importante clase de compusi chimici folositi in toate domeniile industriale in care se obtin produse prin amestecarea a doua sau mai multor substante nemiscibile: industria agroalimentara, industria cosmetica, farmaceutica, a vopselurilor etc.
Daca folosirea acestor substante in diferite activitati practice are o istorie foarte indelungata, studierea teoretica si experimentala a comportarii lor fizico-chimice este de data mai recenta.
Astfel, in anul 1881 E. Ducleaux si J. Traube definesc regula scaderii tensiunii superficiale a solutiilor de surfactanti, iar la inceputul secolului al XX-lea J. W. Mc. Bain explica actiunea de spalare a moleculelor de sapun pe baza formarii micelelor de asociatie.
Studiile teoretice si experimentale referitoare la comportarea moleculelor amfifile in solutie au pus in evidenta faptul ca din grupa substantelor tensioactive pot fi surfactanti numai acele substante ale caror molecule au proprietatea de a se autoasocia in solutie sub forma unor agregate numite micele de asociatie.
De exemplu, moleculele amfifile la care gruparile polare sunt:
![]()
![]()
![]()
![]() ;
; ![]() ;
;![]() etc. au actiune tensioactiva, dar nu pot fi
considerate surfactanti deoarece in solutie nu formeaza micele
de asociatie (coloizi de asociatie).
etc. au actiune tensioactiva, dar nu pot fi
considerate surfactanti deoarece in solutie nu formeaza micele
de asociatie (coloizi de asociatie).
1.2. Clasificare
Numarul mare de monografii si articole despre coloizi de asociatie aparute in reviste de specialitae demonstreaza ca in secolul al XX-lea a existat o preocupare foarte intensa a colectivelor de cercetare din toata lumea privind sinteza si aplicabilitatea surfactantilor (Mandru, Olteanu, 2001, p.260).
Datorita existentei unui numar foarte mare de compusi chimici care au proprietati de surfactant, s-a impus necesitatea clasificarii lor dupa diferite criterii, cum ar fi:
natura materiilor prime folosite la obtinere;
structura si compozitia chimica a moleculelor amfifile;
domeniile de utilizare (valoarea HLB).
In functie de natura materiilors prime folosite la obtinere, surfactantii sunt: surfactanti naturali si surfactanti sintetici.
Surfactantii naturali reprezinta primii compusi chimici folositi in actiunea de spalare (sapunuri) si se obtin din grasimile animale sau uleiurile vegetale supuse unor anumite procese chimice.
Alaturi de sapunuri, din clasa surfactantilor naturali mai fac parte:
sterolii (colesterolul) care favorizeaza emulsionarea apei in ulei;
lecitinele din oua sau soia ale caror molecule amfifile bicatenare se autoasociaza in solutie in agregate cu structura de bistrat numite vezicule sau lipozomi;
saponinele, extrase din radacinile de Ciuin rosu (Saponaria officinalis) au actiune puternic spumanta;
proteinele si lipoproteinele, care favorizeaza formarea si stabilizarea unor emulsii alimentare.
Surfactantii sintetici se obtin din diferiti precursori chimici supusi
unor reactii de hidroliza, sulfatare, sulfonare, esterificare, etoxilare etc.
Deoarece precursorii chimici sunt fractiuni obtinute la prelucrarea petrolului (arene, alcani, alchene, heterocicli etc.) surfactantii sintetici au avantajul unui pret de cost mai scazut, dar poarta amprenta suspiciunii asupra actiunii lor toxice.
Clasificarea surfactantilor in functie de structura si compozitie chimica
Cel mai folosit criteriu de clasificare a surfactantilor il reprezinta structura chimica a moleculei amfifile, mai exact posibilitatea de ionizare a gruparii polare la dizolvarea lor in apa.
In acest sens, Swartz si Perry grupeaza surfactantii in:
surfactanti ionici (anionici si cationici);
surfactanti amfoteri
surfactanti neionici;
Din punct de vedere chimic, surfactantii anionici au gruparea hidrofila reprezentata printr-o grupare functionala care ionizeaza negativ la dizolvarea in apa. Aceasta grupare este neutralizata de ioni ai metalelor alcaline, alcalino-pamantoase sau ioni de amoniu si alchil amoniu.
Acestia reprezinta aproximativ 65% din totalul de surfactanti utilizati in diferite domenii de activitate. Diversitatea lor deriva din structura diferita a componentei nepolare legata direct sau indirect de gruparea hidrofila.
In functie de natura gruparilor polare ionizate negativ, surfactantii anionici se grupeaza in urmatoarele clase:
carboxilati;
esteri ai acizilor carboxilici;
sulfati;
sulfonati;
acilaminoacizi si sarurile corespunzatoare;
esteri ai acidului fosforic si saruri ale acestora.
Sunt compusi care contin ca parte hidrofoba un radical alchil provenit de la acizi grasi sau fractiuni petrochimice, iar ca parte hidrofila o grupare functionala purtatoare de sarcina pozitiva pe un atom de N, S, P.
Deoarece surfactantii de tipul sarurilor de sulfoxoniu, sulfoniu si fosfoniu sunt lipsiti de importanta industriala, in cele ce urmeaza ne vom referi numai la surfactantii cationici din clasa sarurilor de amoniu.
Caracteristica acestor surfactanti o reprezinta capacitatea sarcinilor pozitive de a interactiona puternic, prin legaturi electrostatice cu materiale naturale si sintetice ale caror suprafete sunt incarcate negativ. Aceasta le confera posibilitatea folosirii lor in domenii foarte diverse, precum: conditionarea textilelor, emulsionarea bitumului, agenti anticorozivi si actiune protectoare impotriva coroziunii microbiologice, agenti de fixare a colorantilor pe produsele textile, in prepararea unor produse cosmetice de conditionare si tratare a parului etc.
Studiile realizate de Domagk in anul 1935 au pus in evidenta carcaterul bactericid si bacteriostatic al surfactantilor cationici cu sarcina pozitiva pe atomul de azot. Aceasta a determinat o crestere spectaculoasa a productiei mondiale de surfactanti cationici ajungand in Europa la un procent de 35% din totalul de surfactanti produsi in anul1998.
Ca dezavantaj, il reprezinta gradul ridicat de iritabilitate si o biodegradabilitate scazuta.
Principalele clase de surfactanti cationici sunt:
aminele grase si sarurile lor;
sarurile cuaternare de amoniu ale aminelor alifatice, cicloalifatice si aromatice.
Surfactanti amfoteri
Surfactantii amfoteri sunt compusi chimici care in structura lor au grupari functionale capabile sa ionizeze diferit in functie de pH-ul mediului. Ei au proprietati tensioactive atat in mediu acid, cat si bazic.

Din aceasta clasa fac parte: N-alchilaminoacizii, N-alchilbetainele, sulfobetainele, alchilaminooxizii, fosfatidele.
Surfactantii din aceasta clasa au o foarte mare arie de intrebuintari datorita atat toxicitatii lor scazute, cat mai ales folosirii lor ca materie prima in obtinerea surfactantilor ionici cu proprietati tensioactive imbunatatite.
Din punct de vedere chimic, surfactantii neionici au in compozitia lor o parte hidrofoba asemanatoare cu a celorlalte tipuri de surfactanti si o parte hidrofila, constituita din grupari cu polaritate ridicata, neionizabile (Schick, 1966, 1987).
Surfactantii neionici actioneaza intr-un mod cu totul diferit de al celor ionici, in sensul ca ei se hidrateaza prin intermediul legaturilor dipol-dipol, nu formeaza ioni in solutie apoasa iar activitatea lor este independenta de pH.
In functie de natura gruparii polare, din clasa surfactantilor neionici fac parte: derivatii polietoxilati, gliceridele, sucroesteri, polisorbati etc.
Derivati polietoxilati se obtin prin reactia de polietoxilare a unor compusi hidrofobi care contin atomi de hidrogen activi, in cataliza acido-bazica:
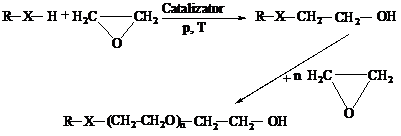
unde X poate fi O, S, NH, COO, CONH, corespunzator unor derivati de la alcooli, fenoli, mercaptani, amine, acizi carboxilici, amide.
Derivatii polietoxilati au o buna solubilitate in apa si se folosesc in ca agenti de spumare, emulgatori, solubilizanti, dispersanti etc.
De altfel, reactia de polietoxilare sta la baza obtinerii unui mare numar de surfactanti neionici.
In afara de grupele oxietilenice, in structura surfactantilor neionici se mai pot intalni grupari polare derivate din gligerina, sorbitol, anhidrosorbitol, glucoza, zaharoza etc.
Acesti surfactanti se folosesc cu predilectie ca emulgatori in industria alimentara (Banu, 2000, p.135).
Notiunea de HLB (Hydrophilic-lypophilic balance) s-a impus din necesitatea clasificarii surfactantilor in raport cu domeniile de utilizare.
Astfel, in procesul de preparare a emulsiilor principala intrebare care se punea era: "care emulsionant este mai bun pentru prepararea emulsiilor U/A sau A/U si care ii va asigura o stabilitatea mai mare
Un prim raspuns la aceasta intrebare a fost dat in anul 1913 de Banckroft. Acesta, in urma unor experimente, a formulat urmatoarea regula, cunoscuta sub numele de regula Banckroft:
"emulsionantii hidrofili (solubili in apa) vor favoriza formarea emulsiilor directe U/A, iar emulsionantii lipofili (solubili in solventi nepolari) vor favoriza formarea emulsiilor inverse A/U".
In anul 1933 Harris, studiind procesul de fabricare a margarinei, a observat ca o caracteristica decisiva a emulgatorului folosit, o reprezinta echilibrul intre proprietatea hidrofila a "capului polar" si proprietatea lipofila a "cozii" nepolare a surfactantului. Astfel, Harris arata ca in alcoolul cetilic efectul hidrofil al gruparii OH este compensat de efectul lipofil al radicalului hidrocarbonat, fenomen care nu se mai observa la sulfatul de cetil.
Studii mai elaborate privind definirea si calcularea HLB s-au realizat dupa anul 1950 de Griffin si Davis.
Din punct de vedere calitativ, notiunea de HLB reprezinta un raport intre proprietatea hidrofila si cea lipofila a unui surfactant.
Cuantificarea acestei notiuni are un caracter relativ si a fost realizata de Griffin in urma unui mare numar de experiente ce aveau la baza studiul solubilitatii unor surfactanti neionici, in functie de structura lor.
Pentru aceasta, Griffin a propus o scara arbitrara de valori, corespunzatoare valorilor HLB, cuprinse intre 1-20. El a atribuit valoarea 1 surfactantilor cu proprietati lipofile maxime (solubili in solventi nepolari) si valoarea 20 pentru surfactantii cu proprietati hidrofile maxime (solubili in solventi polari). Fig.15.2.
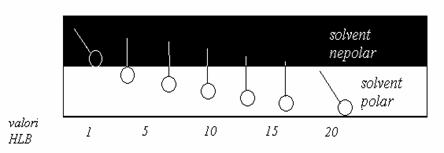
Figura 2
Variatia valorilor HLB
in functie de solubilitatea surfactantilor
Corelarea valorilor HLB cu domeniile de utilizare a condus la gruparea surfactantilor in diferite clase (Tabelul 1).
Tabelul 1. Domenii de aplicatie ale surfactantilor
in functie de HLB
|
Domeniu HLB |
Aplicatii ale surfactantilor |
|
Agenti antispumanti Emulgatori A/U Agenti de udare Emulgatori U/A Detergenti Solubilizanti |
Atat din schema prezentata in figura 15.2 cat si din tabelul 15.1 se desprinde urmatoarea observatie:
v valorile mici ale HLB sunt caracteristice surfactantilor cu contributii mici ale partii hidrofile (cu solubilitate limitata in apa) si care favorizeaza formarea emulsiilor inverse de tip A/U, in timp ce valorile mari ale HLB sunt caracteristice surfactantilor cu ponderi mari ale partii hidrofile (cu solubilitate ridicata in apa) si care stabilizeaza emulsiile directe, de tip U/A
Pornind de la observatia experimentala potrivit careia valoarea HLB depinde de raportul dintre masa partii hidrofile si masa totala a surfactantului, Griffin a propus mai multe formule de calcul atat pentru surfactantii neionici, cat si pentru cei ionici.
a). Pentru compusi neionici care contin numai cu grupari etilenoxidice:
![]() (1)
(1)
unde E reprezinta ponderea procentuala a partii polietilenoxidice fata de intreaga molecula amfifila cu masa moleculara M care contine n grupari oxietilenice.
b). Pentru esterii acizilor grasi cu compusi polihidroxilici:
![]() (2
(2
unde:
S, reprezinta indicele de saponificare definit ca numarul de mg de KOH necesar saponificarii a 1 g ester.
![]() (3)
(3)
A, reprezinta indicele de aciditate, definit ca numarul de mg de KOH necesar neutralizarii a 1 g de acid corespunzator esterului.
![]() (4)
(4)
Astfel, valoarea HLB pentru esterii acizilor grasi se calculeaza cu relatia:
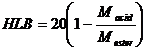 (5)
(5)
Pentru multe clase de surfactanti, valoarea HLB se poate calcula cu o formula generala de tipul:
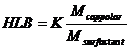 , (6)
, (6)
unde K este o constanta.
c). Metoda incrementelor, propusa de Davis (1963), consta in atribuirea fiecarui grup de atomi unei anumite contributii valorice.
Valoarea HLB se calculeaza prin diferenta dintre suma contributiilor unitatilor structurale hidrofile si cea a unitatilor structurale lipofile, corespunzator relatiei:
![]() (7)
(7)
unde:
![]() , reprezinta suma contributiilor
corespunzatoare unitatii structurale hidrofile;
, reprezinta suma contributiilor
corespunzatoare unitatii structurale hidrofile;![]() , reprezinta suma contributiilor
corespunzatoare unitatii structurale lipofile. Incrementele
prezentate in tabelul 2 au fost calculate cu ajutorul unor serii omologe de
surfactanti ale caror valori HLB erau cunoscute.
, reprezinta suma contributiilor
corespunzatoare unitatii structurale lipofile. Incrementele
prezentate in tabelul 2 au fost calculate cu ajutorul unor serii omologe de
surfactanti ale caror valori HLB erau cunoscute.
d). Pentru amestecuri de surfactanti.
Valoarea HLB pentru amestecuri de surfactanti variaza linear cu proportia masica a fiecarui constituent din amestec:
![]() (8)
(8)
unde:
![]() reprezinta
procentul masic al surfactantului i din amestec;
reprezinta
procentul masic al surfactantului i din amestec;
![]() reprezinta
valoarea balantei hidrofil-lipofile a surfactantului i din amestec.
reprezinta
valoarea balantei hidrofil-lipofile a surfactantului i din amestec.
Datele experimentale au aratat ca relatia (8) are un caracter limitat si se poate aplica numai pentru amestecuri de surfactanti neionici cu valori ale HLB apropiate.
Tabelul 2 Contributii de grup la valoarea HLB
|
Grup de atomi |
Contributii de grup |
Grupe hidrofile
| |
|
| |
|
| |
|
| |
Ester liber | |
|
Ester (ciclu sorbitanic) | |
|
| |
|
| |
|
|
0,5 |
|
| |
Grupe lipofile
| |
|
|
O metoda de evaluare rapida, dar grosiera, a valorii HLB o reprezinta observarea comportarii surfactantilor in apa. Corespondenta dintre valorile HLB si comportarea surfactantilor in apa este prezentata in tabelul 3.
Tabelul 3. Determinarea experimentala a HLB
|
Valoare HLB |
Comportarea surfactantului in apa |
|
> 13 |
Nu se disperseaza Se formeaza o dispersie grosiera Se formeaza o dispersie laptoasa, putin stabila Se formeaza o dispersie laptoasa stabila Se formeaza o dispersie opalescenta Se formeaza o solutie coloidala limpede |
Pentru determinarea riguroasa a valorii HLB se folosesc metode fizico-chimice prin care se determina: CCM, coeficientul de repartitie, temperatura de inversare de faza (TIP), parametrii de solubilitate etc.(Becher, 1987).
Astfel, una dintre cele mai des folosite marimi in calcularea HLB o reprezinta CCM. Corespondenta dintre CCM si HLB este data de relatia:
![]() (9)
(9)
unde:
A si B sunt doua constante pentru o serie omologa data.
De remarcat ca valorile HLB ofera informatii foarte utile cu privire la folosirea surfactantilor in diferite scopuri industriale. Astfel, in industria alimentara emulgatori ca : monogliceride, glicerollactopalmitatul, propilen glicol monostearatul, triglicerolstearatul, esterii sorbitolului au HLB=3-6 si favorizeaza formarea emulsiilor inverse A/U, cum ar fi margarina, iar compusi precum esterii polioxietilensorbitanului, sucroesterii, lecitinele etc. au HLB=8-14 si sunt fie formatori de emulsii directe, fie stabilizatori de turbiditate (Banu C, 2000, p. 135).
2. Coloizi de asociatie
Asa cum s-a aratat in capitolul anterior, alaturi de un comportament general manifestat prin adsorbtia moleculelor amfifile la interfata L/G sau L/S, surfactantii formeaza in solutie diferite agregate numite micele de asociatie sau micele liofile. Termenul "liofil" se refera la prezenta interactiunilor dintre micela si particulele existente in faza continua (surfactant, solvent, ioni etc).
Deoarece aceste agregate au dimensiuni mai mari decat moleculele fazei continue, sistemele din care fac parte se numesc "coloizi de asociatie".
Concentratia surfactantului la care se formeaza micelele de asociatie se numeste concentratie critica micelara (CCM).
Valoarea CCM se poate determina prin masurarea diferitelor proprietati de echilibru sau de transport ale solutiilor.
Potrivit figurii 2 solutiile de surfactanti cu concentratia cuprinsa in domeniul ( I ) au un comportament caracteristic proprietatilor generale.
La o concentratie corespunzatoare aparitiei micelelor (CCM), proprietatile urmarite inregistreaza o modificare brusca a pantei, explicata in general, prin modificarea dimensiunii particulelor din sistem.
De exemplu, conductivitatea solutiei scade brusc la CCM datorita mobilitatii mai mici a micelelor in comparatie cu monomerii.
Tensiunea superficiala ramane constanta dupa CCM , ca urmare a faptului ca in domeniul (II) de concentratie, suprafata interfaciala este saturata cu molecule amfifile iar scaderea tensiunii superficiale a atins valoarea minima.
![]()
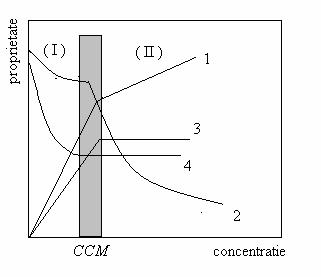
Figura 2
Variatia unor proprietati in functie de concentratiei solutiei de surfactant
1-conductivitatea; 2- conductivitatea echivalenta; 3- presiunea osmotica;
4- tensiunea superficiala
Diferenta dintre valorile CCM pentru acelasi surfactant se datoreaza fie folosirii unor metode diferite, fie prezentei in solutie a unor impuritati care influenteaza foarte mult procesul de micelizare, chiar in cantitati foarte mici. Aceste diferente sunt insa mici, ceea ce face posibila folosirea acestor metode in evaluarea CCM.
Tot prin aceste metode se pot determina dimensiunea, respectiv "masa moleculara" sau numarul de agregare al micelei.
Formarea micelelor liofile este un proces dinamic si reversibil care se petrece intr-un interval de timp foarte scurt; intre moleculele de monomer si cele din micela exista un schimb permanent, care se petrece in 1-10 microsecunde. Aceasta face ca la coloizii de asociatie suprafata interfaciala sa fie mai putin definita, ceea ce confera sistemului o anumita stabilitate temodinamica, in comparatie cu sistemele coloidale liofobe la care exista o mare suprafata interfaciala si deci o instabilitate coloidala.
Autoasocierea moleculelor amfifile are drept cauza tendinta partii hidrofobe de a se indeparta de moleculele polare, respectiv a celei hidrofile de a se indeparta de moleculele nepolare.
In aceste conditii, in solventi polari, moleculele amfifile ionice se autoasociaza in asa fel incat "cozile" (lanturile hidrocarbonate) formeaza un microdomeniu nepolar, inconjurat de o suprafata polara ce contine gruparile hidrofile.(Figura 3a)
Aceste agregate se numesc micele directe de asociatie.
In solvent nepolar iau nastere micele inverse, ca urmare a asocierii partilor polare, cu formarea unui microdomeniu polar, inconjurat de partile hidrofobe care "plutesc" in solventul nepolar.(Figura 3b).

Figura 3
Formarea micelelor de asociatie directe si inverse
Primele studii referitoare la structura micelelor, realizate de Hartley (1936) si Mc Bain (1950) s-au referit la forma lor sferica, forma unanim acceptata in cazul solutiilor diluate de surfactanti.
Studiile ulterioare au aratat ca in functie de complexitatea lor, moleculele amfifile pot forma structuri micelare complexe de tip cilindric, discuri plate, lamelar extinse etc. (Tanford, 1980).
De asemenea, la concentratii ridicate de surfactant, micelele de forma sferica sau cilindrica se asociaza cu formare de mezofaze sau faze lichid cristaline.
Formarea micelelor de asociatie este un proces deosebit de complex, care a fost si continua sa fie un domeniu foarte mult studiat.
Desi studiile realizate la nivelul diferitelor colective de cercetatori din lume au condus uneori la rezultate contradictorii, totusi puncte de vedere comune pun in evidenta rolul fundamental al factorului entropic in procesul de micelizare.
Studiile termodinamice ale procesului de micelizare s-au referit mai intai la formarea micelelor directe, cu participarea moleculelor amfifile ionice, dizolvate in solvent polar (apa).
O analiza termodinamica mai detaliata a aratat faptul ca procesul de micelizare are loc cu scaderea energiei Gibbs a sistemului, ceea ce confera coloizilor de asociatie o stabilitate termodinamica ridicata, in comparatie cu sistemele coloidale liofobe care se formeaza cu consum de energie si sunt instabili termodinamic. Aceasta, deoarece s-a observat ca procesul de asociere a moleculelor amfifile in apa, la temperatura camerei este insotit de o crestere semnificativa a entropiei, crestere ce reprezinta principala contributie la valoarea negativa a energiei Gibbs de micelizare.
![]() (9)
(9)
deoarece: ![]() si
si ![]() , entalpia de micelizare are in general valoare mica
si adesea pozitiva.
, entalpia de micelizare are in general valoare mica
si adesea pozitiva.
Cresterea entropiei sistemului se explica prin manifestarea simultana a efectului hidrofobic si a interactiunilor hidrofobe.
2.1.1 Efectul hidrofobic
Efectul hidrofob, a fost explicat de Tanford (1973, 1980) pe baza relatiei care se stabileste intre moleculele polare de apa si cele nepolare ale unei hidrocarburi (n-hexan, ciclohexan etc.).
Molecula de apa este o molecula polara cu o distributie nesimetrica a sarcinilor electrice.
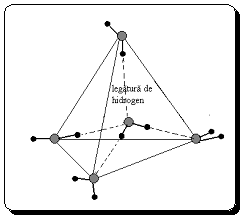
Figura 4
Coordinarea tetraedrica a apei prin legaturi de hidrogen
Intre moleculele de apa, alaturi de fortele de atractie van der Waals, se manifesta si legaturile de hidrogen. Aceste legaturi determina structurarea apei solide in anumite asociatii intermoleculare cu formarea unei retele in care fiecare atom de oxigen este coordinat tetraedric cu alti patru atomi de oxigen prin intermediul unui atom de hidrogen (Fig.15.4).
In apa lichida se mentine tendinta de pastrare a structurii de retea, specifica ghetii, cu mentiunea ca fiecare molecula de apa este inconjurata de cinci molecule vecine. Se formeaza astfel, o ordine locala care scade cu distanta fata de molecula supusa observatiei.
Tendinta moleculelor de apa de a forma legaturi de hidrogen intre ele influenteaza interactiunile acestora cu moleculele nepolare care nu pot forma legaturi de hidrogen.
Astfel, la introducerea unei molecule de hidrocarbura (n-hexan) in apa, aceasta va contribui la distrugerea legaturilor de hidrogen dintre moleculele de apa. Pentru a evita acest fenomen, apa se structureaza in jurul moleculei nepolare cu formarea unui invelis de hidratare sub forma unor "custi" sau clatrati.
In acest caz, o moleculela de apa implicata in formarea "custilor" formeaza un numar de 4 legaturi de hidrogen, in comparatie cu molecula de apa din interiorul lichidului, unde numarul de legaturi de hidrogen este redus la 3,5. Aceasta face ca moleculele de apa din invelisul de hidratare sa fie distribuite mai ordonat decat cele din interiorul lichidului, ceea ce determina o scadere a entropiei sistemului (Fig.5).
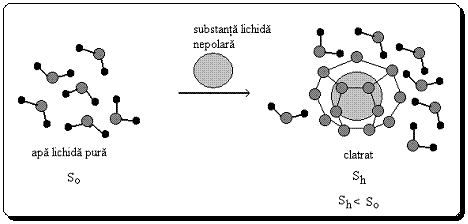
Figura 5
Efect hidrofob
Dispunerea ordonata a moleculelor de apa
in jurul moleculelor nepolare are loc cu scaderea entropiei
Din aceasta cauza, se spune ca hidratarea unei molecule nepolare este un fenomen defavorizat entropic (are loc cu scaderea entropiei).
Prin urmare, hidrocarburile, ca si gazele rare sunt putin solubile in apa, avand o energie Gibbs de "dizolvare" pozitiva, defavorabila amestecarii.
De exemplu, energia Gibbs de hidratare a n-butanului, la temperatura de 298K are valoarea +24,5 kJ/mol, calculata cu relatia:
![]()
2.1.2 Interactiuni hidrofobe
Intre moleculele nepolare inchise in "cusca", inconjurate de moleculele de apa din stratul de hidratare se manifesta o forta de atractie de o intensitate si la o distanta mult mai mare decat toate celelalte forte care ar putea sa se exercite intre aceleasi molecule situate in vid sau in mediul lichid nepolar, in absenta hidratarii.
Acest tip special de interactiune se numeste interactiune hidrofoba si sta la baza procesului de micro-organizare in apa a diferitelor molecule nepolare sau a unor molecule care poseda regiuni nepolare (Fig.6).
Bilantul termodinamic al asocierii moleculelor nepolare hidratate, prin interactiuni hidrofobe este in general favorabil.
Masuratorile privind interactiunile hidrofobe au pus in evidenta valori negative ale energiei Gibbs, fapt care sustine caracterul entropic al fortelor hidrofobe.
Aceasta se explica prin faptul ca prin interactiune hidrofoba, cele doua invelisuri de hidratare ale "custilor" in care se afla moleculele nepolare se apropie. Prin suprapunere, moleculele de apa legate ordonat pe suprafata custilor sunt eliberate si trecute in interiorul lichidului, provocand o crestere a entropiei apei.
Studiul teoretic al acestei interactiuni este foarte complex datorita faptului ca, simultan cu fortele atractive hidrofobe, se manifesta toate celelalte tipuri de forte, precum: forte de polarizare, de dispersie, electrostatice, de respingere, la care se adauga efectele entropice ale hidratarii hidrofobe.
Toate aceste forte depind de structura mediului in care se exercita, respectiv de tipurile de interactiuni care se manifesta intre moleculele de apa.
Din punct de vedere fenomenologic interactiunea dintre doua molecule hidrofobe sau a doua suprafete hidrofobe determina orientari preferentiale ale moleculelor de apa in stratul de hidratare si asigura propagarea din aproape in aproape a unei polarizari de-a lungul straturilor de apa din ce in ce mai indepartate.
Mecanismul de propagare a acestui fenomen, pune in evidenta prezenta unor interactiuni prin transfer de sarcina, specifice legaturilor de hidrogen. Aceste interactiuni se manifesta pe distante mari, de pana la 100Ǻ.
Israelachevili si Pashley (1982) au masurat forta hidrofobica dintre doua suprafete curbe hidrofobe, in apa si au aratat ca aceasta scade exponential cu distanta.
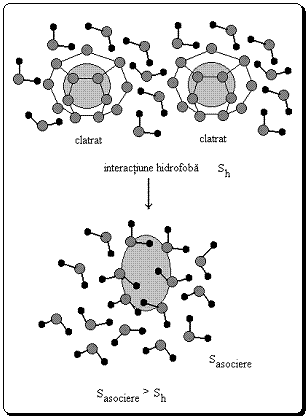
Figura 6
Interactiunea hidrofoba
este un proces care are loc cu cresterea entropiei
Interactiunea hidrofoba joaca un rol important in manifestarea diferitelor fenomene, precum: formarea micelelor liofile, autoasocierea lipidelor bicatenare cu formare de membrane si vezicule, incorporarea proteinelor in structura membranelor biologice, incapsularea unor substante active in interiorul lipozomilor, stabilirea conformatiei proteinelor etc.
2.1.3 Autoasocierea moleculelor amfifile
Avand la baza observatiile de mai sus, se poate explica faptul ca adevarata cauza a procesului de formare a unei micele de asociatie directe o reprezinta interactiunea hidrofoba care are loc cu cresterea entropiei apei respectiv scaderea energiei Gibbs a sistemului.
Astfel, o molecula amfifila introdusa in apa perturba asociatiile moleculare ale apei, datorita lantului hidrocarbonat (hidrofob) Fig.7.

Figura 7
Formarea micelelor de asociatie directe
In acest caz, in jurul monomerului (o molecula amfifila), moleculele de apa se ordoneaza sub forma unei "custi", fenomen care are loc cu scaderea entropiei. La introducerea celui de-al doilea monomer amfifilic, intre acestia se manifesta doua tipuri de interactiuni: o interactiune hidrofoba, atractiva la care participa lantul hidrocarbonat (hidrofob) si o interactiune hidrofila, repulsiva, la care participa capetele polare ale moleculelor amfifile.(Fig.7).
Celelalte molecule amfifile adaugate in apa se vor asocia in agregate in care "cozile" nepolare vor forma un microdomeniu nepolar inconjurat de "capetele" polare, prin care se face contactul cu moleculele de apa.
Deoarece,
volumul microdomeniului nepolar este mai mare decat volumul catenei nepolare a
monomerului, moleculele de apa nu se mai pot distribui in mod ordonat sub
forma unei "custi"; are loc distrugerea legaturilor, iar moleculele
de apa capata un grad de libertate ridicat, ceea ce determina
o crestere a entropiei: ![]() .
.
Deoarece entalpia de micelizare are in general valori mici si pozitive, rezulta ca formarea unei micele de asociatie are loc cu scaderea energiei Gibbs:
![]() (9a)
(9a)
Potrivit celor de mai sus, rezulta ca, intr-o micela de asociatie directa se manifesta urmatoarele tipuri de interactiuni:
interactiuni atractive (van der Waals), intre "cozile" nepolare ale moleculelor amfifile;
interactiuni repulsive (hidrofile), intre "capetele" polare ale moleculelor amfifile;
interactiuni van der Waals si de hidrogen, intre "capetele" polare ale moleculelor amfifile si dipolii apei;
interactiuni electrostatice, intre "capetele" polare si contraionii proveniti din gruparile moleculelor amfifile;
interactiuni sterice.
Toate aceste tipuri de interactiuni, la care se adauga interactiunile dintre micele, determina forma si stabilitatea micelelor, respectiv proprietatile coloizilor de asociatie.
Din
calcule termodinamice se constata ca factorul entropic ![]() reprezinta
aproximativ 90% din valoarea energiei Gibbs standard molare de micelizare, ceea
ce confirma observatia facuta mai sus potrivit careia
forta motrice a procesului de micelizare o constituie cresterea
entropiei sistemului.
reprezinta
aproximativ 90% din valoarea energiei Gibbs standard molare de micelizare, ceea
ce confirma observatia facuta mai sus potrivit careia
forta motrice a procesului de micelizare o constituie cresterea
entropiei sistemului.
Cateva
valori pentru ![]() ,
, ![]() si
si ![]() determinate prin aceasta metoda sunt prezentate in
tabelul 5.
determinate prin aceasta metoda sunt prezentate in
tabelul 5.
Tabelul 5. Marimi termodinamice ale procesului de micelizare, la temperatura de 250C ale unor surfactanti
|
Surfactant |
|
|
|
|
Bromura de dodecil piridiniu | |||
|
Dodecilsulfat de sodiu | |||
|
N-dodecil-N,N-dimetil glicina | |||
|
Polioxietilen(6) decanol |
Din datele prezentate in tabelul 5 se pot desprinde urmatoarele concluzii:
in toate cazurile micelizarea este un proces termodinmic spontan, care se desfasoara cu scaderea energiei Gibbs;
entalpia de
micelizare ![]() are atat valori
negative, cat si pozitive. Aceste valori sunt in general mici si
uneori nu corespund cu cele obtinute prin metoda calorimetrica;
are atat valori
negative, cat si pozitive. Aceste valori sunt in general mici si
uneori nu corespund cu cele obtinute prin metoda calorimetrica;
entropia de
micelizare ![]() este in toate cazurile
pozitiva, cu valori mult mai mari decat cele ale entalpiei de micelizare.
Prin urmare, contributia factorului entropic la scaderea energiei
Gibbs de micelizare este mult mai mare decat a factorului entalpic.
este in toate cazurile
pozitiva, cu valori mult mai mari decat cele ale entalpiei de micelizare.
Prin urmare, contributia factorului entropic la scaderea energiei
Gibbs de micelizare este mult mai mare decat a factorului entalpic.
Principala marime in functie de care se evalueaza procesul de micelizare o reprezinta concentratia critica de micelizare CCM. De aceea, factorii care influenteaza procesul de micelizare sunt de fapt factorii care influenteaza concentratia critica micelara.
Acestia sunt:
structura partii hidrofobe ( a "cozii" hidrocarbonate);
structura partii hidrofile (a "capului" polar);
efectul contraionilor;
efectul electrolitilor;
efectul substantelor organice;
efectul amestecului de surfactanti;
temperatura.
Structura partii hidrofobe
Lungimea partii hidrofobe influenteaza in mod substantial CCM.
Potrivit relatiei (46):
![]() (46)
(46)
dedusa din date termodinamice, rezulta ca intr-o serie omologa CCM scade logaritmic cu numarul atomilor de carbon din catena hidrofoba (p).
Unde, A si B sunt constante pentru o anumita serie omologa. Valoarea constantei A este aproximativ aceeasi pentru o anumita grupa ionica, iar valoarea constantei B este aproximateiv aceeasi, pentru toate moleculele amfifile cu catene alchilice liniare saturate.
Din panta dreptei (46) se poate evalua energia libera de transfer a unei grupe metilen din mediu apos in micela.
In cazul surfactantilor cu partea hidrofoba formata dintr-o catena alchilica liniara si o singura grupare hidrofila ionica, CCM scade de doua ori pentru fiecare grupare metilenica adaugata, fata de valoarea anterioara. In acelasi sens creste si solubilitatea surfactantilor ionici ca urmare a scaderii temperaturii Kraft.
Pentru catenele alchilice ramificate se modifica numarul gruparilor metilen, ceea ce determina o scadere mai lenta a CCM in functie de numarul atomilor de carbon din partea hidrofoba.
Prezenta unor elemente structurale, precum nuclee aromatice sau legaturi multiple, in catena hidrocarbonata, determina o crestere a CCM in raport cu compusul saturat corespunzator.
In schimb, prezenta fluorului pe catenele alchilice conduce la o scadere accentuata a CCM ceea ce explica activitatea superficiala superioara a compusilor din clasa surfactantilor fluorohidrocarbunati.
Gruparile hidrofile se opun procesului de micelizare datorita interactiilor repulsive de natura electrostatica, pentru surfactantii ionici, sau sterica, pentru surfactantii neionici, care se manifesta intre ele.
Cu
cat gruparile hidrofile sunt mai ionizabile, cu atat CCM este mai
ridicata. Asa se explica descresterea CCM in ordinea: ![]() respectiv, valorile de aproximativ 10 ori mai mari ale CCM pentru surfactantii ionici in
comparatie cu surfactantii neionici cu aceeasi parte
hidrofoba (Tab.6)
respectiv, valorile de aproximativ 10 ori mai mari ale CCM pentru surfactantii ionici in
comparatie cu surfactantii neionici cu aceeasi parte
hidrofoba (Tab.6)
Tabelul 6. CCM ale unor surfactanti cu aceeasi parte hidrofoba,
in solutie apoasa
|
Surfactantul |
CCM (mol/L) |
Numar de agregare(n) |
z/n |
|
|
Dodecilsulfat de sodiu | ||||
|
Clorura de dodecil amoniu | ||||
|
Bromura de dodecil-trimetil amoniu | ||||
|
Clorura de dodecil piridiniu | ||||
|
Bromura de dodecil piridiniu | ||||
|
Iodura de dodecil piridiniu | ||||
|
|
Introducerea
unor grupe oxietilenice in catenele hidrocarbonate ale unor surfactanti
ionici, precum: ![]() sau
sau
![]() micsoreaza valorile CCM datorita fie scaderii gradului de
disociere a grupelor ionice, fie interactiunii lantului hidrocarbonat
al catenei cu gruparile oxietilenice in urma carora acestea din
urma capata o anumita "valoare hidrofoba
aparenta" care permite un transfer mai complet al partii
nepolare in micela (Mandru, Olteanu, 2001).
micsoreaza valorile CCM datorita fie scaderii gradului de
disociere a grupelor ionice, fie interactiunii lantului hidrocarbonat
al catenei cu gruparile oxietilenice in urma carora acestea din
urma capata o anumita "valoare hidrofoba
aparenta" care permite un transfer mai complet al partii
nepolare in micela (Mandru, Olteanu, 2001).
Influenta contraionilor (proveniti din gruparea hidrofila) asupara CCM se datoreaza atat influentei lor asupra gradului de disociere, respectiv a gradului de legare de micele, precum si structurii lor intrinseci (valenta, volum, polaritate etc.)
Astfel, valori mici ale gradului de
disociere ( raportul![]() mic) reprezinta
un numar mic de contraioni liberi, situati in stratul difuz din jurul
micelei, respectiv un numar mare de contraioni legati de micela.
Acesti ioni legati determina diminuarea fortelor repulsive
de tip electrostatic ce se manifesta intre gruparile hidrofile
ionizate, fapt care conduce la micsorarea CCM.
mic) reprezinta
un numar mic de contraioni liberi, situati in stratul difuz din jurul
micelei, respectiv un numar mare de contraioni legati de micela.
Acesti ioni legati determina diminuarea fortelor repulsive
de tip electrostatic ce se manifesta intre gruparile hidrofile
ionizate, fapt care conduce la micsorarea CCM.
De asemenea, legarea contraionilor este favorizata de cresterea polarizabilitatii si valentei ionilor. In schimb, razele ionice de hidratare mari determina o separare a ionilor si o legatura mai slaba cu micela.
Aceste observatii au condus la urmatoarea ordonare a contraionilor in functie de descresterea CCM a surfactantilor :
pentru
cationi: ![]()
pentru
anioni: ![]()
Se stie ca in procesul de formulare a alimentelor, alaturi de substantele nutritive se folosesc o serie de aditivi, care de cele mai multe ori au caracter de electrolit. Aceste substante modifica procesul de micelizare fie datorita interactiunii lor cu moleculele amfifile, fie datorita modificarii proprietatilor structurale ale solventului (apei). Experimental s-a observat ca prezenta electrolitilor in solutii de surfactanti ionici determina o scadere a CCM, ca urmare a reducerii gradului de disociere (z/n) al micelelor.
Intre CCM si concentratia sarii adaugate se stabileste o relatie de forma:
![]() (47)
(47)
unde: A este o constanta care depinde de natura moleculei amfifile;
B este de asemenea o constanta a carei valoare este aproximativ 0,5;
![]() reprezinta
concentratia molara a ionului de semn contrar sarcinii
reprezinta
concentratia molara a ionului de semn contrar sarcinii
micelei.
Din datele prezentate in tabelul 7 se observa ca unei cresteri a concentratiei sarii (NaCl) ii corespunde o scadere a concentratiei critice micelare CCM si a sarcinii elementare a micelei, respectiv o crestere a numarului de agregare.
Tabelul 7. Influenta concentratiei de electrolit asupra procesului de micelizare
|
Solutie SDS+apa+NaCl |
CCM(mol/L) |
Sarcina elementara a micelei (z/n) |
Numar de agregare (n) |
|
SDS + apa | |||
|
SDS + 0,02 M NaCl | |||
|
SDS + 0,03 M NaCl | |||
|
SDS + 0,10 M NaCl | |||
|
SDS + 0,20 M NaCl | |||
|
SDS + 0,20 M NaCl |
Explicatia actiunii ionilor de semn contrar asupra CCM consta in faptul ca intre ioni si micela incarcata electric se exercita forte de atractie puternice, de natura electrostatica, care favorizeaza fenomenul de agregare a moleculelor de surfactant, micsorind CCM. Ionii de acelasi semn cu micela nu influenteaza procesul de micelizare.
In
cazul surfactantilor neionici sau amfoteri actiunea ionilor asupra CCM
nu se mai poate explica pe baza interactiunilor electrostatice. In acest
caz CCM se modifica datorita
modificarii proprietatilor de solvent ale apei. Astfel, unii
ioni determina o crestere a solubilitatii surfactantului
neionic (efect "salting in"), (![]() ), iar altii micsoreaza solubilitatea
printr-un efect numit "salting out".
), iar altii micsoreaza solubilitatea
printr-un efect numit "salting out".
Actiunea electrolitilor asupra CCM este determinata si de structura interna a ionilor. Astfel, ionii cu raza de hidratare mica determina o scadere avansata a CCM . In seria anionilor ordinea de descrestere a CCM este:
![]()
iar in seria cationilor exista urmatoarea ordine:
![]() .
.
Prezenta substantelor organice in solutiile de surfactanti influenteaza mai putin valoarea CCM. Ceea ce este interesant este faptul ca moleculele organice nepolare (hidrocarburi alifatice sau aromatice) se pot solubiliza intr-un solvent polar (apa) numai in prezenta surfactantilor care le inglobeza in microdomeniul nepolar al micelei.
Moleculele organice amfifile, precum: alcoolii, glicolii, aminele reduc in general CCM. Uneori aceste molecule cu partea hidrofoba mai mare determina, alaturi de surfactant, o scadere substantiala a tensiunii interfaciale si favorizeaza formarea unor sisteme disperse microeterogene stabile termodinamic numite microemulsii.
De cele mai multe ori procesele de preparare si stabilizare a mediilor disperse sunt eficientizate prin folosirea amestecurilor de surfactanti.
In amestec, surfactantii isi modifica substantial proprietatile tensioactive. Astfel, moleculele se adsorb la interfata cu formarea unor filme mixte care determina o scadere accentuata a tensiunii interfaciale. De asemenea, prezenta unor surfactanti diferiti in solutie apoasa determina formarea unor micele mixte, proces care imbunatateste capacitatea de solubilizare, detergenta, emulsionare, spumare etc.(Mandru, Olteanu, 2001,p.140)
Procesul de micelizare este influentat in mod diferit de temperatura, in functie de natura surfactantului. Aceasta deoarece temperatura actioneaza atat asupra partii nepolare, cat si a celei polare.
Astfel, pentru surfactantii ionici cresterea temperaturii conduce in general la o scadere a CCM pana la o valoare minima, dupa care aceasta creste din nou (Fig.8a ).

Figura 8
Influenta temperaturii asupra concentratiei critice micelare (CCM)
a)-surfactanti ionici; b)-surfactanti neionici
Acest
comportament se explica prin faptul ca pana la temperatura
corespunzatoare valorii minime a CCM (![]() ), entalpia de micelizare este pozitiva,
nefavorabila procesului de asociere, iar la temperaturi superioare
acesteia, entalpia de micelizare are valori negative, favorabile formarii
micelelor.
), entalpia de micelizare este pozitiva,
nefavorabila procesului de asociere, iar la temperaturi superioare
acesteia, entalpia de micelizare are valori negative, favorabile formarii
micelelor.
Pentru surfactantii ionici temperatura la care se formeaza micele se numeste temperatura Kraft. Din punct de vedere macroscopic, aceasta corespunde temperaturii la care o solutie tulbure de surfactant ionic devine limpede prin incalzire.. Cunoasterea temperaturii Kraft prezinta importanta in procesul de formulare a detergentilor.
In cazul surfactantilor neionici CCM scade continuu cu cresterea temperaturii. Aceasta, pentru ca entalpia de micelizare este pozitiva pe tot domeniul de temperatura, probabil datorita scaderii numarului mediu de molecule de apa din jurul grupelor oxietilenice. Pentru surfactantii neionici se evidentiaza un punct de ceata, care corespunde temperaturii la care o solutie limpede devine tulbure prin incalzire.
Un rol important il are temperatura in procesul transformarilor de faza a lipidelor bicatenare termotrope care, in solutie apoasa, formeaza agregate cu structura diferita in domenii de temperatura diferite1.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |