
STRUCTURA SECUNDARA SI TERTIARA A ADN
Legaturile prezente in structura secundara si tertiara a acizilor nucleici sunt comune cu cele din alte tipuri de polimeri biologici. Acestea sunt legaturi cu energie scazuta, a caror multiplicitate determina aparitia unor forte destul de puternice pentru a stabili si mentine coeziunea de ansamblu, in spatiu, si pentru a autoriza modificarile plastice.
Cu toate acestea secventa covalenta a lanturilor polinucleotidice demonstreaza diferente fundamentale fata de proteine. Acestea se traduc prin interactii particulare intre compusi si cu mediul si stau la originea conformatiilor permise. Aceste diferente vin: i) din structura scheletului polimer; ii) prin prezenta substituentilor laterali, bazele azotate, care aduc in structura proprietatile lor originale: planuri apolare susceptibile de stivuire (de suprapunere) si capabile sa realizeze imperecheri specifice prin intermediul gruparilor lor polare.
Consecintele scheletului oza-fosfodiester
Posibilitatile de rotatie
Geometria si conformatia scheletului sunt dictate de posibilitatile de rotatie ale componentelor in jurul legaturilor covalente succesive. Cel putin din punct de vedere teoretic, acestea sunt mult mai numeroase ca cele care pot sa apara in inlantuirea catenelor proteice in care legatura peptidica este plana si rigida si nu isi gasesc echivalent in structura acizilor nucleici. In consecinta, conformatiile posibile ale unui polinucleotid, in ansamblul sau, sunt mult mai complexe decat cele din proteine. Aceasta afirmatie este sustinuta de informatiile structurale privind unghiurile de legatura si posibilitatile de rotatie (torsiune) cat si de interactiile sterice intre grupari si cu moleculele din lanturile vecine.
Se poate realiza o analiza simplificata a fiecarei unitati mononucleotidice (Figura 3.1), independent de vecinii sai, pentru a determina conformatiile probabile, inainte de includerea acesteia in lantul polinucleotidic. In acest mod se realizeaza evaluarea tuturor interactiilor posibile. In cadrul unitatii mononucleotidice, sase dintre legaturile scheletului (a b g d e z) ofera posibilitati de rotatie substituentilor lor (Figura 3.1 Prin cea de a saptea legatura (χ), baza participa la formarea legaturi glicozidice. La acesti factori de conformatie se adauga izomeria conformationala a ciclului furanozic al pentozei discutata in capitolul 1.
In realitate, aceste posibilitati multiple de rotatie sunt supuse unor constrangeri interne care limiteaza gradele de libertate de miscare. In unitatea mononucleotidica si mai ales in polinucleotid, scheletul riboza-fosfat are o conformatie restrictiva, in urma insumarii interferentelor sterice si functionale. Aceasta structura nu este foarte rigida. De asemenea, catenele separate de acizi nucleici sunt destul de flexibile pentru a trece in conformatii dezordonate de tip ghem statistic
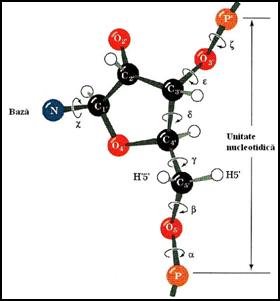
Figura 3. 1. Tipurile de rotatii posibile in structura unei mononucleotide
(dupa Biochemistry,Voet&Voet,1995)
Natura polianionica a acizilor nucleici
Contrar scheletului proteic, polar dar cu sarcina totala neutra, cel al acizilor nucleici este polianionic. Densitatea sa de sarcina negativa, foarte crescuta la pH celular, are urmatoarele consecinte:
i) repulsii intre segmentele lantului care se opun compactarii acestuia. Din aceasta cauza nu ne putem astepta la forme globulare, compacte.
ii) o afinitate electrostatica crescuta pentru cationi minerali si organici. Ionul Mg2+ este un factor important pentru achizitionarea structurilor spatiale si stabilizarea acestora (Figura 1.23). Ca urmare a acestei afinitati, peptidele si proteinele incarcate pozitiv la pH fiziologic, se pot fixa pe scheletul acizilor nucleici.
Legatura de hidrogen
Pentru acizi nucleici, modul de formare a structurilor sub forma de elice (helix) este diferit de cel cunoscut pentru proteine datorita fortelor de repulsie si afinitatii electrostatice crescute precum si a interactiilor dintre baze (pe care le vom discuta in continuare). De fapt, in cazul acizilor nucleici, legaturile de hidrogen nu se stabilesc intre polii scheletului, ci intre echivalentii lanturilor laterale, bazele.
Imperecherea specifica a bazelor
Regula lui Chargaff
Compozitia ADN a fost stabilita abia in anii 1940, la 70 de ani de la descoperirea sa. Chargaff a stabilit compozitia ADN prin hidroliza si cromatografie si a remarcat urmatoarele:
a) continutul in purine (A+G) este egal cu cel in pirimidine (C+T), indiferent de originea celulara a speciilor de ADN;
b) fractiile molare ale bazelor sunt astfel distribuite incat A=T si G=C.
La acea epoca nu a fost inteleasa greutatea acestor observatii care au fost numite mai tarziu "regula lui Chargaff". ARN nu prezinta aceste doua caracteristici.
De retinut ca, valorile sumelor A+T si G+C nu sunt egale. Acestea sunt specifice tipului si provenientei moleculei de ADN. Astfel, continutul G+C poate reprezenta intre 35 si 75% din continutul total al bazelor.
Imperecherile Watson si Crick
La inceputul anilor 1950, James Watson a propus o explicatie pentru stoechiometria Chargaff a bazelor, in urma realizarii unor machete moleculare: cuplurile Pur-Pyr se stabilesc prin legaturi de hidrogen care apar intre bazele care prezinta o anumita complementaritate. In acelasi context, specialistul in cristalografie Francis Crick a inteles ca hartile ADN, obtinute prin difractie cu raze X, pot fi interpretate printr-un complex de duble helixuri imperecheate prin intermediul acestor cupluri.
Cei doi cercetatori au definit aceste imperecheri ca fiind de tip "Watson si Crick" (Figura 3.2). Ele reprezinta asocierea specifica dintre: i) A si T (sau U) prin doua legaturi de H; ii) G si C prin trei legaturi de H (o asociere mult mai solida).
In structura ADN, ansamblul celor doua baze imperecheate este plan, iar lungimea totala a acestor cupluri este identica (Figura 3.2
Studiul imperecherilor
Datorita importantei lor cruciale in formarea structurilor in dublu helix si in copierea fidela a informatiei in cazul replicarii sau transcriptiei, caracterul specific al acestor imperecheri a determinat si mai determina un numar mare de studii. Principale metode folosite sunt:
a) cristalizarea bazelor si derivatilor lor si co-cristalizarea diferitelor perechi urmata de analize prin difractie cu raze X a geometriilor de asociere;
b) masurarea energiei de legatura;
c) determinari prin spectroscopie IR si RMN - care diferentiaza speciile libere de formele imperecheate. Se realizeaza determinarea constantelor de asociere a bazelor identice, diferite sau modificate prin folosirea unor solventi neutri fata de legaturile de hidrogen;
d) masurarea directa a fortelor si a importantei atractiilor. Se confectioneaza doua suprafete acoperite cu bazele de studiat. Una dintre acestea este legata la un resort iar cealalta este apropiata controland distanta prin interferometrie optica (precizie de 1/10 din raza atomica). Masura fortelor care se exercita intre baze este data de deformarea resortului respectiv.
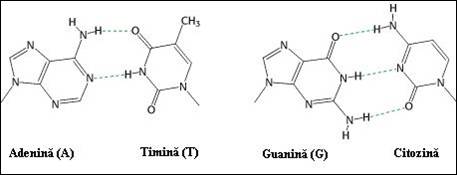
Figura 3. Imperecheri pirimidina-purina conform Watson si Crick (formarea legaturilor de hidrogen).
Bilantul tipurilor de investigatii, trecute in revista mai sus, este rezumat in urmatoarele concluzii
a) Existenta mai multor tipuri de imperecheri diferite: in structura ADN perechile A-T si C-G se imperecheaza dupa modelul Watson si Crick. Cu toate acestea, perechea A-T co-cristalizeaza si in geometria denumita a lui Hoogsteen (Figura 3.3), care este diferita. Modalitatea de imperechere Hoogsten, descrisa in figura 3.3., se intalneste in fragmentele de triplu helix ADN sau in structura ARNt, constituind factori de stabilizare a structurii tertiare.
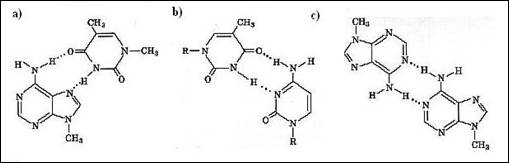
Figura 3. Imperecheri diferite de tipul "Watson-Crick": a) imperecherea de tip Hoogsten a derivatilor cuplurilor T-A (gruparea metil inlocuieste pentoza); b) imperechere ipotetica intre C si T; c) imperechere de adenine in structura cristalului de 9-metil-adenina
b) Evaluarea selectivitatii atractiei bazelor: incepand din anii 1970, masuratorile energiilor de legatura si ale constantelor de asociere au demonstrat preferinta energetica a bazelor pentru stabilirea de cupluri. Datele prezentate in tabelul 2. 6 sunt elocvente in acest sens. In raport cu autoasocierea, imperecherile Watson-Crick au o energie de legatura mult mai puternica si o constanta de asociere de 15 la 1 000 ori mai mare. Masura directa a fortelor de atractie confirma valorile energiei de legatura si evidentiaza ca atractia A-T domina pe distanta scurta (10-20 nm) in timp ce la distante mai mari bazele par sa se atraga indiferent de natura lor.
De retinut ca in situ, in structura polinucleotidelor, aceste caracteristici de legatura nu sunt constante fiind dependente de bazele vecine, deci de secventa primara.
c) Explicatia selectivitatii: este evident ca asocierea specifica, in functie de regulile lui Watson si Crick, depinde de posibilitatea stabilirii numarului de legaturi de hidrogen necesare. Astfel, apare obligativitatea ca gruparile implicate sa prezinte o geometrie complementara adecvata care este dependenta de formele tautomere pe care le adopta bazele (Figura 1.6). Totusi, aceste consideratii nu sunt suficiente pentru a explica total specificitatea de imperechere. In aceste conditii, s-a avansat ipoteza existentei unei complementaritati electronice intre A - T, si C - G, care pentru moment nu este complet elucidata.
Ierarhia plierii ADN
Interactiile si conformatiile elementare pe care le-am descris sunt, asemeni cazului proteinelor, dictate de structura primara specifica a acizilor nucleici. Compozitia si secventa bazelor vor determina replieri ale polimerului intr-o structura spatiala globala. Atat pentru ADN cat si pentru ARN putem defini mai multe nivele de organizare structurala.
Nivelul structurii secundare
Acest nivel este cel al imperecherii locale a bazelor provenind din doua fragmente antiparalele (de zeci la mii de nucleotide), cu consecintele de rasucire in diverse tipuri de elice, pe care le vom descrie in continuare. Fragmentele care se imperecheaza apartin la doua catene diferite sau pot sa faca parte din aceeasi catena.
Aceste elice (helixuri), formate prin stivuirea planurilor bazelor fata de o axa, le consideram structuri in doua dimensiuni (2-D). Ele pot fi uneori separate de fragmente ne-imperecheate sau imperecheate diferit.
Nivelul tertiar
Nivelul tertiar este constituit din rasuciri, plieri sau suprarasuciri ale elicelor. Se formeaza structuri arhitecturale in trei dimensiuni (structuri 3-D) care confera macromoleculei conformatia sa globala. Aceste structuri vor fi analizate, pentru ADN, in paragrafele urmatoare si pentru ARN in capitolul patru.
Nivelurile superioare de organizare, asocieri exceptionale de subunitati, pentru a forma structuri cuaternare cu grade complexe de compactare la nivelul cromozomilor vor fi descrise succint in capitolul cinci.
Structura spatiala a ADN
Organizarea acestor polimeri, a caror marime deosebita a fost evidentiata, este dominata de celebra dubla-elice (dublu helix sau duplex). Sunt deja cunoscute structura, deosebit de repetitiva si uniforma, dar si variatiile si deformarile modelului de rasucire la nivel secundar si tertiar.
Dublul helix - Modelul Watson si Crick
Anul 1953 are o importanta deosebita pentru biologie: descoperirea structurii spatiale a ADN urma sa deschida calea cunoasterii mecanismelor ereditatii si ale biosintezei proteice, primele mari realizari ale domeniului biologiei moleculare. Utilizand si asambland toate cunostintele anterioare privind compozitia ADN, tautomeria bazelor, modelele moleculare anterioare, spectrele de difractie cu raze X (furnizate de M. Wilkins si R. Franklin), Watson si Crick au reusit, in acest an de gratie, sa deduca modelul de organizare in dubla elice si sa demonstreze existenta structurii denumita de atunci ADN B.
Rasucirea in dubla elice
Conformatia ADN B este cea mai raspandita in natura si are urmatoarele caracteristici responsabile de rasucirea in dubla elice:
1) Este formata din doua catene polideoxiribonucleotidice cu secvente simetrice asociate prin imperecherea bazelor complementare. Sensul celor doua catene este obligatoriu opus: acestea sunt antiparalele (Figura 3.4.
2) Asocierea celor doua catene determina aparitia de constrangeri care se traduc prin rasucirea obligatorie, in elice, a unei catene in jurul celeilalte. Catenele nu pot fi separate decat daca pierd structura elicoidala regulata. Dubla elice (Figura 3.5) are cateva caracteristici bine definite:
a) bazele sunt imperecheate si stivuite prin intermediul planurilor lor, care au lungime egala, si constituie un cilindru central;
b) inlantuirile pentoza-fosfat polianionice formeaza scheletele elicoidale paralele exterioare, planurile bazelor fiind aproape perpendiculare pe cele ale bazelor;
c) marea axa a ansamblului este perpendiculara pe planul de stivuire a bazelor.
Aceasta structura monotona, de o remarcabila regularitate, se stabileste pe toata lungimea unei molecule si ii confera un caracter fibros. Ea este mentinuta prin doua ansambluri de forte, discutate in capitolul precedent: legaturile de hidrogen care se formeaza intre bazele celor doua catene si fortele de stivuire.
Caracteristicile geometrice ale structurii 2-D de tip B
Structura in doua dimensiuni a acizilor nucleici prezinta urmatoarele caracteristici: i) din cele doua sensuri de rasucire, posibile teoretic - drept/stang, care determina obtinerea unor structuri care constituie fiecare imaginea rasturnata a celeilalte in oglinda, pentru ADN se impune modelul considerat conventional drept. Acesta este dictat de geometria scheletului pentoza-fosfat ii) dimensiunile elicei (helixului) sunt indicate in tabelul 2.7. Elicea contine, in medie, 10 perechi de baze pe tura, care au un pas de 3,4 nm si un diametru de 2 nm. Distanta dintre planurile bazelor este corespunzatoare grosimii nucleelor in contact; iii) datorita pozitiei axei in centrul fiecarei perechi de baze si de atasarea lor covalenta di-simetrica pe schelet, se formeaza doua fose (mare si mica) care au deschidere si profunzime diferita si care alterneaza la nivelul flancurilor elicei, pe toata lungimea acesteia (Figura 3.5). Morfologia acestor fose sufera variatii locale, in functie de secventa de baze. De exemplu, intr-o regiune bogata in A-T, fosa mica este mult mai ingusta decat in cazul unei regiuni bogate in G-C.
d) conformatiile pentozei si legaturii glicozidice in structura unitatilor nucleotidice sunt caracteristice acestui tip de structura (Tabel 3.1
Conformatia B, cea descrisa de Watson si Crick, este cea mai stabila in conditii fiziologice si deci considerata drept forma nativa de referinta pentru ADN. Totusi, flexibilitatea relativa a structurii ii permite acesteia sa adopte si alte conformatii duplex, dintre care doua sunt bine caracterizate prin cristalografie. In tabelul 3.1 sunt grupate caracteristicile diferitelor conformatii iar in figura 3.5. este prezentat modelul conformatiei B.
Conformatia A
Daca se concentraza o solutie de ADN in apa, moleculele incep sa treaca reversibil intr-o conformatie diferita, care a fost numita A. ADN-A este tot o dubla elice dreapta dar cu o geometrie particulara:
i) aceasta este mult mai compacta; pentru acelasi numar de perechi de baze lungimea sa totala este mai redusa iar diametrul este mai mare decat in cazul ADN-B. Ca urmare acestei structuri bazele sunt mai putin accesibile;
ii) planurile bazelor sunt rasucite cu 1800 in raport pozitia celor din forma B si sunt mult inclinate fata de axa, ceea ce striveste si adanceste fosa mare si aplatizeaza pe cea mica. In acest caz, calificativele de fosa mare si mica isi pierd sensul;
iii) conformatia furanozei trece in 3E (C3' endo) (Figura 1.15
In vivo, conformatia A este adoptata de: i) ADN din anumiti spori bacterieni formati ca raspuns la uscarea mediului. Aceasta trecere poate explica rezistenta la conditii extreme si efectul de dimerizare al radiatiilor UV; ii) imperecherile locale sub forma de dubla elice ale ARN, care prezinta o preferinta neta pentru conformatia C3' endo a pentozei (3E); iii) hibrizi ARN-ADN care se formeaza tranzitoriu in timpul procesului de amorsare a replicarii si in timpul transcriptiei.
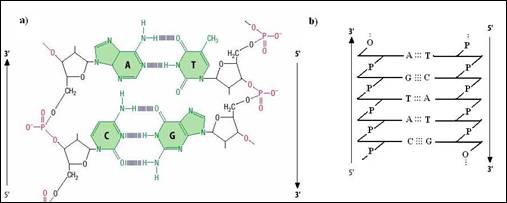
Figura 3. Legaturi de hidrogen intre bazele complementare din structura catenelor elicei ADN: a) reprezentare in plan a legaturilor de hidrogen; b) prezentare schematica plana a vectorizarii catenelor.
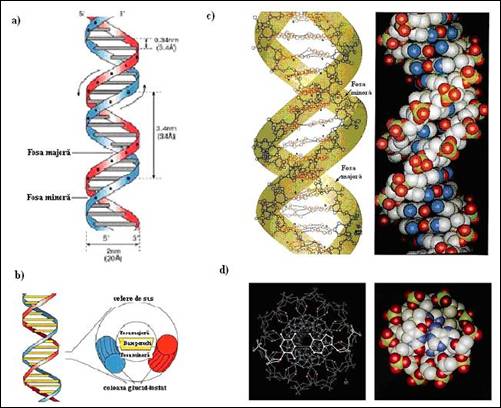
Figura 3.5. Structura ADN B: a) imagine schematica a dublei elice cu evidentierea dimensiunilor, b) vedere schematica de sus; c) imagini ADN B cu evidentierea scheletului riboza-fosfat si a planului bazelor; d) vederi de sus cu evidentierea cilindrului central (adaptata dupa Biochemistry, Voet&Voet, 1995)
Tabel 3. . Caracteristicile diferitelor conformatii ale elicelor ADN
|
Caracteristici |
conformatie B |
conformatie A |
conformatie Z |
|
sens de rasucire |
Drept |
drept |
Stang |
|
numar de pb/tur |
12 (6 di-nucleotide) |
||
|
inaltimea pe ax pe tur (pas) pe plan de baze |
3,4 nm 0,34 nm |
2,8 nm 0,26 nm |
4,5 nm 0,37 nm |
|
inclinarea bazelor fata de ax rotatia planului bazelor |
-600/dinucleotida |
||
|
Diametru |
2 nm |
2,3 nm |
1,8 nm |
|
Conformatii |
|||
|
dPyd: pentoza |
E |
E |
E |
|
legatura glicozidica |
Anti |
anti |
Anti |
|
dPuo: pentoza |
E |
E |
E |
|
legatura glicozidica |
Anti |
anti |
Syn |
|
fosa: mare |
mare si profunda |
ingusta si profunda* | |
|
Mica |
ingusta si profunda |
mare si profunda* |
ingusta si profunda |
in text este explicata aceasta aparenta contradictie
Conformatia Z
Este o structura radical diferita de precedentele deoarece se formeaza prin rasucirea elicei spre stanga. Pentru prima data, a fost evidentiata, in vitro, prin cristalografie cu raze X, la 25 de ani de la descoperirea conformatiei B de catre Watson si Crick. Aceasta conformatie este prezenta in segmentele de secventa alternante Pur-Pyr (-G-C-G-C-). Unitatea de structurala de baza este dinucleotidica. Componenta purinica prezinta o conformatie care prezinta modificari la nivelul formei "anvelope" a pentozei si a pozitiei bazei.
Aceasta conformatie Z a fost detectata la procariote si la eucariote, la nivelul secventelor bogate in metil-citozine, ale caror grupari hidrofobe favorizeaza formarea structurii. Analiza structurii primare evidentiaza ca anumite regiuni scurte de ADN prezinta alternanta necesara pentru adopta conformatii Z. Acestea ar putea avea rol de comutator al expresiei genelor ca urmare a trecerii reversibile din conformatie B in Z. Cu siguranta ca acest proces este foarte costisitor care din punct de vedere energetic.
Este general admis ca, in conditii fiziologice (tarie ionica si pH celular), apare necesitatea unei etape indispensabile de pregatire prealabila a dublei catene, de exemplu printr-o supra-rasucire. Cu ajutorul spectroscopiei prin dicroism circular a fost identificata net existenta conformatiilor B si Z si posibilitatile de tranzitie ale acestora (Figura 3.7
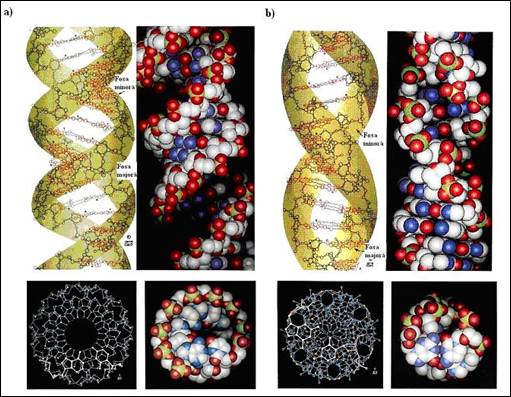
Figura 3.6. Alte conformatii ADN: a) conformatia ADN A - vedere normala si de sus; b) conformatia Z - vedere normala si de sus (adaptata dupa Biochemistry, Voet&Voet, 1995)
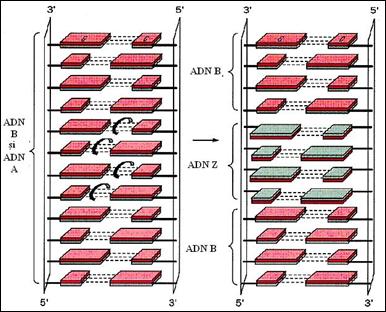
Figura 3. Model privind posibilitatea de trecere din conformatia B in Z (dupa Biochemistry, Voet & Voet, 1995)
Evidentierea ADN-Z
Pana la sfarsitul anilor 1970 nu a fost contestata dubla elice dreapta prin evidentierea altor conformatii. In 1979, in SUA, Rich a obtinut ADN "de stanga" sau ADN-Z. Rezultatul a fost obtinut folosind un oligonucleotid artificial dublu-catenar cu secventa: d(CGCGCG).
Aceasta alegere, in care alterneaza o baza pirimidinica si una purinica, poate fi considerata a priori arbitrara. Astfel de secvente exista in vivo, chiar daca sunt rare. Experimentul prin care s-a demonstrat ca un polimer artificial, cu o anumita structura, poate adoptata conformatie Z a fost realizat in conditii de concentratii in saruri ale mediului foarte ridicate. Dupa 1982, a fost posibila obtinerea ADN-Z in conditii mult mai apropiate de cele fiziologice. S-a constatat ca este suficienta metilarea secventelor de ADN la nivelul citozinei sau realizarea experimentului in prezenta anumitor poliamine de tipul sperminei. De asemenea, la sfarsitul anului 1982, a fost posibila prima evidentiere a prezentei ADN-Z in structura materialului genetic viu (cromozomi de insecte si de razatoare) prin folosirea de anticorpi specifici directionati catre ADN-Z. Din acest moment ADN-Z nu a mai constituit numai o curiozitate de laborator. Un an mai tarziu, prezenta acestei forme a fost evidentiata si la nivelul cromozomilor de la om.
Caracteristicile ADN-Z
ADN "de stanga" nu este imaginea in oglinda a ADN "de dreapta". Acesta are o conformatie care difera prin:
a) scheletul pentoza-fosfat este in zig-zag in loc sa formeze o spirala regulata cum este cazul ADN-B, de unde si numele de ADN-Z pe care l-a primit structura;
b) ADN-Z formeaza un helix mai zvelt si mult mai putin rasucit decat ADN-B. El poseda un numar mai mare de perechi de baze pe fiecare tura de elice: 12 pb in loc de 10/10,5 pb in ADN-B. Pasul elicei este de 4,6 nm (in loc de 3,4 nm pentru ADN-B) si diametrul de 1,8 nm fata de 2,4 pentru ADN-B;
c) bazele sunt, asemeni structurii ADN-B, orientate in interiorul helixului. In structura ADN-Z acestea sunt mult mai accesibile (conformatie anti pentru citozina sau timina si sin pentru guanina sau adenina) decat in structura ADN-B (conformatie anti pentru toate tipurile de nucleotide) unde sunt aproape inaccesibile. Aceasta alternanta anti-sin produce aspectul de zig-zag al scheletului helixului. Spre deosebire de ADN-B, ADN-Z are oxigenul ciclului pentagonal, de pe aceeasi catena, orientat alternativ in sus si in jos. Astfel, in ADN-Z nucleul imidazol al guaninei (in particular N7 si C8) este mult mai accesibil.
Deci, conformatia ADN-Z este favorizata de o alternanta pirimidina si purina. Tendinta dinucleotidelor pirimidinice-purinice de a forma secvente ADN-Z descreste in ordinea: m5CG > CG > TG = CA > TA (m5C este citozina metilata in pozitia 5)
Se pare ca ADN Z apare mai frecvent la procariote decat la eucariote. Aceasta tendinta poate fi corelata cu faptul ca secventele CG sunt net mai numeroase in structura ADN la procariote decat la eucariote.
In solutii fiziologice, ADN-Z este mai putin stabil decat ADN-B. Acest fapt este datorat in mare parte repulsiilor electrostatice care apar intre gruparile fosfat incarcate negativ. Aceste grupari fosfat sunt mai apropiate in ADN-Z (elice mai zvelta) decat in ADN-B unde cele doua catene sunt mult mai departate. Astfel se explica de ce evidentierea initiala a structurilor a putut fi facuta numai pentru solutii ADN bogate in saruri, care reduc fortele de repulsie dintre gruparile fosfat.
Interesul pentru ADN-Z
Nu se cunoaste inca exact functia ADN-Z. Totusi, se pare ca acesta joaca un rol biologic important. Este unanim acceptat ca, secventele CG par sunt implicate in controlul expresiei genelor. Astfel, cel mai adesea, aceste secvente sunt metilate (la nivelul citozinei) in genele inactive si invers, nemetilate in genele frecvent exprimate. De asemenea, se stie ca metilarea secventelor CG favorizeaza foarte mult formarea ADN-Z. Se considera ca unul dintre mecanismele posibile implicate in reglarea expresiei genelor o reprezinta capacitatea, in vivo, a anumitor secvente CG de a adopta o conformatie ADN-Z (dublu helix "de stanga") in mijlocul unei zone de dublu helix "de dreapta".
Pe de alta parte, anumite proteine cu un rol reglator important ("Z-DNA binding protein"), sunt capabile sa se lege specific la ADN-Z si nu la ADN-B.
In concluzie
Datele prezentate mai sus ne confirma ca ADN nu contine numai informatia "codanta" care dirijeaza sinteza ARN, prin secventa sa nucleotidica, ci si o informatie "conformationala" determinata de prezenta anumitor secvente nucleotidice (ex. succesiunile CG). Aceste informatii conformationale ar putea permite ca segmente din structura ADN sa adopte conformatii diferite (ex. ADN-Z) care ar putea astfel juca un rol important in anumite mecanisme de reglare biologica, in particular la nivelul transcriptiei.
ADN nu este considerata o molecula statica. Aceasta trebuie privita mai mult ca o structura dinamica, flexibila, la nivelul careia unele conformatii sunt in echilibru cu altele.
Conformatia de tripla elice (triplu helix)
Pentru diferite regiuni de ADN a fost identificata o conformatie de tripla elice (triplu-helix H). Aceasta conformatie poate fi adoptata de unele dintre secventele particulare despre care vom discuta in continuare.
Un numar secvente particulare prezente in structura primara sau fixarea anumitor proteine produc modificari conformationale locale in structura 2-D a acizilor nucleici.
Secventele repetitive
Unele regiuni din structura ADN se indeparteaza de geometria standard de dublu helix prin aparitia unei curburi la nivelul axei mari. Aceasta modificare este adesea rezultatul fixarii unei proteine dar poate fi, la fel de bine, rezultatul repetarii anumitor secvente in regiuni ale structurii ADN la nivelul carora nu s-au legat proteine.
O scurta repetitie a aceleiasi baze pe o catena, formata de exemplu din 4 la 6 A sau T una dupa alta, produc local, prin inclinarea planurilor, o conformatie B mai rigida. Aceasta se caracterizeaza printr-o fosa mica mai ingusta si un pas mai mare decat in conformatia B normala. Repetarea periodica a acestei suite, separata prin serii aleatoare de aceeasi lungime, cumuleaza efectul. Aceste molecule vor migra mai repede deoarece fortele de frictiune la nivelul lor sunt mai reduse in raport cu forma baton. Se considera ca aceste deformari sunt implicate direct in interactiile dintre diferitele regiuni de ADN si proteinele globulare.
Secventele polipirimidinice
O alta structura foarte particulara rezulta dintr-o asimetrie Pur/Pyr intre cele doua catene. Daca regiunea luata in discutie este destul de lunga, dubla catena se desface pe o portiune, catena eliberata, bogata in pirimidine se repliaza si se dispune in fosa mare la nivelul restului catenei ramasa sub forma de duplex. Pozitionarea se realizeaza prin stabilirea de imperecheri de tip Hoogsteen cu purinele care la randul lor fac parte integranta din dubla catena. Astfel, se formeaza o elice tripla (denumita H de la Hoogsteen), ale carei planuri sunt triade de tip T-A x T si C-G x C (unde x marcheaza imperecherea Hoogsteen) (Figura 3.9.
In mod analog, o tripla elice eterogena se poate forma intre un ADN bicatenar si o catena de la o alta specie (ADN sau ARN). Astfel de structuri ar putea responsabile de initierea schimburilor de secvente implicate in recombinarea genoamelor.
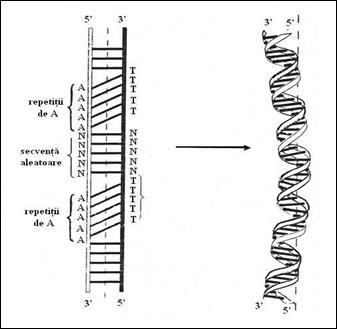
Figura 3. Curbura impusa dublului helix de catre repetarea secventiala a bazelor.
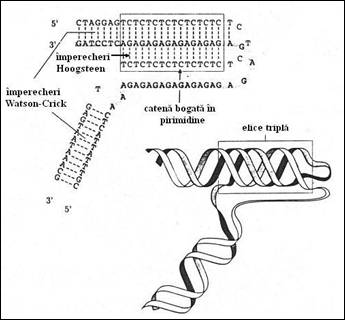
Figura 3. Imperecherea si schema triplei elice H a ADN
Secventele palindromice
Se cunoaste ca palindroamele prezinta pe aceeasi catena o secventa si complementul sau (secventa sa complementara). Aceste regiuni manifesta preferinta de imperechere intre ele prin auto-complementaritate decat tendinta de imperechere complementara cu cealalta catena a elicei (Figura 3.10 Aceasta situatie este frecventa in cazul monocatenelor ARN, structura in "ac de par" fiind un motiv secundar important al structurii lor. In cazul ADN, aparitia unor astfel de structuri cruciforme pare sa fie rezervata secventelor mai putin stabile din structura dublei elice si anume celor bogate in baze A si T care alterneaza.
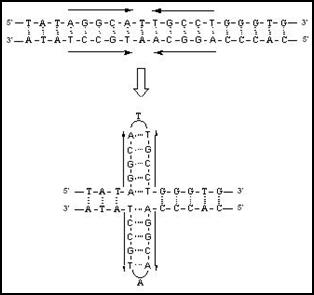
Figura 3. . Consecintele prezentei secventelor repetitive pentru structura secundara a ADN. Existenta unor secvente repetitive inversate poate provoca imperecheri ale regiunilor de pe aceeasi catena. Cum cele doua catene sunt complementare o imperechere poate determina o imperechere simetrica pe cea de a doua catena. Rezultatul il reprezinta formarea unei structuri cruciforme.
Topoizomeri si topoizomeraze
Majoritatea cromozomilor bacterieni sunt suprarasuciti in celule. De asemenea, chiar moleculele de ADN lineare lungi contin regiuni suprarasucite local. In mod normal, cromozomii bacterieni poseda aproximativ cinci suprarasuciri pentru fiecare 1000 perechi de baze ADN. De asemenea, ADN din nucleii celulelor eucariote este suprarasucit. Toate organismele poseda enzime care pot scinda ADN pentru a de-rasuci sau suprarasuci moleculele de ADN in scopul modificarii topologiei acestuia in functie de necesitatile fiziologice ale celulei.
Caracterizare generala
Super-helixurile 3-D ale ADN
In vivo, ADN nu ramane linear. El se gaseste in cea mai mare parte a genoamelor sub forma inchisa:
a) molecula este inchisa prin formarea de legaturi 3'-5' ester intre extremitatile sale, deci, este forma de forma ADN circular inchis. Este cazul unor virusuri, plasmide, ADN mitocondrial si ADN din cloroplaste.
b) extremitatile sunt ancorate la nivelul unor puncte fixe pe o matrita: i) cazul cromozomului nucleoid de la procariote; ii) matricea nucleara de la eucariote, unde ADN este sub forma de bucle care intra in contact strans cu proteinele.
In aceasta topologie, cele doua catene sunt indispensabile, chiar daca sunt desfacute. Starea duplexului in momentul inchiderii sale poate sa il supuna la forte suplimentare de constrangere la care acesta trebuie sa raspunda.
Supra-rasucirile dublului helix
Conceptul de supra-rasucire a fost introdus ca urmarea a observatiilor facute de J. Vinograd (1963) asupra comportamentului anormal la ultracentrifugare al moleculelor de ADN circular ale virusului animal SV40. Cu toate ca se afla in stare pura, acesta se repartiza in functie de conditii sau de pre-tratament in trei zone de densitati diferite: 14, 16 si 20S. Existenta unei alte benzi cu densitate foarte mare, 53S, a fost explicata ca fiind rezultatul unei posibile denaturari pe care o vom analiza mai tarziu. Autorul a interpretat aparitia celor trei benzi prin existenta a trei forme mai mult sau mai putin compacte ale aceleiasi molecule: i) 14S, molecule lineare; ii) 16S, molecule circulare "relaxate" care reprezentau eventuale forme modificate; iii) 20S, singura forma nativa care contine ADN circular compactat printr-o suprarasucire a dublului helix.
Demonstrata ca fiind starea fiziologica a moleculelor de ADN, aceasta suprarasucire este indusa printr-o rasucire a moleculei prealabila inchiderii sale. Pentru facilitarea explicatiei consideram o molecula ipotetica de 374 pb care va fi utilizata drept exemplu (lungimea reprezinta 1/14 din marimea virusului SV40). Modelul utilizat se considera a fi un duplex linear in conformatie B cu 36 ture (374/10,4). Molecula poate fi analizata sub diferite forme si conditii (Figura 3.11
a) ca o structura fara tensiuni suplimentare numita "relaxata";
b) fixam o extremitate si derulam dublul helix cu un anumit numar de ture, de exemplu 3, inainte de a inchide molecula. Molecula inchisa trebuie sa compenseze aceasta constrangere (modificare). Ea poate realiza acest lucru in doua moduri care corespund la doua conformatii 3-D limitate: i) rasucirea se realizeaza pe cele 33 de ture ale helixului B ramas, deficitul de 3 ture dand nastere unei regiuni de ne-imperechere, sub forma unei bule de ADN denaturat; ii) dubla elice se poate reface sub forma a 36 de ture si tensiunea aparuta poate fi compensata de formarea unei torsade a duplexului sub propria sa axa de 3 super-ture in sensul in care elicea ADN se deruleaza. Aceasta suprarasucire, care este de pas drept ca si elicea, este numita, prin conventie, negativa.
Forma (b.i) este energetic defavorabila. In conditii normale moleculele de ADN adopta o conformatie supra-rasucita negativa (b.ii). In experientele lui Vinograd, aceasta este forma cu densitatea cea mai mare 20S. 16S corespunde moleculei circulare relaxate obtinuta prin ruperea unei catene iar 14S este forma lineara rezultata prin scindarea celor doua catene.
In vitro, este posibila supra-rasucirea unui duplex prin introducerea de ture suplimentare in sensul elicei. Aceasta supra-rasucire pozitiva este practic absenta in structurile biologice. Situatia ar putea fi explicata prin faptul ca presiunea de rasucire impusa dublului helix este mai greu de disociat opunand o rezistenta care impiedica molecula de ADN sa-si realizeze functiile vitale (replicarea si transcriptia).
Parametrii pentru caracterizarea formarii super-elicelor
Pentru a intelege mai bine formarea super-helixurilor ADN si caracteristicile acestora au fost definiti o serie de parametrii. Nomenclatura conventionala curenta, folosita pentru definirea parametrilor topologici este urmatoarea:
Densitatea de supra-rasucire ("superhelical density") notata conventional cu s este numarul de super-ture pentru o tura de dubla elice. Pentru forma b.ii din exemplul nostru, s are valoarea -3/36 = -0,08. Marea majoritate a moleculelor de ADN naturale au o densitate de supra-rasucire aproximativ asemanatoare, cuprinsa intre -0,05 si -0,06 (sau de la -5 la -6%).
Numarul de inlantuiri L ("linking number") care se defineste ca numarul de ture ale unei catene in jurul axei dublei elice intr-o molecula circulara dispusa ipotetic pe o suprafata plata. Acest numar este considerat conventional pozitiv pentru dubla elice de dreapta, si este un numar intreg si constat pentru o molecula inchisa.
Moleculele care nu difera decat prin indicele L sunt denumite topoizomeri (formele 2a si 2b din figura 3.11). Interconversia lor este posibila numai prin taierea si re-sudarea obligatorie a uneia dintre cele doua catene.
Pentru a intelege mai bine exemplificam pentru ADN circular al virusului SV40 (aprox 5 300 pb) care are urmatoarele caracteristici:
forma relaxata: L = 500 (5 300/10,6)
forma nativa: L = 475
s
Pentru a aduce precizari asupra formelor supra-rasucite ale dublelor elice si a putea diferentia formele cu acelasi numar L (de exemplu a si b) apare necesitatea definirii altor doi parametri topologici: T si W.
Numarul de rasuciri T ("twisting number") care este o caracteristica intrinseca a dublei elice si reprezinta numarul sau total de ture (nr. total de baze/nr. baze pe tura pentru a da nastere structurii ipotetice dispusa in plan);
Numarul de supra-rasuciri, W ("writhing number") care este un indiciu veritabil asupra supra-rasucirii moleculei. Acesta descrie modul de rotire al axei duplexului in spatiu. W este 0 pentru molecula relaxata, si aproximativ, numarul de super-ture cu semnul sau corespunzator, pentru forma supra-rasucita. De retinut ca intotdeauna L= W + T
Spre deosebire de L, care are o valoare fixa asociata entitatii globale inchise, T si W reprezinta insumarea caracteristicilor locale ale secventelor si nu sunt neaparat numere intregi. Valoarea relativa a celor doua componente este determinata energetic. Pentru un anumit tip de ADN, starea energetica minima este aceea pentru care variatia L, provocata de trecerea la conformatia suprarasucita, se traduce aproximativ 70% in parametrul W. In cazul exemplului utilizat daca L trece de la 36 la 33, forma rasucita stabila va avea W egal cu -2,1 (-3 x 0,70) (Figura 3.11
Structura topoizomerilor si topoizomerazelor
Asa cum am constata in prezentarea generala, doua molecule de ADN circulare, care au aceeasi secventa de baze, pot sa difere intre ele prin parametrul L, numit numar de inlantuiri, adica numarul de ture pe care o catena o face in jurul celeilalte. Aceste doua forme moleculare, a caror singura diferenta este numarul de rasuciri, se numesc topoizomeri.
Notiunile care vor fi utilizate in continuare (tensiune, constrangere) nu sunt aplicabile teoretic decat inelelor de ADN (moleculelor circulare cu capete inchise), si nu moleculelor de ADN lineare, ale caror extremitati sunt libere. Totusi, o molecula de ADN linear se poate comporta ca o molecula de ADN circular daca fiecare dintre cele doua extremitati este legata intr-un punct de ancorare, situatie absolut normala in celule.
Tot in prezentarea generala am constatat ca numarul de rasuciri reprezinta o constanta topologica. Indiferent de deformarile pe care le sufera o molecula de ADN, ale carei extremitati sunt fixe, nu vom schimba numarul de rasuciri. Deci, modificarea numarului de perechi de baze pe tur de elice, in dreptul unei bucle a ADN, va fi in mod necesar compensata de o supra-rasucire de sens opus (pozitiva sau negativa) in amonte sau in aval de acest loc (Figura 3.11
Diferitele stari ale topoizomerilor
Starea relaxata:
In starea numita "relaxata", constrangerea sau tensiunea existenta la nivelul dublei elice este minima. Analizele fizico-chimice efectuate pe fibre cristaline de ADN-B au indicat ca aceasta stare exista pentru 10 perechi de baze pe tur. In celule, ADN are o conformatie apropiata de cea a ADN-B. Totusi, in aceasta stare netensionata ADN are 10,5 perechi de baze pentru fiecare tura a spirei, in loc de 10 (Klug, Premiul Nobel pentru chimie 1982). Aceasta valoare este de fapt o medie, ea putand varia pe distante scurte in molecula de ADN, deoarece acesta este asociat cu proteine.
Starea supra-rasucita
Axa dublului helix se poate rasuci sub ea insasi formand o super-elice. Teoretic, sunt posibile doua forme de supra-rasucire ("supercoiling"):
a) supra-rasucire pozitiva: numarul de rasuciri a fost crescut; tensiunea care apare determina formarea unui super-elice "pozitiva" sau stanga;
b) supra-rasucire negativa: numarul de rasuciri a fost diminuat; axa dublei elice se rasuceste formand o elice "negativa" sau dreapta.
Supra-rasucirea negativa = de-rasucire
Cea mai mare parte a moleculelor de ADN, din natura, formeaza suprarasuciri negative (super-elice de dreapta), prin derularea a aproximativ unui tur pentru fiecare 200 perechi de baze. In figura 3.12 este prezentata schematic o modalitate de introducere a unei supra-rasuciri folosind modelul unei bratari elastice. Un exemplu casnic de aparitie a unor structuri supra-rasucite il constituie rasucirea firului de telefon.
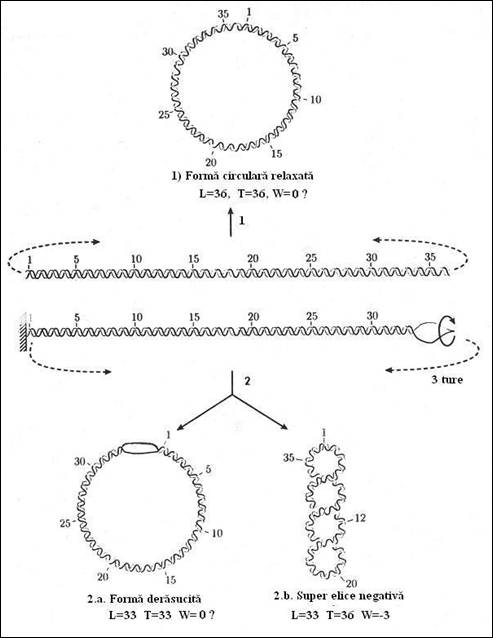
Figura 3. Reprezentarea schematica a diferitelor forme de ADN circular. numerele reprezinta turele dublului helix, iar sagetile punctate regiunile de sudura ale extremitatilor.
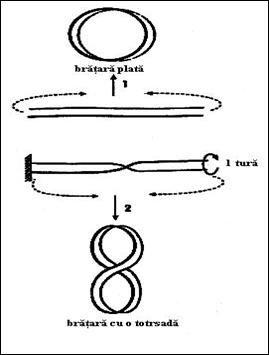
Figura 3. Modelul unei bratari elastice: cele doua laturi pot reprezenta cele doua catene ale dublului helix.
Supra-rasucirea exercita o constrangere asupra moleculei. Aceasta constrangere provoaca o incolacire, atat in cazul ADN supra-rasucit pozitiv cat si a celui supra-rasucit negativ. Obtinerea unui molecule de ADN supra-rasucite (pozitiv sau negativ) necesita aport energetic, situatie logica deoarece se realizeaza trecerea dintr-o stare netensionata intr-o stare tensionata.
Formele de ADN supra-rasucite negativ prezinta un dublu avantaj: i) sunt mai compacte (cum sunt de altfel si formele supra-rasucite pozitiv); ii) sunt mult mai accesibile enzimelor implicate in replicare si transcriptie deoarece se formeaza in urma unei de-rasuciri lejere a dublei elice.
La eucariote, ADN formeaza o super-elice dreapta in urma rasucirii in jurul moleculelor de proteine histonice.
Trebuie sa mentionam ca ADN mitocondrial nu este complexat cu histone. Acesta se afla pur si simplu sub forma de inele supra-rasucite, asemeni ADN bacterian
Concluzie in celule ADN exista sub doua forme: a) stare relaxata (fara constrangeri); b) stare incolacita, rezultatul unei suprarasuciri negative: de obicei -1 tur/200 pb.
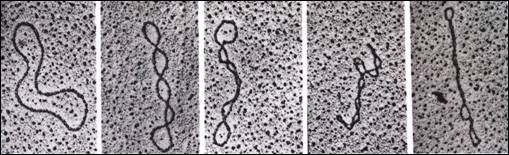
Figura 3.13. Micrografii electronice ale topoizomerilor unei molecule de ADN dublu-catenara circular inchisa: 1) forma relaxata; 2, 3, 4, 5 forme supra-rasucite. (dupa Biochemistry, Voet&Voet, 1995)
Existenta structurilor supra-rasucite ale ADN a fost demonstrata si prin microscopie electronica. In figura 3.13 sunt prezentate micrografii electronice atat pentru forma relaxata cat si pentru diferitele forme suprarasucite.
 Topoizomerii
pot fi separati prin gel electroforeza. In general, cu cat un inel de
ADN este de-rasucit (supra-rasucit negativ), cu atat el este mai
incolacit si mai compact. Teoretic, cu cat un inel este mai compact
cu atat el va migra mai repede, dar mobilitatea electroforetica este
dependenta si de o serie de alti factori. Moleculele de ADN pot
fi vizualizate prin iradierea gelului cu radiatii UV, dupa ce acesta
a fost tratat cu bromura de etidium (BET), substanta care se
intercaleaza intre bazele stivuite ale acizilor nucleici, si
determina aparitia unei fluorescente oranj determinata de
efectul excitatiei UV (Figura 3.14).
Reactia se produce atat in cazul acizilor nucleici monocatenari cat
si dublu-catenari. Afinitatea pentru acizii nucleici monocatenari este mai
mica si deci fluorescenta este mai scazuta. In figura
3.14 este prezentata separarea electroforetica a topoizomerilor SV40
inainte si dupa tratamentul cu topoizomeraza.
Topoizomerii
pot fi separati prin gel electroforeza. In general, cu cat un inel de
ADN este de-rasucit (supra-rasucit negativ), cu atat el este mai
incolacit si mai compact. Teoretic, cu cat un inel este mai compact
cu atat el va migra mai repede, dar mobilitatea electroforetica este
dependenta si de o serie de alti factori. Moleculele de ADN pot
fi vizualizate prin iradierea gelului cu radiatii UV, dupa ce acesta
a fost tratat cu bromura de etidium (BET), substanta care se
intercaleaza intre bazele stivuite ale acizilor nucleici, si
determina aparitia unei fluorescente oranj determinata de
efectul excitatiei UV (Figura 3.14).
Reactia se produce atat in cazul acizilor nucleici monocatenari cat
si dublu-catenari. Afinitatea pentru acizii nucleici monocatenari este mai
mica si deci fluorescenta este mai scazuta. In figura
3.14 este prezentata separarea electroforetica a topoizomerilor SV40
inainte si dupa tratamentul cu topoizomeraza.
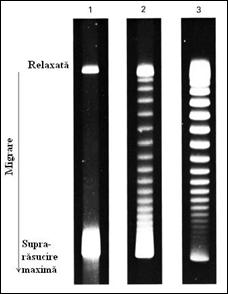
Figura 3. Separarea electroforetica a topoizomerilor SV40: linia 1) migrarea ADN nativ; linia 2) migrarea ADN supus 3 minute tratamentului cu topoizomeraza; linia 3) migrarea ADN supus 30 minute tratamentului cu topoizomeraza.
Topoizomerazele
Sunt enzime care modifica numarul de rasuciri . Deci, ele sunt capabile sa induca sau sa elimine super-turele intr-un dublu helix ADN. Pentru a modifica numarul de inlantuiri este necesara taierea uneia dintre cele doua catene sau a ambelor.
Pana in prezent se cunosc doua tipuri de topoizomeraze: topoizomeraza de tip I si topoizomeraza de tip II.
Topoizomerazele de tip I
Sunt enzime care realizeaza taierea tranzitorie si re-sudarea unei singure catene din structura ADN dublu-catenar relaxand-o prin suprimarea super-turelor negative. Ele aduc ADN supra-rasucit sau tensionat la conformatia sa initiala. Enzimele relaxante de tip I actioneaza dupa urmatorul protocol:
a) Taierea unei catene ADN este realizata la nivelul legaturii fosfodiester. Este eliberata momentan gruparea 3' OH, iar gruparea fosfat din 5' este esterificata cu o tirozina prezenta in situsul activ al topoizomerazei (Figura 3.15). Aceasta reactie de trans-esterificare creeaza un complex tranzitoriu ADN-topoizomeraza. Astfel, energia legaturii fosfodiester scindata la nivelul ADN este conservata temporar sub forma legaturii fosfotirozina.
b) Rotatia catenei taiate: catena eliberata se poate roti liber in jurul catenei intacte.
c) Re-sudarea catenei ADN: legatura fosfodiester este restabilita utilizand energia conservata de legatura fosfotirozina; in general, aceste topoizomeraze nu necesita aport de ATP.
ADN si topoizomerazele sunt regenerate in final, molecula de ADN avand acum o conformatie ne-tensionata.
Topoizomeraze de tip I au fost descrise, pentru prima data la bacterii, dar se gasesc si la om. Structura acestora din urma este diferita de cea de la bacterii, ele putand relaxa nu numai super-turele negative cat si pe cele pozitive (Figura 3.16
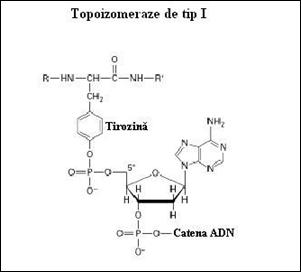
Figura 3. Tirozina prezenta in situsul catalitic activ al topoizimerazei esterifica gruparea 5' fosfat eliberata
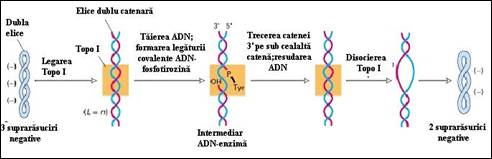
Figura 3. Modul de actiune al topoizomerazelor de tip I
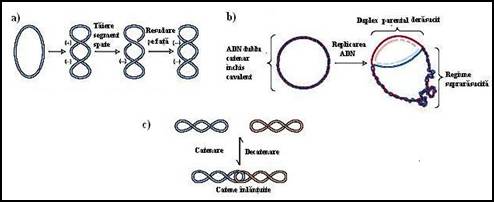
Figura 3.17. Modul de actiune al girazelor bacteriene: a) introducerea de super-ture negative; b) replicarea ADN dublu catenar circular inchis cu formarea de regiuni supra-rasucite (catenate); c) interventia girazelor in procesul de catenare decatenare;
Topoizomerazele de tip II
Sunt enzime care taie temporar ambele catene de ADN si apoi le re-sudeaza. Topoizomerazele de tip II sunt structuri dimere fiecare catena ADN fiind taiata de catre o subunitate.
Din aceasta categorie fac parte si girazele bacteriene. Acestea sunt enzime remarcabile care deruleaza ADN, deci permit introducerea de super-ture negative la nivelul dublei elice (Figura 3.17) . Aceasta reactie este cuplata cu hidroliza cel putin a unei molecule de ATP.
La eucariote nu se cunoaste foarte bine mecanismul introducerii de supra-rasucirii negative.
In figura 3.18. este prezentat un model al mecanismului de actiune al topoizomerazei II de la E. Coli. Enzima este un dimer constituit din doua subunitati identice. Initial, aceasta leaga o parte a catenei ADN, segmentul G (albastru inchis), inducand o modificare conformationala la nivelul domeniilor B, B', A si A' ale enzimei (2). Dupa legarea ATP (indicata prin asterisc) si a altei parti a catenei ADN, segmentul T (albastru deschis), se produc o serie de reactii in care segmentul G este scindat de catre domeniile A si A' (portocaliu deschis) ale enzimei. Capetele segmentului G se leaga covalent la un rest de tirozina cu trei domenii (3 si 3a). Simultan domeniile de legare a ATP (verde) se deplaseaza unele catre altele, transportand segmentul T catre si in deschiderea centrala (4). Segmentul G taiat este apoi resudat si segmentul T este eliberat ca urmare a unei modificari conformationale care separa domeniile A si A' la capatul enzimei (5). Refacerea interfetei dintre domeniile A si A' se realizeaza printr-o reactie care necesita utilizarea unei molecule de ATP (2). In acest punct, segmentul G poate disocia de pe enzima prin conversia 2 in 1. Alternativ, enzima poate trece catre un alt ciclu, trecand segmentul T peste segmentul G si inlaturand inca doua super-ture.
In 1984 au fost descoperite la unele archeobacterii, care traiesc la mai mult de 800C, si apoi la eucariote termofile, topoizomeraze capabile sa induca supra-rasuciri pozitive. Acestea determina formarea unor molecule de ADN suprarasucite pozitiv cu consum de ATP. Enzimele a fost denumite initial "gireze inverse" deoarece au rolul de a proteja ADN de denaturare, fenomen altfel inevitabil la temperaturi ridicate. Se pare ca acestea sunt topoizomeraze este de tip I si nu de tip II cu toate ca necesita ATP pentru functionare.
Interesul biochimic al topoizomerazelor
Virusuri si procariote
Rolul conjugat al celor doua tipuri de izomeraze este foarte important:
a) In primul rand, ADN supra-rasucit negativ este mai compact decat echivalentul sau circular relaxat. Astfel, in vivo, ADN contine numeroase incolaciri, prezenta acestora fiind indispensabila impachetarii moleculelor de ADN circular foarte lungi intr-un volum mic.
b) Pe de alta parte, topoizomerazele faciliteaza replicarea, transcriptia si repararea ADN prin recombinare cu alte segmente ADN. De fapt, numeroase proteine, indispensabile, inca de la initierea acestor procese, nu se vor lega la ADN decat daca acesta este supra-rasucit negativ. Deplasarea furcilor de replicare si de transcriptie induce automat formarea de supra-rasuciri pozitive la nivelul duplexului ADN, ingreunand deplasarea acestora. Pentru ca sinteza ADN sa se continue, supra-rasucirile pozitive trebuiesc inlaturate de catre ADN giraza (Figura 3.19
Intelegem foarte bine care este interesul topoizomerazelor capabile sa introduca super-ture negative. Rolul enzimelor care produc relaxarea super-turelor negative este mai enigmatic. Este posibil ca acestea sa fie implicate in asigurarea unui grad normal de supra-rasucire. Acesta se poate obtine printr-un echilibru intre topoizomerazele care asigura supra-rasucirea negativa si topoizomerazele relaxante.
In figura 3.19. este prezentat un model interesant de actiunea al topoizomerazelor de tip II. La bacterii si virusuri denaturarea capetelor ne-replicate urmata de supra-rasuciri conduce la instalarea unor constrangeri topologice care determina incetarea replicarii. In cazul ADN de la SV40, cele doua etape finale (sinteza si decatenare) pot sa apara in orice ordine in functie de conditiile experimentale. Procesul a fost confirmat prin studii de microscopie electronica care demonstreaza catenarea moleculelor de SV40 complet replicate. In vitro, interventia topoizomerazei II catalizeaza de-catenarea unor astfel de cercuri impletite.
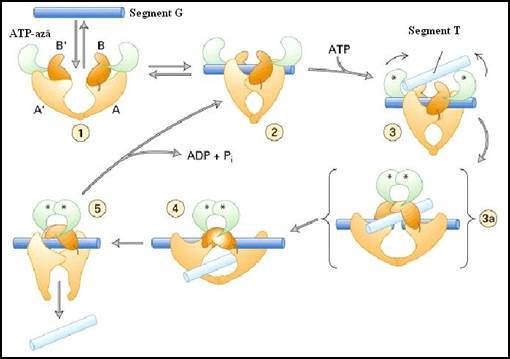
Figura 3.18. Model molecular al activitatii catalitice a topoizomerazei II de la E. Coli (dupa Molecular Cell Biology Lodish H., et. al., 2000)
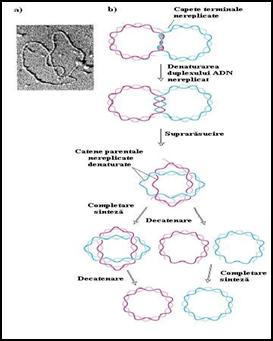
Figura 3.19. Interventia topoizomerazei II in procesul de decatenare la SV40. a) Imagine electronomicroscopica; b) Model de decatenare; catenele parentale sunt reprezentate in culori inchise iar catenele fiice in culori deschise.(dupa Molecular Cell Biology Lodish H., et. al., 2000)
Eucariote
Intelegem foarte bine necesitatea topoizomerazelor de tip I pentru relaxarea super-turelor negative si pozitive. In ceea ce priveste topoizomerazele de tip II, acestea se pare ca au mai ales capacitatea de a desface nodurile (constrangerile) care apar in structura ADN. Asemeni situatiei de la procariote, acestea taie dubla elice ADN, lasa sa treaca un alt segment dublu catenar prin aceasta bresa si apoi o inchid. Se cunosc izoformele alfa si beta, forma beta avand o extremitate COOH terminala mai lunga decat forma alfa.
In concluzie, topoiomerazele sunt foarte utile, fie pentru a schimba supra-rasucirea unei molecule de ADN, fie pentru a desface nodurile care apar in structura ADN in urma diferitelor procese de transcriptie si replicare. Aceste enzime sunt extraordinari prestidigitatori, capabili sa realizeze traversarea unei molecule de ADN de catre o alta molecula monocatenara sau dublu-catenara fara a lasa semne.
Deci, fara topoizomeraze nu ar putea fi rezolvate suprarasucirile inevitabile care se produc in structura ADN in urma inaintarii ARN si ADN polimerazelor.
Aplicatii medicale: inhibitorii topoizomerazelor
Inhibitorii girazei bacteriene, anti-bacterieni: luam drept exemplu modul de actiune al anumitor medicamente din familia quinolonelor, deja utilizate de mult timp, cum sunt Negram (acid nalidixic) si Urotrat sau a unora mai noi, cum este Novobiocina. Aceste medicamente sunt utilizate la om pentru tratamentul infectiilor urinare determinate de colibacili. Ele reactioneaza partial prin inhibarea girazei. Astfel, este impiedicata supra-rasucirea negativa, produsa normal de giraza si necesara unei bune replicari bacteriene. In acest fel este impiedicata replicarea E. coli si deci stopata multiplicarea colibacililor. Actiunea selectiva asupra enzimei bacteriene se explica prin diferenta structurala dintre topoizomerazele bacteriene si umane. Aceste medicamente au fost utilizate empiric inainte de cunoasterea modului lor de actiune.
Inhibitorii topoizomerazelor umane - anticancerigeni: topoizomerazele sunt tinta a numeroase medicamente anticanceroase. Acesti produsi actioneaza stabilizand taieturile tranzitorii din structura ADN induse in stare normala de topoizomeraze. In aceste situatii, nu se poate realiza relegarea si acumularea unor astfel de complexe de clivare determina moartea celulelor. Se manifesta o selectivitate relativa fata de celulele tumorale deoarece cantitatea de topoizomeraze la nivelul acestora este mult mai mare. Dintre medicamentele din aceasta categorie amintim: etopozidul (VP16), inhibitor al topoizomerazei II si taxolul (extras din Taxus baccata), inhibitor al topoizomerazei I.
Din pacate, exista numeroase cazuri de rezistenta la inhibitorii topoizomerazelor. Unele dintre aceste mecanisme se explica prin modificarea structurii topoizomerazelor.
Consecintele supra-rasucirii tertiare
Structurale
Supra-rasucirea moleculelor de ADN circulare, sau inchise sub forma de bucla, reprezinta o modalitate majora de compactare mecanica a acestor molecule de marime mare. Forma lineara opune forte electrostatice replierilor dublei elice. Raporturile dintre compactarea si densitatea moleculei se dispun in ordinea formei astfel: circulara supra-rasucita > circulara relaxata > lineara.
Aceste forme se pot diferentia prin microscopie electronica, ultracentrifugare si electroforeza. Electroforetic este posibila separarea topoizomerilor a caror valoare L difera numai cu o singura unitate. In figura 3.14. este prezentata separarea electroforetica a diferitilor topoizomeri ai ADN de la SV40. Materialul genetic a fost extras din virioni SV40 in conditii care sa asigure obtinerea unui ADN cu un numar maxim de supra-rasuciri (linia 1).
Cateva probe au fost tratate cu topoizomeraza de tip I din E. coli timp de 3 la 30 minute (liniile 2 si 3). Se observa identificarea a aproximativ 25 de benzi, egale cu numarul aproximativ de topoizomeri, dupa tratamentul cu topoizomeraza I. In figura este prezentata si forma deplin relaxata, care nu prezinta supra-rasuciri. ADN care prezinta un numar redus de supra-rasuciri tinde sa se extinda si migreaza mult mai incet decat moleculele compacte care poseda un numar mai mare de supra-rasuciri.
Functionale
Moleculele supra-rasucite sunt tensionate. Este vorba de o tensiune de torsiune care creste, ca in cazul elasticului, o data cu cresterea numarului de super-ture. Energia latenta a acestei structuri 3-D poate fi:
a) partial absorbita de rasucirea ADN in jurul proteinelor (histonele de la eucariote). Aceasta situatie este mult mai probabila decat rasucirea sub propria structura. In aceste cazuri spunem ca supra-rasucirea este contrabalansata de catre un suport;
b) repartizata asupra ansamblului moleculei. In cazul unei conformatii ne-contrabalansate, efectul negativ al supra-rasucirii se poate repartiza asupra pasului mediu al dublei elice care este marit, de la 10,4 la 10,6 sau din contra se concentreaza local asupra uneia dintre regiuni fiind probabila ruperea imperecherilor. Supra-rasucirea, prin dinamica sa, este o conditie prealabila pentru aparitia deformarilor si tranzitiilor de la dublul helix B catre alte conformatii. De asemenea, aceasta reprezinta o necesitate pentru amorsarea tuturor operatiilor fundamentale care necesita o deschidere locala a duplexului cu sunt: replicarea, transcriptia, recombinarea.
Tehnice
Cristalizarea moleculei antreneaza modificari ale structurii 3-D. Suprarasucirea duplexului flexibil poate fi evaluata prin utilizarea de molecule cu capacitate de intercalare.
Agenti intercalati: modifica helixul si conformatia sa supra-rasucita. Demonstratia a fost realizata de catre J. Vinograd cu bromura de etidium. Adaugarea de reactiv, al carui efect asupra moleculei este urmarit prin ultracentrifugare sau electroforeza, face ca ADN nativ sa atinga o densitate minima: prin inserarea bromurii de etidium determina trecerea ADN din conformatia sa supra-rasucita negativa in forma relaxata. O molecula de BET deruleaza helixul cu un unghi constant de aproximativ -260C, metoda putand fi utilizata pentru masurarea supra-rasucirilor (Figura 3.20 ). Adaugarea suplimentara de reactiv forteaza trecerea moleculei de ADN in conformatie supra-rasucita pozitiv.
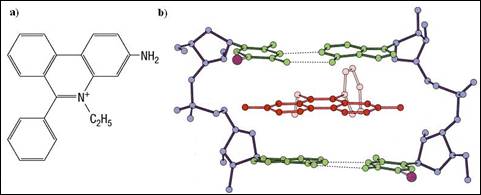
Figura 3.20. Actiunea bromurii de etidium asupra structurii ADN: a) structura bromurii de etidium; b) intercalarea bromurii de etidium intre planurile bazelor (adaptata dupa Biochemistry, Voet&Voet, 1995)
Tratamentul denaturant al ADN circular: caldura, tratamentul cu baze, determina modificarea imperecherii celor doua catene care formeaza Helixul, determinand formarea unei structuri compacte cu densitate mare. Daca se realizeaza taierea prealabila a celor doua catene cu ajutorul enzimelor, acestea se separa si structurile lor aleatoare singure au densitati mai mici. In figura 3.14 sunt prezentate astfel de situatii pentru molecula de ADN SV40 in urma tratamentului cu topoizomeraze.
Proprietatile fizico-chimice ale ADN
Consecintele naturii fibroase si marimii
Pentru a extrage acizii nucleici si a le evalua masa moleculara, sunt utilizate anumite proprietati determinate de natura fibroasa si de marimea ADN, pe care le-am anticipat deja in paragrafele precedente, si anume:
a) sarurile de sodiu ale ADN sunt solubile in apa si dau solutii cu vascozitate ridicata caracterizate prin fenomenul de birefringenta de curgere;
b) alcoolii, dintre acestia cel mai folosit este etanolul, sunt utilizati pentru precipitarea acizilor nucleici din solutie, sub forma unor aglomerate formate din fibre foarte lungi;
c) densitatea acestor macromolecule este destul de mare pentru a permite separarea lor prin ultracentrifugare. Centrifugarea in gradient de densitate la echilibru permite determinarea masei moleculare si evaluarea continutului in G+C*. In aceasta tehnica, numita si izopicnica (densitate egala), gradientul este realizat cu solutii de clorura de cesiu (CsCl) (Figura 2.3
Diferenta de o unitate intre masele moleculare ale cuplurilor GC si AT este suficienta pentru ca densitatea ADN sa fie o functie lineara a continutului in G+C.
Consecintele compozitiei
Dintre proprietatile datorate compozitiei retinem:
a) Caracterizarea si dozarea ADN pentru continutul in deoxiriboza. Coloratia Feulgen a fost utilizata mult timp in histologie si citologie pentru localizarea nucleelor si cromozomilor pe diferite preparate si se bazeaza pe reactie aldehidica a deoxipentozei. Hidroliza acida partiala, la cald, inlatura purinele demascand resturile de 2-deoxiriboza. O fractiune suficienta dintre deoxiribozele atasate pe schelet, sub forma lor furanozica, sunt convertite in forma aldehidica care poate reactiona cu reactivul Schiff (fuxina decolorata cu acid sulfuros) pe care il recoloreaza. Produsul obtinut precipita pe scheletul macromoleculei.
b) Absorbtia in UV a ADN la 260 nm datorita continutului lui in baze. Aceasta absorbtie este de aproximativ 30 de ori mai importanta decat a proteinelor cu o concentratie egala, dar totusi inferioara bazelor libere. Proprietatile de absorbtie ale acizilor nucleici stau la baza metodelor de dozare si de caracterizare a starii lor moleculare (efectul hipocrom al ADN).
Proprietatile oferite ADN de catre imperecherea si stivuirea bazelor
Proprietati mecanice
Spre deosebire de elicea alfa a proteinelor, scheletul acizilor nucleici nu este stabilizat prin legaturi de hidrogen. Helixul este deci flexibil si extensibil ca un resort mai mult sau mai putin intins. Astfel, se explica rezistenta chimica si fragilitatea mecanica a ADN in afara celulelor. Cand molecula este ancorata la nivelul extremitatilor, ea este obiectul supra-rasucirilor despre care am discutat in paragraful anterior. Aceste calitati sunt esentiale pentru evolutia proceselor de replicare si de transcriptie in cursul carora diferitele regiuni trebuie sa se adapteze pentru contactul cu diferitele complexe proteice, sa se expuna pentru a fi accesibile, etc.
Denaturarea acizilor nucleici
Procesul de denaturare reprezinta o alterare a structurii spatiale a unei macromolecule fara ruperea legaturilor covalente. Comportamentul la denaturare al acizilor nucleici este esential diferit de al proteinelor.
Denaturarea si renaturarea termica
Denaturarea si renaturarea termica a ADN sunt pe de o parte modalitati de studiu ale acestor molecule dar si unelte necesare in manipularea acestora. In continuare vom incerca sa examinam aspectele esentiale.
Denaturarea incalzirea unei solutii de ADN este insotita de modificari spectaculoase ale proprietatilor fizice: pierderea vascozitatii si amplificarea absorbtiei in UV. Efectul de hipercromicitate este o modificare foarte importanta si informativa pentru studiul fenomenului de denaturare (Figura 3.21). Din stare nativa, dublu catenara, molecula trece in stare denaturata: se rup legaturile de hidrogen ale imperecherilor si contactele Van der Waals care asigura stivuire, temperatura separa mai mult sau mai putin complet cele doua catene care isi pierd forma elicoidala si adopta o conformatie statistica aleatoare (Figura 3.22.a; 3.23a). In aceste conditii creste absorbtia in UV a bazelor care pana in acel moment erau mascate.
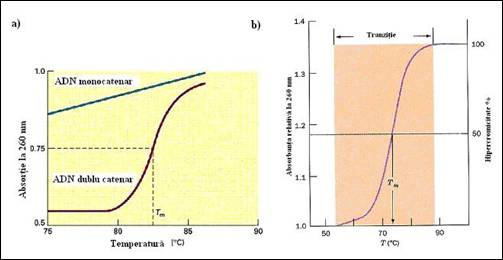
Figura 3. Efectul temperaturi asupra ADN dublu catenar: a) cresterea valorilor DO260 nm in urma procesului de denaturare termica; b) efectul hipercrom al procesului de denaturare si modalitatea de estimare a temperaturii de melting
Aceasta modificare provocata de cresterea temperaturii a fost denumita fuziune prin comparatie cu procesul care se produce la nivelul membranelor. Asa cum se poate observa in figura 3. 22b, moleculele de ADN de origini diferite prezinta caracteristici de fuziune diferite prin:
a) curba de fuziune: amplitudinea si etalarea efectului hipercrom;
b) valoarea temperaturii de fuziune Tm (m pentru melting), reprezinta valoarea la care jumatate din cantitatea de ADN dublu catenar se regaseste in forma monocatenara. Grafic, reprezinta 50% din valoarea maxima a absorbantei, si corespunde punctului de inflexiune al curbei de variatie a acesteia cu temperatura.
La originea acestor diferente stau caracteristici intrinseci ale ADN: lungimea si compozitia in baze. Rezistenta la fuziune este in relatie directa cu continutul in G+C, deoarece imperecherile GC se realizeaza prin intermediul a trei legaturi de hidrogen si sunt mai stabile in timp ce perechile AT se disociaza primele. Astfel curba din figura 3. 2(b) demonstreaza existenta unei relatii lineare intre Tm si (G+C). In tabelul 3.2 sunt furnizate cateva informatii privind continutul G+C si valoarea Tm la cateva tipuri de organisme. Pentru comparatie sunt introduse si valorile pentru poli(AT) si poli(CG).
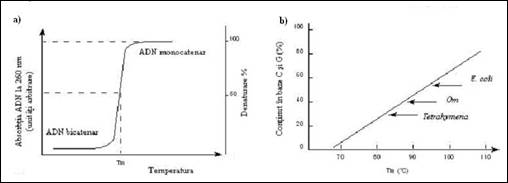
Figura 3. a) Efectul hipercrom al denaturarii termice si determinarea temperaturii de melting; b) Efectul continutului G+C al ADN din diferite surse asupra temperaturii de fuziune.
Tabel 3. Exemple de valori Tm in functie de continutul in (G+C)
|
polinucleotide sau ADN |
G+G (% din continutul total) |
Tm (0C) |
|
poli(AT) | ||
|
Mamifere | ||
|
Escherichia coli | ||
|
Micrococcus phlei |
>98 |
|
|
poli (CG) |
Un factor important este concentratia in saruri a mediului. Acesta reprezinta un factor extrinsec care are efect protector spectacular. Ionii minerali neutralizeaza sarcinile scheletului fosfat si anuleaza repulsiile electrostatice care destabilizeaza dublul helix (Figura 3.23). De retinut ca in apa pura ADN se poate denatura la temperatura ambianta.
Renaturarea restaurarea starii initiale de dubla catena, plecand de la ADN denaturat, este posibila. Succesul acestei renaturari depinde de: i) conditiile de mediu: pH, tarie ionica; ii) starea mai mult sau mai putin avansata a denaturarii; iii) protocolul adoptat pentru revenirea la temperatura ne-denaturanta (Figura 3.24
Procesul de renaturare face obiectul a numeroase studii in intentia intelegerii cineticii si a modelarii etapelor. Procesul de denaturare/renaturare parcurge diferite etape in functie de protocolul utilizat:
a) daca solutia este racita prea repede, timpul de cautare al catenelor complementare este prea scurt: moleculele sunt "inghetate" in starea imperfecta de cupluri inter- si intramoleculare;
b) daca solutia este mentinuta timp indelungat la o temperatura inferioara Tm (Tm-20 sau la temperatura optima Tm-250C) s-a observat, din contra, o revenire gradata la proprietatile caracteristice structurii bicatenare. Trebuie asigurata durata necesara pentru explorarea bazelor prezente pe cele doua catene, reconstituirea imperecherilor complementare si formarea dublei elice. Aceste conditii au fost denumite "de anelare", "annealing" sau "trempe", expresii imprumutate din activitatea de turnare a sticlei sau a metalelor.
Daca se porneste de la o solutie complet denaturata, re-imperecherea se realizeaza in doua etape de cinetica diferite:
i) catenele separate se intalnesc la intamplare (hazard). Catenele complementare se pot imperechea la nivelul unei scurte regiuni si pot forma inceputul unei duble elice. Aceasta etapa este lenta si este limitanta de viteza pentru procesul total de renaturare;
ii) imperecherile se vor efectua foarte rapid, plecand de la punctele de initiere a procesului, dupa modelul inchiderii unui fermoar, impunand structura 2-D elicoidala pe toata lungimea moleculei.
In afara de determinarea vascozitatii si absorbtiei, starea ADN mai poate fi controlata prin microscopie electronica si prin tehnici de biologie moleculara. Prin microscopie electronica se vizualizeaza direct moleculele in timp ce biologia moleculara furnizeaza metodele indirecte: i) studiul activitatii de transformare a ADN pentru un anumit tip celular; ii) degradarea preferentiala a duplexului de catre enzime cum sunt nucleaza S1 si ExoII (Tabel 2.4). Cromatografia de absorbtie pe hidroxiapatita ofera o alta modalitate de separare a duplexului, prin retinerea pe suprafata suport a monocatenelor.
Denaturarile si renaturarile sunt etape cheie pentru numeroase tehnici de biologie moleculara. Hibridizarea, etapa tehnica foarte importanta, presupune formarea de duplexuri artificiale intre ADN din diferite surse sau intre ADN si ARN.
Regiunile de ARN al caror lant monocatenar se repliaza pentru a forma o structura elicoidala 2-D pot prezinta acelasi fenomen de denaturare. Aceste duplexuri ARN sunt mult mai stabile. Valorile temperaturilor lor de melting sunt mai mari cu aproximativ 200C decat cele ale secventelor de ADN echivalente.
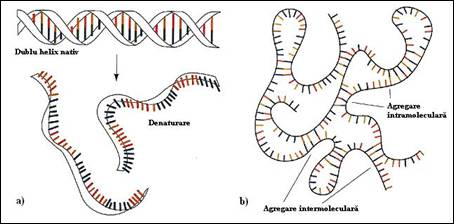
Figura 3. Fenomenul de denaturare si renaturare termica a acizilor nucleici:denaturare; b) renaturare
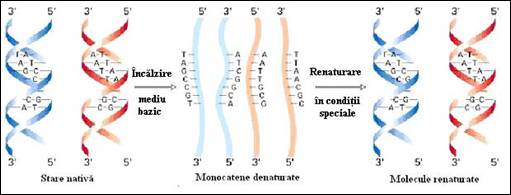
Figura 3. Procesul de denaturare prin incalzire si tratament alcalin (dupa Molecular Cell Biology Lodish H., et. al., 2000)
Alte tipuri de denaturari
Exista o serie de alti factori care au actiune denaturanta asupra ADN:
Valorile extreme de pH dezorganizeaza imperecherile modificand ionizarea grupelor de baze.
Tratamentul alcalin este o metoda importanta care este folosita in tehnicile de biologie moleculara pentru denaturarea ADN. Prin aceasta se separa rapid catenele fara a se produce degradare. Este o modalitate reversibila de a obtine molecule de ADN monocatenare care sunt foarte utile etapelor de hibridizare din tehnicile Southern si northern blot (Figura 3.24). Si moleculele de ARN se denatureaza foarte bine in conditii blande de tratament alcalin.
Corpii organici: compusii organici ca aldehida formica, formamida, ureea, au capacitatea de a stabili legaturi de hidrogen si sunt utilizati ca agenti denaturanti in tehnicile de separare a ADN (Figura 3.25). Faptul ca actiunea lor necesita accesibilitatea grupelor de baze implicate in imperecheri a condus la conceptia unei structuri dinamice pentru ADN, la nivelul caruia exista regiuni care se desfac tranzitoriu si monocatene care se re-imperecheaza. Aceasta ne face sa consideram ca molecula se comporta ca si cum ar "respira". In ADN linear, desfacerea spontana a bazelor este totusi rara la temperaturi fiziologice: durata de viata a imperecherilor/desfacerii acestora este ordinul 10-2 si 10-7 secunde respectiv.
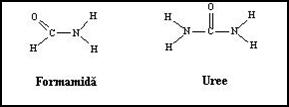
Figura 3. Agenti denaturanti pentru dubla elice ADN. Sunt molecule capabile sa formeze legaturi de hidrogen si sa induca denaturarea ADN
Trebuie sa retinem ca in vivo: i) probabilitatea de denaturare a ADN in conditii de pH, forta ionica si temperatura celulara este minima. Cu toate acestea existenta procesului activ de imperechere partiala este obligatoriu pentru replicare si transcriptie; ii) proteinele care se leaga la ADN inhiba, pentru cea mai mare parte, denaturarea. Cu toate acestea, in functie de starea fiziologica a celulei, numeroase proteine destabilizeaza dubla elice.
Bilant
Principalii factori care determina structura spatiala a acizilor nucleici:
1) conformatia scheletului si sarcina electrostatica;
2) dublele interactii ale bazelor cu solventul: hidrofobe prin intermediul nucleelor si hidrofile prin intermediul substituentilor polari;
3) stivuirea bazelor prin contacte Van der Waals;
4) imperecherea specifica a bazelor prin legaturi de hidrogen.
Totusi, in raport cu proteinele diversitatea combinatiilor este limitata de utilizarea a numai patru monomeri constitutivi:
a) ADN este macromolecula formata din doua catene polinucleotidice ale caror grade de libertate si varietate de organizare sunt reduse;
b) moleculele de ARN prezinta un repertoriu structural care aminteste de cel al proteinelor, motive si domenii, care le permit, de altfel, sa exprime anumite functii cum ar fi cea catalitica.
De ce T in ADN si U in ARN?
Dezaminarile accidentale (oxidative) fac ca citozina (C) sa poata pierde spontan gruparea sa amino (inlocuita de OH) si sa se transforme in uracil, deci sa stea la originea unei mutatii. Din fericire, exista enzime de reparare care recunosc U, deoarece U nu este prezent in mod normal in structura ADN. Acestea inlatura U prin excizie si o pot inlocui cu C.
In ADN, baza T poate fi deci considerata ca un semnal care indica normalitatea, si ca orice aparitie a lui U trebuie considerata o greseala. Daca ADN ar fi avut U in stare normala, enzimele de reparare nu ar fi putut distinge intre "U normal" si U provenind din dezaminarea citozinei.
In ceea ce priveste ARN, acesta poseda U fie in stare "normala" sau dupa dezaminarea accidentala a citozinei. Este deci imposibila diferentierea celor doua tipuri de U. In acelasi timp sinteza T (compus metilat) este mai scumpa din punct de vedere energetic decat U. Deoarece integritatea ADN este esentiala pentru organism, ARN nu a beneficiat de acest sistem de protectie specifica ADN.
De ce deoxiriboza in ADN si riboza in ARN?
Helixurile care contin riboza sunt mai putin stabile decat cele care contin deoxiriboza, datorita prezentei gruparii OH din pozitia 2'. Deci, deoxiriboza confera un element de stabilitate ADN, gardianul informatiei genetice a organismelor.
Pe de alta parte, in structura ARN prezenta OH in pozitia 2' este esentiala si utila in excizia intronilor din pre-ARNm.
De ce 2 catene in ADN si una in ARN?
In molecula de ADN existenta a doua catene complementare reprezinta o modalitate de asigurare a pastrarii informatiei genetice. Asa cum vom vedea in capitolul despre mutatii, in cazul deteriorarii unei catene, informatia este conservata de cealalta. Cat priveste ARN, se pare ca acesta nu reprezinta decat o copie printre alte mii.
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |