Rezolvarea ecuatiei lui Schrodinger pentru anumite valori proprii ale energiei Ei conduce la solutii numite functii proprii ψn,l,m , functii de unda orbitalice sau pe scurt orbitali atomici. Cele 3 numere n,l,m nu mai sunt introduse artificial (ca in modelul Bohr-Somerfeld) ci apar ca o consecinta fireasca a rezolvarii ecuatiei pentru expresii ale lui E si V cunoscute (aceste numere apar in constanta de normare, polinomul lui Laguerre si polinomul lui Legendre, care sunt componente ale expresiei matematice a functiei de unda). Pentru comoditatea rezolvarii ecuatiei de unda coordonatele carteziene sunt inlocuite cu coordonate polare, in care pozitia unui punct in sistemul de referinta este determinata de raza polara r precum si de unghiurile θ si φ. (Figura 2)
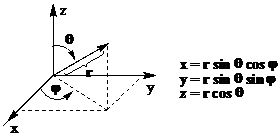
Figura 2. Transformarea coordonatelor carteziene in coordonate polare
Cateva exemple de functii de unda pentru un atom monoelectronic sunt prezentate in Tabelul 4.
Tabelul 4. Functii de unda ale atomului de hidrogen
|
1s |
|
|
2s |
|
|
2p |
|
|
3s |
|
|
3p |
|
|
3d |
|
Functiile orbitale se noteaza ψn,l,m , cele 3 numere n,l,m din indice particularizand exact orbitalul. De exemplu:
este orbitalul pentru care n=0, l=1 si m=0.
Daca aruncam o privire sumara asupra expresiilor functiilor orbitalice din Tabelul 4 observam imediat ca unele functii sunt reale altele sunt complexe. Unele functii sunt reprezentabile (cele reale), altele nu (cele complexe) dar dintre toate functiile doar una nu poate lua valoarea 0, ψ1,0,0 !!! Restul functiilor pot lua valoarea 0 fie datorita variabilei r fie datorita variabilelor θ sau φ. Acele valori ale argumentelor functiilor (r, θ, φ) pentru care functia se anuleaza, vor determina aparitia unor zone spatiale in care probabilitatea existentei electronului va fi nula, zone ce poarta numele de suprafete nodale. Suprafetele nodale pot fi plane, sferice sau paraboloidice unele din ele pot fi externe, altele interne.
Pentru fiecare valoare a lui n, se obtin n2 solutii ale ecuatiei de unda, fiecare solutie reprezentand un orbital. Totalitatea solutiilor, deci a orbitalilor, avand aceeasi valoare pentru n reprezinta un nivel energetic (daca acest nivel este populat cu electroni, formeaza o patura sau un strat de electroni). Stratul pentru care n=1 se noteaza K, cel pentru care n=2 se noteaza L, pentru n=3 se noteaza M si asa mai departe. Exista certitudini (dovedite prin calcul) ca n nu poate avea valori mai mari de 7. Numarul cuantic n determina univoc energia electronului in orbital, gradul de degenerare (n2), numarul substraturilor precum si numarul de suprafete nodale interne.
Numarul cuantic secundar sau inca azimutal l, determina forma orbitalului si poate lua toate valorile incepand cu 0 pana la n-1. Totalitatea orbitalilor dintr-un nivel care au aceeasi forma (aceeasi valoare pentru l) formeaza un subnivel iar electronii care populeaza acest subnivel formeaza un substrat energetic.
Numarul cuantic magnetic m caracterizeaza orientarea orbitalilor (ce au acelasi numar cuantic secundar l ) in camp magnetic. Pentru fiecare numar cunatic secundar l precizat, numarul cuantic magnetic ia 2l+1 valori de la -10+l.
Un numar cuantic care nu apare in solutiile matematice ale functiilor de unda la rezolvarea ecuatiei lui Schrodinger atemporale este numarul cuantic de spin s. El poate lua doar doua valori +1/2 si -1/2. El caracterizeaza momentul magnetic de spin (ca rezultat al "rotatiei" electronului in jurul propriei axe) al electronului. Pe un orbital se pot plasa doar doi electroni cu valori diferite ale numarului cuantic de spin.
Orbitalii atomici reprezinta zone din spatiu in care probabilitatea existentei electronului este maxima; orbitalii atomici delimiteaza suprafata tridimensionala care include circa 90 % din densitatea de probabilitate a norului electronic
Urmatoarele tipuri de orbitali se intalnesc in straturile si substraturile populate cu electroni ce alcatuiesc invelisul electronic al unui atom:
1. Orbitali de tip s - corespund functiilor de unda de forma ψn,0, 0 unde n=1,27. Toti orbitalii s au numarul cuantic secundar l=0. Nici una din functiile de unda corespunzatoare, nu contine vreo expresie dependenta de θ sau φ, functiile fiind dependente doar de r. Spunem ca orbitalii sunt centrosimetrici. Toti orbitalii s, adica 1s, 2s, 3s au simetrie sferica, volumul si energia lor creste o data cu valoarea numarului cuantic principal n. Orbitalii s ce corespund la numere cuantice n≥2 au suprafete nodale interne. Formula de calcul al numarului suprafetelor nodale interne este: n-l-1. Suprafetele nodale interne definesc zone de simetrie sferica in care probabilitatea existentei electronului este nula. Cateva exemple de orbitali s sunt prezentati in Figura 3.
|
Orbitalul 1s |
|
Figura 3. Tipuri de orbitali s
2. Orbitali de tip p corespund functiilor de unda de forma ψn≥2,1,m . Toti orbitalii p au numarul cuantic secundar l =1. Toate functiile de unda pot lua valoarea 0 fie datorita expresiei componentei radiale (expresia ce contine argumentul r), fie datorita functiilor trigonometrice ce au ca argument θ sau φ si de aceea orbitalii vor prezenta suprafete nodale. Semnele + si - nu au semnificatie electrica, ele arata doar ca functia isi schimba semnul de o parte si de alta a suprafetei nodale, schimbarea de semn indicand schimbarea fazei de vibratie (orbitalii fiind anticentrosimetrici). Prin urmare orbitalii au o forma bilobara si o simetrie axiala. Deoarece numarul cuantic secundar l are valoarea 1, numarul cuantic magnetic m poate avea valorile: -1,0,1. Corespunzator celor 3 valori ale numarului cuantic magnetic avem 3 orbitali de tip p: ψn,1,-1,ψn,1,0, ψn,1,1. Cei 3 orbitali de tip p alcatuiesc un substrat. Acesti orbitali sunt orientati spatial dupa cele 3 axe de coordonate, unghiul intre axele de coordonate (90o) fiind si unghiul intre orbitali. Orbitalii p ce corespund la numere cuantice n≥3 au suprafete nodale interne. Cateva exemple de oribitali p sunt prezentati in Figura 4 .
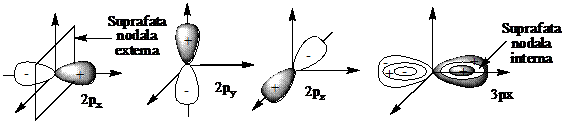
Figura 4. Tipuri de orbitali p
3.Orbitali de tip d - corespund functiilor de unda de forma ψn≥3,2,m . Toti orbitalii d au numarul cuantic secundar l =2. Toate functiile de unda pot lua valoarea 0, datorita functiilor trigonometrice ce au ca argument θ sau φ si de aceea orbitalii vor prezenta suprafete nodale. Orbitalii au o forma tetralobara iar unul singur are o forma trilobara. Deoarece numarul cuantic secundar l are valoarea 2, numarul cuantic magnetic m poate avea valorile: -2,-1,0,1,2. Corespunzator celor 5 valori ale numarului cuantic magnetic avem 5 orbitali de tip d: ψn,2,-2, ψn,2,-1, ψn,2,0, ψn,2,+1, ψn,2,+2 . Cei 5 orbitali de tip d alcatuiesc un substrat. 4 orbitali au cate doua plane nodale externe iar unul are o suprafata nodala externa de tip paraboloidic (dz2). Orbitalii d ce corespund la numere cuantice n≥4 au suprafete nodale interne. Cateva exemple de orbitali d sunt prezentati in Figura 5.

Figura 5. Tipuri de orbitali d
4.Orbitali de tip f - corespund functiilor de unda de forma ψn≥4,3,m . Toti orbitalii d au numarul cuantic secundar l =3. Toate functiile de unda pot lua valoarea 0, datorita functiilor trigonometrice ce au ca argument θ sau φ si de aceea orbitalii vor prezenta suprafete nodale. Orbitalii au o forma octalobara sau tetralobara. Deoarece numarul cuantic secundar l are valoarea 3, numarul cuantic magnetic m poate avea valorile: -3-2,-1,0,1,2,3. Corespunzator celor 7 valori ale numarului cuantic magnetic avem 7 orbitali de tip f: ψn,3,-3, ψn,3,-2, ψn,3,-1, ψn,3,0, ψn,3,+1, ψn,2,+2 . Cei 7 orbitali de tip f alcatuiesc un substrat. Orbitalii octalobari au cate trei plane nodale externe. Orbitalii f ce corespund la numere cuantice n≥5 au suprafete nodale interne.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |