Multe din progresele timpurii ale termodinamicii au fost facute pe baza datelor experimentari proprietatilor gazelor. Una din intrebarile primare careia i s-a cautat raspuns a fost daca gazele se racesc la expansiune. (Intuitia noastra ne-ar putea sugera ca asa este, dar este oare corecta aceasta afirmatie?)
Cel care a efectuat un experiment pentru a dovedi daca gazele la expansiune se racesc sau nu si cu ce valoare a fost Joule.
Aparatul lui Joule consta in doua vase de sticla in forma sferica interconectate prin intermediul unui robinet. Unul din vase a fost umplut cu un gaz la o anumita presiune p si la o anumita temperatura T. Celalalt vas a fost vidat. Intregul aparat a fost complet izolat astfel incat q = 0, drept consecinta experimentul va fi unul adiabatic.
S-a deschis robinetul lasand gazul sa expandeze in vasul vidat. Deoarece gazul expandeaza spre presiune nula nu se efectueaza lucru, deci w = 0. Avand de asemenea q = 0 si w = 0 acum este clar ca:
ΔU = q + w = 0.
Procesul are loc la energie interna constanta.
Clar ca ΔV ≠ 0 deoarece gazul expandeaza si va ocupa volumul celor doua vase. Intrebarea era, se va modifica T ? ΔT fiind determinat a fi zero, nu va aparea modificare de temperatura.
(Reiese ca experimental lui Joule a fost experiment insuficient de elaborat pentru a diferentia comportarea unui gaz real de unul ideal astfel incat concluziile desprinse din acest experiment par a fi mai degraba aplicabile gazului ideal.)
De fapt, Joule a incercat sa masoare valoarea derivatei,
![]()
si rezultatul a fost ca,
![]() (13.1)
(13.1)
Aceasta derivata speciala nu este deloc potrivita studiului nostru, pastrand valoarea lui U constanta. Putem utiliza acum versiunea sirurilor lui Euler pentru a obtine informati mult mai instructive.
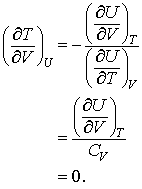 (13.2 a, b, c)
(13.2 a, b, c)
Stim ca CV pentru gaze nu este nici zero nici infinit, deci concluzionam ca,
![]() (13.3)
(13.3)
Acesta este pe langa un rezultat important unul deosebit de valoros! El ne spune ca energia interna a unui gaz ideal nu este o functie de T si V, ci doar T. Aceasta transpusa in ecuatie, pentru gazul ideal
U = U(T). (13.4)
Pentru gazele reale, sau comportari aproximative atribuite gazelor, precum ecuatia de stare van der Waals,
![]()
Oricum, aceasta cantitate este foarte mica, chiar pentru gazele reale! Mai tarziu vom exemplifica acestea pentru ecuatia de stare van der Waals.
Acest rezultat extinde rezolvarea la entalpia unui gaz ideal!
Astfel, pentru un gaz ideal, atat U cat si H sunt functii dependente doar de T.
Atunci toate derivatele urmatoare trebuie sa fie zero:
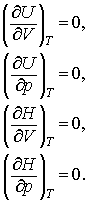 (13.6 a,
b, c, d)
(13.6 a,
b, c, d)
vom folosii toate aceste rezultate pentru a discuta expansiunea unui gaz ideal.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |