Legea lui Hess stipuleaza ca daca se aduna sau se scad ecuatii ale reactiilor, atunci putem aduna respectiv scadea si ΔH sau ΔU lor pentru a obtine ΔH sau ΔU ecuatie globale a reactiilor. De exemplu: daca adaugam reactia
a A + b B → c C + d D. ΔH1, ΔU1
la reactia
e E + f F → g G + h H ΔH2, ΔU2
pentru a obtine ecuatia
a A + b B + e E + f F → c C + d D + g G + h H,
atunci, pentru ecuatia globala avem
ΔH = ΔH1 + ΔH2 si ΔU = ΔU1 + ΔU2.
Marea utilitate a legii lui Hess este ca nu trebuie sa intabelam
valorile ΔH ale fiecarei reactii in parte. Putem
obtine valoarea ΔH a unei anumite ecuatii a unei reactii particulare prin
adunarea sau scaderea ΔH unor reactii simple, definite drept reactii de formare. Vom
definii ΔfHo a unui compus drept
entalpia reactiei :
elemente pure izolate, in starile lor standard → un mol de compus in stare lui standard
De exemplu, formarea apei lichide este definita de ΔH o a reactiei:
H2(g) + 1/2 O2(g) → H2O(l).
Prin definitie caldura de formare a unui element in stare standard este zero!
Pentru obtinerea ΔH o a ecuatiei ipotetice (15.1), va trebui sa adunam si sa scadem caldurile respective de formare
ΔrH o = cΔfHCo + d ΔfHDo− a ΔfHAo− b ΔfHBo. (15.8)
De exemplu ΔH o pentru reactia
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l), (15.9)
este data de
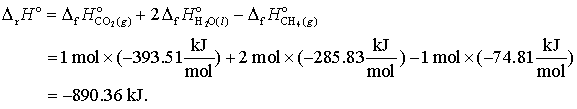
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |