Se observa rapid ca rezultatul expansiunii din experimentul lui Joule nu este valid pentru un gaz real! Un experiment mai aproape de adevar, dar totusi putin diferit, a fost efectuat de Joule si J. J. Thompson pentru a elucida proprietatile gazelor reale la expansiune lor.
O proba de gaz, aflata initial la p1, V1 si T1 a fost fortata a fost fortata sa treaca printr-un perete poros la o presiune constanta, p1. Gazul a fost evacuat la celalalt capat al dispozitivului la p2, V2, si T2. Aparatul a fost izolat pentru cat q = 0. Lucrul efectuat are expresia a doi termeni, lucrul efectuat de sistem pentru a forta gazul sa treaca prin deschidere si lucrul efectuat de sistem asupra vecinatatilor ca si consecinta a primei exercitari a lucrului.
Lucrul total devine:
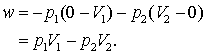 (13.18 a, b)
(13.18 a, b)
deoarece q = 0, modificarea energiei interne a gazului este,
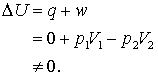 (13.19 a, b, c)
(13.19 a, b, c)
Acest proces, spre deosebire de expansiune Joule, nu are loc la o energie interna constanta!
Totusi, entalpia este data de expresia,
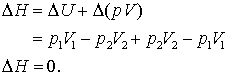 (13.20 a, b, c)
(13.20 a, b, c)
Drept consecinta, experimentul Joule-Thompson este un proces care se desfasoara la o entalpie constanta. In cadrul experimentului ei au putut alege o valoare pentru Δp, si apoi pentru ΔT. Raportul acestor doua cantitati este o aproximatie a derivatei,
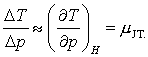 (13.21)
(13.21)
JT fiind definit drept 'coeficientul efectului Joule-Thompson.' Acest coeficient este diferit de zero pentru gazele reale (sau pentru reprezentari realistice precum ecuatia de stare van der Waals), dar, dupa cum vom vedea in continuare este zero pentru gazul ideal! Aplicand acum regula sirului lui Euler in ecuatia (13.21) rezulta,
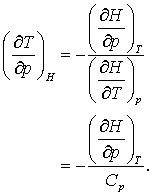 (13.22 a, b)
(13.22 a, b)
Numeralul ecuatiei (13.22 b) este zero pentru un gaz ideal, dar nu neaparat zero pentru un gaz real!
Coeficientul efectului Joule-Thompson este important in lichefierea gazelor deoarece ne spune despre faptul ca un anume gaz se incalzeste sau se raceste la aceasta expansiune! Pare ca acest coeficient este o functie descrescatoare de temperatura si va trece prin valoarea zero la temperatura de inversiune Joule-Thompson, TI. Intr-o expansiune dp < 0. Indiferent ca dT este pozitiv sau negativ dependenta va fi doar de semnul lui μJT. Daca ne reamintim definirea lui μJT,
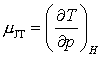 ,
,
vedem ca daca μJT este pozitiv atunci dT este negativ dupa expansiune, astfel incat gazul se va racii. Pe de alta parte, daca μJT este negativ, atunci dT este pozitiv astfel incat gazul se va incalzii la expansiune. Pentru a lichefia un gaz conform expansiunii Joule-Thompson, gazul va trebui intai racit sub temperatura de inversiune J-T. Cateva din temperaturile de inversiune:
He 40 K
N2 621 K
O2 764 K
Ne 231 K
Observam ca N2 si O2 se vor racii la expansiune la temperatura camerei, in schimb He si Ne se vor incalzii la expansiune la temperatura camerei!
|
Politica de confidentialitate |
| Copyright ©
2026 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |