
Definirea unei expansiuni adiabatice de acum inainte este dq = 0. Cu alte cuvinte, nici un fel de caldura nu paraseste sistemul. Totusi dw ≠ 0. Pe masura ce gazul expandeaza (se dilata!) el va efectua lucru asupra vecinatatilor. Lucrul trebuie sa provina atat din energia interna a gazului deoarece aceasta trebuie sa scada. Deoarece energia interna a unui gaz ideal este dependenta doar de T rezulta ca temperatura gazului trebuie sa scada.
Din expresia primei legi a termodinamicii doar lucrul pV este cel constatat
![]() (13.7 a, b)
(13.7 a, b)
deoarece dq = 0 pentru un proces adiabatic.
Daca considera acum U ca functie de T si V. Adica, U = U(T,V), rezulta
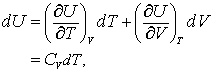 (13.8 a, b)
(13.8 a, b)
deoarece definitia lui CV si deoarece gazul considerat de noi este unul ideal astfel incat a doar derivata devine nu tine cont de ec.13.6a.
Valoarea dU in ecuatiile (13.7) si (13.8) trebuie sa fie egale, astfel incat:
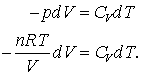 (13.9 a,
b)
(13.9 a,
b)
Daca rearanjam ecuatia (13.9b) obtinem:
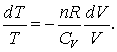 (13.10)
(13.10)
Daca acum utilizam expresiile privind entalpia, gasim
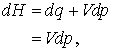 (13.11
a, b)
(13.11
a, b)
si
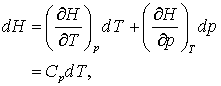 (13.12 a, b)
(13.12 a, b)
Din acestea deducem ca:
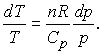 (13.13)
(13.13)
Comparand acum ecuatiile (13.10) si (13.13) observam ca:
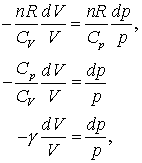 (13.14
a, b, c)
(13.14
a, b, c)
Unde am considerat Cp/CV = γ .
Daca consideram acum Cp si CV drept constante atunci ecuatia (13.14c) se poate integra pentru a obtine,
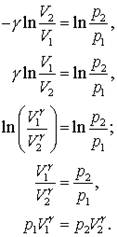 (13.15
a, b, c, d, e)
(13.15
a, b, c, d, e)
Ecuatia (13.15 e) este o ecuatie pentru expansiune adiabatica a unui gaz ideal, pe care se pare ca am intalnit-o deja anterior!
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |