Forte hidrofobe
Uleiul formeaza faze separate de mediul apos
 Macromoleculele se aranjeaza in structuri
care minimizeaza contactul dintre gruparile polare si domeniile hidrofobe
Macromoleculele se aranjeaza in structuri
care minimizeaza contactul dintre gruparile polare si domeniile hidrofobe
O explicatie a efectului hidrofob
Forte de dispersie
Efect dirijat entropic
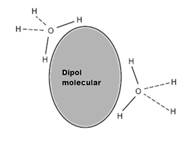
Interactiunea sarcina-dipol
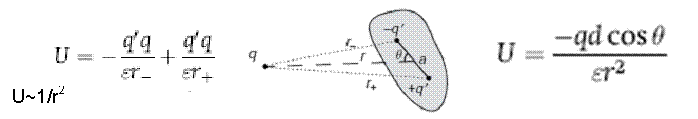
La distante mari, r>>a
d=aq', momentul dipolar
U~1/r3
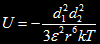 Interactiune dipol-dipol
Interactiune dipol-dipol
Pentru dipoli in solutie supusi agitatei termice
Forte de dispersie
Sarcinile fluctueaza rapid in timp: dipoli instantanei
Forte de atractie sau de respingere
![]() La distante mari
La distante mari
La distante mici
Solubilitatea reprezinta cantitatea maxima de substanta (solvat) care se dizolva in conditii date de temperatura, intr-un anumit volum de solvent. Ea este influentata de natura solvatului, natura solventului, temperatura, iar pentru substantele gazoase si de presiune. Cand solventul este apa, solvatarea poate fi explicata prin mai multe tipuri de interactiuni:
a) interactiuni ion-dipol, care se intalnesc la substantele organice ionice si se explica prin realizarea unor legaturi intre ionii de solvat si moleculele polare de solvent, care duc la desprinderea ionilor din reteaua cristalina si trecerea lor in solutie. O mentiune speciala trebuie facuta pentru moleculele sapunurilor si detergentilor ionici, la care molecula este formata dintr-un rest hidrocarbonat nesolvabil si un ion solubil in apa;
b) interactiuni hidrofobe solvat organic-apa, care presupune o repulsie reciproca a moleculelor. Ele pot fi explicate prin faptul ca intre moleculele organice exista slabe atractii van der Waals, iar intre cele de apa, legaturi de hidrogen puternice.
c) interactiuni dipol-dipol, ce se intalnesc la substantele organice polare si care se explica prin formarea unor legaturi fizice intre dipolii de solvent si solvat, care usureaza solvatarea; d)interactiuni prin legaturi de hidrogen cu moleculele de solvent.
Si pentru a vedea mai bine legatura dintre structura si proprietatile fizice si chimice ale substantei, trebuie precizat ca atat interactiunile dipol-dipol cat si cele prin legaturi de hidrogen, scad pe masura ce creste restul hidrocarbonat al moleculei si de aceea solubilitatea substantelor organice scade cu cresterea catenei hidrocarbonate.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |