Metabolismul aminoacizilor
Toate tesuturile din organismul uman sunt capabile sa sintetizeze aminoacizi ne-esentiali, sa remodeleze un anumit aminoacid sau sa transforme catene de atomi de carbon in aminoacizi sau derivati ai acestora care vor contine azot. Dintre toate, ficatul ramane totusi, sediul central al metabolismului azotului din organism. Scheletul de carbon al majoritatii aminoacizilor este degradat la intermediari ai ciclului Krebs, dupa eliminarea gruparii amino prin reactii de desaminare.
In cazul unui surplus alimentar, aminoacizii potential toxici datorita continutului in azot, sunt eliminati prin reactii de transaminare, deaminare si de formare a ureei. In acest caz, catenele de atomi de carbon sunt in general conservate fie ca si carbohidrati, prin gluconogeneza, fie ca si grasimi, prin calea sintezei grasimilor. Daca e sa clasificam aminoacizii in functie de cele aratate mai sus, ei se pot grupa in trei categorii: glucenici, cetogenici sau glucogenici si cetogenici.
Aminoacizi glucogenici sunt acei care duc la formarea neta a piruviratului sau a intermediarilor ciclului TCA (a-cetoglutarat sau oxaloacetat), toti fiind precursori ai glucozei. Exista doua exceptii la acesta categorie si anume lisina si leucina, ceilalti aminoacizi fiind macar partial glucogenici.
Lisina si leucina sunt singurii acizi cetogenici, formand doar acetil-CoA sau acetoacetil-CoA, nereusind niciodata sa duca la sinteza glucozei.
O mica grupa de aminoacizi prezinta caracteristici atat glucogenice cat si cetogenice, putand conduce fie la glucoza, fie la grasimi. Acestia sunt izoleucina, fenilalanina, treonina, triptofanul si tirosina.
Cele prezentate mai sus sunt schematizate in tabelul 3.1. urmator, aranjati in ordinea alfabetica a denumirii lor, evidentiind inca o data ca cisteina1 si tirosina2 sunt conditionat esentiale, asa cum se va vedea din reactiile metabolice descrise mai departe in capitol.
Tabelul 3.1. Metabolismul aminoacizilor
|
Aminoacid |
Provenit din |
Degradat la |
glucogenic / cetogenic |
Precizari |
|
Alanina |
Piruvat |
piruvat |
glucogenic |
Cantitati mari in celule |
|
Arginina |
Glutamat |
glutamat |
glucogenic |
Puternic bazic Participant in ciclul ureei |
|
Asparagina |
Aspartat |
aspartat |
glucogenic |
In glicoproteine |
|
Aspartat |
Oxaloacetat |
oxaloacetat |
glucogenic |
Caracter acid, cantitati mari in celule |
|
Cisteina |
(metionina)1 |
piruvat |
glucogenic |
Contine grupa -SH |
|
Glutamate |
Oxoglutarat |
oxoglutarat |
glucogenic |
Caracter acid, cantitati foarte mari in celule |
|
Glutamina |
Glutamat |
glutamat |
glucogenic |
cantitati mari in celule |
|
Glicina |
Serina |
Mixeaza pe un carbon |
glucogenic |
Nu are lant ramificat, colagen |
|
Histidina |
Aminoacid esential |
glutamat |
glucogenic |
Caracter slab bazic |
|
Izoleucina |
Aminoacid esential |
acetil-CoA + propionil-CoA |
mixt |
Catena ramificata |
|
Leucina |
Aminoacid esential |
acetil-CoA |
cetogenic |
Catena ramificata |
Tabelul 3.1. Metabolismul aminoacizilor (cantinuare)
|
Lisina |
Aminoacid esential |
mixt |
Catena ramificata mare, caracter bazic |
|
|
Metionina |
Aminoacid esential |
propionil-CoA |
glucogenic |
Contine sulf in molecula, Donor de grupare metil |
|
Fenilalanina |
Aminoacid esential |
Tirosina |
mixt |
Cu nucleu aromatic, Provoaca fenilcetonuria |
|
Prolina |
Glutamat |
Glutamat |
glucogenic |
Imino-acid |
|
Serina |
fosfoglicerat |
Piruvat |
glucogenic |
Contine grupare -OH alcoolica |
|
Treonina |
Aminoacid esential |
Neclarificat inca |
glucogenic |
Contine grupare -OH alcoolica |
|
Triptofan |
Aminoacid esential |
mixt |
Caracter aromatic |
|
|
Tirosina |
(fenilalanina)2 |
fumarat + acetoacetat |
mixt |
Caracter aromatic, Contine grupare -OH fenolica |
|
Valina |
Aminoacid esential |
propionil-CoA |
glucogenic |
Catena ramificata |
1. Anabolismul (biosinteza) aminoacizilor
Biosinteza glutamatul si asparatul
Sunt sintetizati din precursorii lor larg raspanditi, a-cetoacizi printr-o reactie de transaminare, intr-o singura etapa, avand drept biocatalizatori glutamat dehidrogenaza, pentru glutamat, respectiv aspartat aminotransferaza (AST), pentru aspartat.

Asparatul mai poate fi sintetizat din asparagina prin actiunea asparaginazei. Importanta glutamatului ca amino donor intracelular in cazul reactiilor de transaminare si a asparatului drept precursor al ornitinei in ciclul ureei reies clar din studiul metabolismului azotului.
Biosinteza alaninei si ciclul glucoza - alanina
In afara rolului ei in sinteza proteinelor, alanina este al doilea mare aminoacid circulat, dupa glutamina, servind un singur scop, acela de a transfera azotul de la tesuturile periferice la ficat. Desi este transferat de multe tesuturi, muschiul ramane baza de formare a sa din piruvat. Piruvatul poate fi insa transformat si in glucoza, prin oxidare, prin calea gluconogenezei. Atunci cand transferul alaninei de la muschi la ficat este cuplat cu transportul glucozei de la ficat la muschi, procesul este cunoscut drept ciclul glucoza-alanina. Principala caracteristica a acestui ciclu consta in faptul ca intr-o singura molecula, alanina, se asigura exportul de piruvat si amoniac de la tesuturi la ficat, in timp ce scheletul de atomi de carbon este reciclat, iar azotul, in mare majoritate, eliminat.
![]()
Producerea alaninei in muschi se poate face prin doua cai principale, una directa din degradarea proteinelor si una printr-o reactie de transaminare a piruvatului de catre piruvat amino-transferaza (sau alanin transferaza ALT).
Biosinteza cisteinei
Pentru sinteza cisteinei, furnizorul de sulf este un aminoacid esential, metionina. Sub actiunea catalitica a metionin adenozil transferazei, prin condensarea ATP cu metionina se formeaza S-adenozilmetionina (SAM), precursor al multor reactii de transfer al gruparii metil, in urma transferului transformandu-se in S-adenozilhomocisteina, care este apoi scindata de adenozilhomocisteinaza in homocisteina si adenozina.
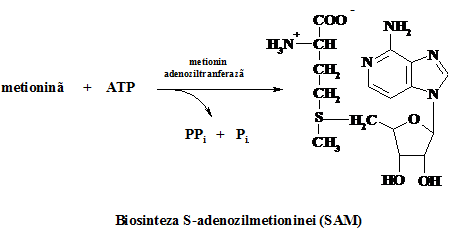

In sinteza cisteinei, homocisteina se condenseaza cu serina rezultand cistationina, scindata ulterior de citationaza la cisteina si a-cetobutirat. Insumate, aceste doua transformari sunt cunoscute drept trans-sulfurare.
In cele doua cai enzimatice esentiale acestui proces, cele doua enzime cistationin - sintezaza si cistationaza (cistationin-liaza) utilizeaza drept co-factor piridoxal fosfatul. Lipsa acestora sau defecte genetice ale lor determina boli ca homocistinuria, asociata adesea cu retardarea mintala.
Biosinteza tirosinei
Sinteza tirosinei se produce in celule prin hidroliza aminoacidului esential fenilalanina, jumatate din necesarul de fenilalanina fiind folosit in acest scop. In consecinta, la o dieta bogata in tirosina necesarul de fenilalanina al organismului se poate reduce pana la jumatate.
Fenilalanin-hidroxilaza are functie mixta, una din ele fiind oxidarea fenilalaninei. Lipsa sau deficitul in aceasta enzima duce la boala genetica fenilcetonuria (PKN), care daca este netratata la timp duce la retardari mintale severe, determinate de acumularea fenilalaninei.
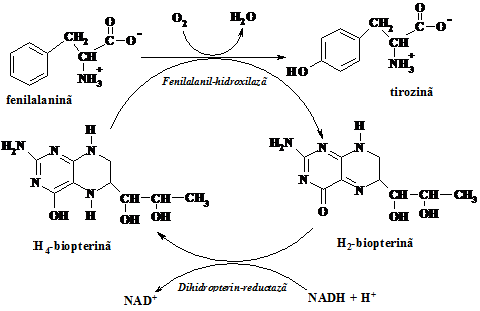
Pe de alta parte, lipsa sau insuficienta dihidropterin-reductazei determina aparitia tulburarilor neurologice mult mai severe decat in fenilcetonurie.
Biosinteza ornitinei si prolinei.
Biosinteza acestor aminoacizi au drept precursor glutamatul, glutamat semialdehida fiind punctul in care procesele decurg spre unul sau celalalt aminoacid. Ornitonina nu are rol in sinteza proteinelor, rolul ei important este de acceptor de carbamoil fosfat in ciclul ureei. Sinteza ei in organism este importanta mai ales atunci cand dieta este saraca in arginina (a doua sursa importanta de ornitina). Ornitina se obtine din glutamat semialdehida printr-o simpla transaminare.
Biosinteza serinei
Principala cale de biosinteza a serinei porneste de la un intermediar glicolitic, 3-fosfogliceratul. Acesta este transformat, sub influenta unei dehidrogenaze legate de NADH la ceto-acidul corespunzator, 3-fosfopiruvatul, care poate suferi o transaminare ulterioara. Transaminarea este catalizata de aminotransferaza, avand drept donor de azot glutamatul. Ceea ce rezulta, 3-fosfoserina este transformata in serina de catre fosfoserin fosfataza.
Biosinteza glicinei.
Principala cale biochimica de obtinere a glicinei consta intr-o singura etapa catalizata de serin hidroximetil transferaza, constand in transferul unei grupari hidroximetil de la serina la cofactorul tetrahidrofolat (THF).
Glicina este implicata in multe reactii de biosinteza a proteinelor, printre care sinteza nucleotidelor purinice, hemului, creatininei, serinei, etc.
2. Catabolismul aminoacizilor
Catabolismul glutamina/glutamat si asparagina/aspartat
In rinichi, dar numai aici ci si in alte tesuturi, se gaseste glutaminaza, enzima care transforma glutamina din ficat sau alte tesuturi la glutamat si amoniac, amoniacul fiind apoi eliminat prin urina.
O alta enzima, asparaginaza, de asemenea larg raspandita in organism, transforma asparagina in asparat si amoniac. Aspartatul, printr-o reactie de transaminare trece in oxalilacetat, care urmeaza apoi calea glicogenogenica.
Atat glutamatul cat si aspartatul sunt importanti colectori si eliminatori ai azotului cu ajutorul glutamin sintezazei si al ciclului ureei. Calea catabolica a scheletului de carbon implica a singura cale a reactiilor, catalizata de aminotansferaza, cu producerea unui intermediar al ciclului TCA. O a doua posibilitate este indusa de glutamat dehidrogenaza, a-cetoglutamatul astfel format ducand de la glutamat la glucogenogeneza.
Catabolismul alaninei
Alanina participa si ea la transportul inter-tesuturi al azotului, ca parte a ciclului glucoza-alanina. Transformarea catabolica a alaninei implica o reactie simpla de transfer aminic, cu formarea directa a piruvatului. Piruvatul astfel format va conduce la formarea oxalilacetatului, desi atunci cand incarcarea energetica a celulei este mica, piruvatul va fi oxidat la dioxid de carbon si apa prin complexul PDH si ciclul TCA. Aceasta ii confera alaninei caracterul de aminoacid glucogenic.
Catabolismul argininei, ornitinei si prolinei
Catabolisml argininei este legat de ciclul ureei, fiind hidrolizata la uree si ornitina de catre arginaza. Ce depaseste necesarul din ciclu ureei este transformat prin transaminare ducand la formarea glutamat semialdehida; aceasta poate fi transformata in glutamat sau poate servi drept precursor al biosintezei prolinei.
Catabolismul prolinei este chiar reversul procesului ei anabolic.
Prin catabolizarea ornitinei si prolinei rezulta glutamat semialdehida care prin oxidare sub actiunea glutamate semialdehid dehidrogenazei se oxideaza la glutamat. Acesta putand fi convertit la a-cetoglutarat printr-o reactie de transaminare, confirma caracterul glucogenic al argininei, ornitinei si prolinei.
Catabolismul serinei
Transformarea serinei la glicina, care apoi oxidata duce la dioxid de carbon si apa si formarea a doi echivalenti de N5,N10-metilen-THF a fost deja descrisa. Serina se poate cataboliza inapoi la intermediarul glicolitic 3-fosfoglicerat, o cale practic inversa a biosintezei serinei. Bine-nteles cele doua procese sunt biocatalizate de enzime diferite. Mai exista o cale de catabolizare a serinei, sub influenta serin/treonin dehidratazei, cand printr-o reactie de dezaminare se formeaza piruvirat.
Catabolismul treoninei
In cazul treoninei deosebim trei cai posibile pentru catabolism. Prima se refera la formarea a-amino-b-cetobutiratului, sub influenta treonin dehidrogenaza. a-Amino-b-cetobutiratului poate fi transformat fie in acetil CoA si glicina, fie sa se descompuna spontan la aminoacetat care este apoi transformat in piruvat. Cea de-a doua cale implica actiunea serin/treonin dehidratazei cu formarea a-cetobutiratului, catabolizat apoi la propionil-CoA si in final la succinil-CoA, un intermediar al ciclului TCA. In fine, cea de-a treia cale, care utilizeaza drept biocatalizator treonin aldolaza, duce la formarea unor produsi cu caracter atat glucogenic (piruvatul) cat si cetogenic (acetil-CoA).
Catabolismul glicinei.
Caracterul glucogenic al serinei este determinat de posibilitatea transformarii ei in serina, sub influenta serin hidroximetil transferzei, iar serina transformata inapoi in 3-fosfoglicerat, cu ajutorul serin/treonin dehidratazei. Totusi principala cale catabolica conduce la dioxid de carbon si un echivalent N5,N10-metilen-THF, cataboliza realizata de complexul de scindare glicinica mitocondrial.
Catabolismul cisteinei
Catabolismul cisteinei poate urma diferite cai. Cea mai simpla este desulfurarea de catre ficat si formarea hidrogenului sulfurat si a piruvatului. O cale mai importanta o reprezinta catabolizarea oxidativa a cisteinei sulfidrilului, cu ajutorul cistein dioxigenazei, la sulfinat, formand intermediarul cisteinsulfinat. Catabolismul cisteinsulfinatului decurge prin transaminarea la a-sulfinilpiruvat, care prin desulfurare produce ion bisulfit (HSO3-) si piruvat. Sub actiunea apei si oxigenului molecular, catalizata de sulfit oxidaza, ionul bisulfit este transformat in sulfat si se mai formeaza apa oxigenata (H2O2). Ionul sulfat astfel obtinut este utilizat la sinteza precursorului 3'-fosfoadenozin-5'-fosfosulfatului (PAPS), utilizat la transferul sulfului la biomolecule cum sunt zaharurile din glicosfingolipide.

Desi nu este o proteina, cel mai important produs al catabolismului cisteinei in constituie un precursor al bilei, taurina, utilizata la formarea acizilor conjugati bilei, taurocolatul si taurochenodeoxicolatul.
Catabolismul metioninei
Reglarea caii metabolice a metioninei este determinata atat de metionina cat si de cisteina. Daca acesti aminoacizi sunt in cantitati adecvate, SAM se acumuleaza. Daca cantitatea de metionina este mica SAM se va forma in cantitati mici, determinand homocisteinei acumulate sa se remetileze la metionina.
Catabolismul valinei, leucinei sim izoleucinei
Acesti aminoacizi fac parte din grupa celor reamificati, fapt care determina organismul uman sa nu ii poata sintetiza, find esentiali vietii prin aport alimentar. Catabolismul celor trei aminoacizi se initiaza in sange ducand la formarea NADH si FADH2, care sunt utilizati ulterior la formarea ATP. In primele doua etape ale catabolismului se utilizeaza aceleasi enzime pentru toti cei trei aminoacizi. Urmatoarele etape diverg, cu formarea a numerosi intermediari.
Principalul produs la catabolizarea valinei il reprezinta proprionil-CoA, precursorul gluconic al succinil-CoA. Izoleucina are ca principal produs catabolizat acetil-CoA, deci izoleucina are atat caracter glucogenic cat si cetogenic. Leucina, care formeaza atat acetil-CoA cat si acetoacetil-CoA este doar cetogenica.
De mentionat inca o data faptul ca numeroase boli genetice se datoreaza catabolismului defectuos al aminoacizilor esentiali.
Catabolismul fenilalaninei si tirosinei
Fenilalanina are practic doar doua posibilitati: incorporarea intr-un lant polipeptidic sau producerea de tirosina sub influenta fenilalanin hidroxilazei. In consecinta fenilalanina se va cataboliza doar la tirosina.
Tirosina este la fel de importanta pentru biosinteza proteinelor cat si ca intermediar in diverse alte biosinteze.
La fel ca si in cazul fenilcetonuriei, determinata de deficienta in fenilalanin hidroxilaza, deficienta in tirosin transaminazei determina aparitia excretiilor urinare de tirosina si a intermediarilor sai. Semnele clinice ale bolilor neurologice asociate sunt aceleasi in ambele cazuri.
Prima boala genetica recunoscuta, alcaptunuria; este determinata o modificari ale enzimei oxidaza acidului homogentisic, recunoscuta usor prin coloratia puternica a urinei la expunerea la aer.
Catabolismul lisinei
Catabolismul lisinei este neobisnuit deoarece gruparea a-amino este transferata a-cetoglutaratului si in general in bugetul azotului. Reactia este o transaminare in urma caruia rezulta ca metabolit saccaropina. Reactia mai are o caracteristica aparte in sensul ca nu foloseste drept cofactor piridoxal fosfat. Datorita faptului ca reactia nu este reversibila, lisina este un aminoacid esential. Produsul final al catabolismului lisinei este acetoacetil-CoA.
Lisina este un aminoacid important si esential in sinteza proteinelor, un deficit in aportul in organism determinand scaderea serioasa a sintezei proteinelor. Ea este de asemenea un precursor important in sinteza carnitinei, biomolecula necesara transportului acizilor grasi la mitocondrii pentru oxidare. Lisina libera nu serveste drept precursor al reactiei mai sus mentionate, deci ea trebuie transformata. Unele proteine sunt capabile sa modifice lisina la trimetillisina utilizand SAM drept donor de grupare metil. Hidroliza proteinelor care contin trimetillisina sunt cele care furnizeaza substratul necesar sintezei carnitinei.
Catabolismul histidinei
Catabolismul histdinei debuteaza cu eliminarea gruparii e-amino si formarea dublei legaturi in molecula, reactia fiind catalizata de prezenta histadazei. Produsul deaminat, urocanatul, se transforma in continuare, produsul final al catabolismului reprezentand glutamatul.
Histidina serveste drept sursa de azot ciclic care in combinatie cu tetrahidrofolatul (THF) duce la formarea intermediarului 1-carbon THF, care reprezinta una din caile de obtinere a N5-formimino-THF.
Absenta enzimei din prima reactie, histidaza, reprezinta principalul factor declansator al boli genetice in care este implicata histidina, histidinemia. Incidenta acesteia este destul de mare (1 la 10000), fiind relativ usor de depistat prin absenta urocantului din piele sau transpiratie, in care se gaseste relativ abundent.
Decarboxilarea histidinei in intestine de catre bacterii duce la formarea histaminei. Si alte tesuturi sunt capabile sa decarboxileze histidina la histamina, dar prezenta acesteia in exces determina constrictia sau dilatarea vaselor sanguine. Reactiile specifice ale organismului sunt cele ale astmei sau forme alergice.
Catabolizarea triptofanului
In timpul catabolizarii triptofanului la acetoacetat apar o serie de reactii secundare deosebit de importante. Prima enzima care intra in jocul catabolic este fier porfirin oxigenaza care determina deschiderea ciclului indolic. Ultima enzima folosita in acest catabolism creste in concentratie de pana la zece ori atunci cand dieta este bogata triptofan.
Kinurenina este primul intermediar de ramificare din aceasta cale catabolica. Kinurenia prin dezaminare duce la formarea acidului kinurenic. Acest acid si metabolitii lui actioneaza ca antiexcitante si anticonvulsive.
O a doua reactie de ramificare importanta duce la formarea acidului antranilic si a alaninei. Un alt echivalent al alaninei este produs in lantul principal al lantului metabolic, acesta fiind reactia care a permis clasificarea triptofanului atat ca aminoacid glucogenic, cat si cetogenic.
O alta ramificare a catabolismului converteste kinurenina in 2-amino-3-carboximuconic semialdehida, care are in structura doua grasimi. O etapa importanta se petrece in ficat unde prin transaminare si mai multe rearanjari se produc cantitati limitate de acid nicotinic, care va conduce la formarea NAD+ si NADP+.
Pe langa rolul lui de precursor in biosinteza proteica, triptofanul serveste de asemenea ca precursor la sinteza seritoninei si melatoninei.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |