Exista ecuatii de stare aproximative pentru gaze care pot da virtual orice grad de precizie dorit. Totusi nu exista ecuatii analoge de stare pentru solide si lichide. Din fericire volumul solidelor si lichidelor nu se modifica esential cu modificarea presiunii, daca aceasta modificare nu este prea mare. Aceasta situatie ne permite definirea unor parametrii si de a forma o ecuatie aproximativa care este valabila doar intr-un domeniu limitat de temperaturi si presiuni.
Ne vom limita la lichidele si solidele izotropice, adica vom exclude lichidele cristaline si solidele cristaline. Lichidele cristaline si solidele cristaline sunt anizotropice. Ele raspund la modificari de temperatura, dilatarea (expansiune) lor de-a lungul diferitelor axe ale cristalului fiind diferita. Multe solide, mai ales metalele si aliajele sunt conglomerate de cristale microscopice cu o orientare aleatorie astfel incat materialul se comporta ca un lichid izotropic chiar daca cristalele individuale sunt anizotrope. Vom putea astfel aplica metodele noastre izotropice la aceste materiale chiar daca trebuie sa recunoastem cristalinitatea acestora.
Volumul unei probe de material izotropic este dovedit experimental ca fiind o functie de temperatura si presiune; in consecinta putem scrie:
![]() (7.1)
(7.1)
(volumul este de asemenea o functie de numarul molilor din proba, dar ne vom referii doar la modificari ne esentiale astfel incat cantitatea de material ramane constanta.
Vom scrie o modificare diferentiala a volumului datorita modificarilor diferentiale ale temperaturii si/sau presiunii dupa cum urmeaza:
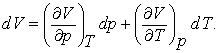 (7.2)
(7.2)
Modificarea relativa, sau modificarea fractionala, este atunci:
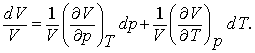 (7.3)
(7.3)
Coeficientii dp si dT in ecuatia (7.3) fiind asa de importanti incat au primit nume si simboluri speciale.
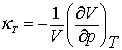 (7.4)
(7.4)
este denumit izoterma de compresibilitate. Indicele, T, de la litera greaca kappa este pentru a distinge aceasta compresabilitate de alta legata distincta si care va fi analizata ulterior. Atunci cand presiunea creste volumul descreste astfel decat derivarea ecuatiei (7.3) este negativa. Semnul negativ in definirea lui κT determina valoarea pozitiva a lui kappa. Daca nu exista nici un fel de dubii asupra acestui indice acesta poate fi omis din definirea lui kappa.
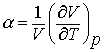 (7.5)
(7.5)
este definit drept coeficientul termic de expansiune (dilatare), uneori prescurtat drept coeficient de expansiune.
Valorile lui α si κT trebuie obtinute din date experimentale si ele pot fi gasite in tabele. α si κT sunt ele insele functii de temperatura si presiune, cu toate ca pot varia foarte incet odata cu modificare temperaturii sau presiunii insa ele pot fi considerate constante pentru intervale mici de variatie a temperaturii sau presiunii. In consecinta le vom considera constante in continuare.
U toate ca α si κT sunt mult mai utile pentru lichide si solide, ele pot fi calculate si pentru gaze. Volumul unui gaz este o functie strans legata de temperatura si presiune astfel incat α si κT nu sunt tocmai constante pentru gaze. Reprezinta mai degraba un exercitiu potrivit a fi aplicat derivatelor partiale pentru calcularea acestor entitati pentru gazul ideal. De exemplu, plecand de la ecuatia de stare a gazului ideal avem
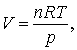
astfel incat
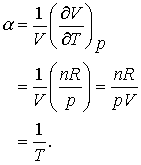 (7.6 a,b,c)
(7.6 a,b,c)
Aceasta cantitate este clar ca nu este o constanta. (Sa nu uitam ca aceasta este coeficientul de expansiune termica a gazului ideal si nu expresia generala a lui α.)
Ecuatia (7.3) se va putea scrie utilizand valorile α si κT
![]() (7.7)
(7.7)
care poate fi integrata pentru a da ecuatia aproximativa de stare a lichidelor si solidelor izotropice,
![]() (7.8)
(7.8)
unde Vo este volumul la presiunea po si temperatura To.
Mai exista o cantitate care poate fi obtinuta din α si κT, respectiv,
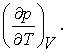
Aceasta este o derivata care ne spune cat de repede se ridica presiunea atunci cand mentinem volumul constant dar ridicam temperatura. Utilizand o varianta a regulii sirului Eugler putem scrie,
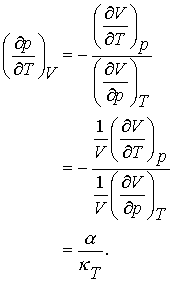 (7.9 a,b,c)
(7.9 a,b,c)
Hai sa aplicam aceasta pentru a observa ce presiune va fi generata intr-un termometru cu mercur atunci cand incercam sa incalzim termometrul la temperaturi mai inalte decat cele ale scalei sale. Pentru mercur Hg, α = 1.82 × 10−4 K−1 si κT = 3.87 × 10−5 atm−1. Deci putem scrie:
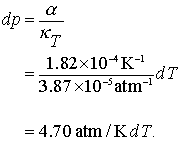 (7.10 a,b,c)
(7.10 a,b,c)
Observam ca pentru fiecare 1 oC presiunea creste cu 4.7 atm. Aceasta reprezinta o presiune imensa pentru tubul de sticla al termometrului, fiind suficiente cateva grade peste limita ca termometrul sa se sparga.
|
Politica de confidentialitate |
| Copyright ©
2025 - Toate drepturile rezervate. Toate documentele au caracter informativ cu scop educational. |
Personaje din literatura |
| Baltagul – caracterizarea personajelor |
| Caracterizare Alexandru Lapusneanul |
| Caracterizarea lui Gavilescu |
| Caracterizarea personajelor negative din basmul |
Tehnica si mecanica |
| Cuplaje - definitii. notatii. exemple. repere istorice. |
| Actionare macara |
| Reprezentarea si cotarea filetelor |
Geografie |
| Turismul pe terra |
| Vulcanii Și mediul |
| Padurile pe terra si industrializarea lemnului |
| Termeni si conditii |
| Contact |
| Creeaza si tu |